- •49 Петля Гистерезиса.
- •48. Электрическое поле в диэлектриках
- •47 Диполь в электрическом поле
- •46. Поле диполя
- •36. Распределение Больцмана
- •34. Распределение молекул по скоростям Максвелла.
- •Основное уравнение мкт
- •[Править]Вывод основного уравнения мкт
- •[Править]Уравнение среднеквадратичной скорости молекулы
- •27. Вынужденные колебания. Резонанс.
- •[Править]Осевой момент инерции
- •[Править]Теорема Гюйгенса-Штейнера
- •[Править]Осевые моменты инерции некоторых тел
- •16. Динамика вращательного движения
- •15. Вращение вокруг неподвижной оси
- •Определение
- •Основные понятия
- •[Править]Синхронизация времени
- •[Править]Линейность преобразований
- •[Править]Согласование единиц измерения
- •[Править]Изотропность пространства
- •[Править]Принцип относительности
- •[Править]Постулат постоянства скорости света
- •[Править]Непротиворечивость теории относительности
- •Третий закон Ньютона
- •[Править]Современная формулировка
- •4. Криволинейное движение
- •1 Кинематика поступательного движения
- •2. Кинематика вращательного движения.
Основное уравнение мкт
![]() ,
где k является постоянной
Больцмана (отношение универсальной
газовой постоянной R к числу
Авогадро NA), i —
число степеней свободы молекул (i =
3 в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T -
абсолютная температура.
,
где k является постоянной
Больцмана (отношение универсальной
газовой постоянной R к числу
Авогадро NA), i —
число степеней свободы молекул (i =
3 в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T -
абсолютная температура.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
[Править]Вывод основного уравнения мкт
Пусть имеется кубический сосуд с ребром длиной l и одна частица массой m в нём.
Обозначим
скорость движения vx,
тогда перед столкновением со стенкой
сосуда импульс частицы
равен mvx,
а после — − mvx,
поэтому стенке передается импульс p =
2mvx.
Время, через которое частица сталкивается
с одной и той же стенкой, равно ![]() .
.
Отсюда следует:
![]()
Так
как давление ![]() ,
следовательно сила F = p * S
,
следовательно сила F = p * S
Подставив,
получим: ![]()
Преобразовав: ![]()
Так как рассматривается кубический сосуд, то V = Sl
Отсюда:
![]() .
.
Соответственно, ![]() и
и ![]() .
.
Таким
образом, для большого числа частиц верно
следующее: ![]() ,
аналогично для осей y и z.
,
аналогично для осей y и z.
Поскольку ![]() ,
то
,
то ![]() .
Это следует из того, что все направления
движения молекул в
хаотичной среде равновероятны.
.
Это следует из того, что все направления
движения молекул в
хаотичной среде равновероятны.
Отсюда ![]()
или ![]() .
.
Пусть ![]() —
среднее значение кинетической энергии
всех молекул, тогда:
—
среднее значение кинетической энергии
всех молекул, тогда:
![]() ,
откуда
,
откуда ![]() .
.
Для
одного моля выражение примет вид ![]()
[Править]Уравнение среднеквадратичной скорости молекулы
Уравнение среднеквадратичной скорости молекулы легко выводится из основного уравнения МКТ для одного моля газа.
![]() ,
для 1 моля N = Na,
где Na — постоянная
Авогадро
,
для 1 моля N = Na,
где Na — постоянная
Авогадро
Nam = Mr, где Mr — молярная масса газа
Отсюда окончательно
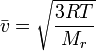
32. вантовая теория теплоёмкостей Эйнштейна − была создана Эйнштейном в 1907 году, при попытке объяснить экспериментально наблюдаемую зависимость теплоёмкости от температуры.
При разработке теории Эйнштейн опирался на следующие предположения:
-
Атомы в кристаллической решетке ведут себя как гармонические осцилляторы, не взаимодействующие друг с другом.
-
Частота колебаний всех осцилляторов одинакова.
-
Число осцилляторов в 1 моле вещества равно 3Na, где Na - число Авогадро.
-
Энергия их квантована:
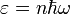 ,
, 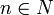
-
Число осцилляторов с различной энергией определяется распределением Больцмана:
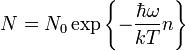
Внутренняя энергия 1 моля вещества:
![]() .
.
![]() находится
из соотношения для среднего значения:
находится
из соотношения для среднего значения:
![]()
и составляет:
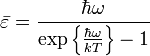 ,
,
отсюда:
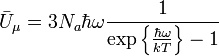 .
.
Определяя теплоёмкость как производную внутренней энергии по температуре, получаем окончательную формулу для теплоёмкости:
 .
.
31. Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Хотя модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высокихтемпературах, в других условиях её соответствие с опытом гораздо хуже. В частности, это проявляется в том, что реальные газы могут быть переведены в жидкое и даже в твёрдое состояние, а идеальные — не могут.
Для более точного описания поведения реальных газов при низких температурах была создана модель газа Ван-дер-Ваальса, учитывающая силы межмолекулярного взаимодействия. В этой модели внутренняя энергияU становится функцией не только температуры, но и объёма.
Уравнение состояния
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь междудавлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
![]()
где
-
p — давление,
-
V — молярный объём,
-
T — абсолютная температура,
-
R — универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка a учитывает силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь), поправка b — силы отталкивания (из общего объёма вычитаем объём, занимаемый молекулами).
Для ν молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
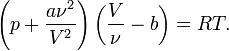
где
-
V — объём,
30. Закон Пуассона является законом распределения вероятностей, например, для следующих случайных величин.
а) Пусть на интервале ]0, N[ оси Ох случайно размещаются п точек независимо друг от друга, причем события, заключающиеся в попадании одной точки на любой наперед заданный отрезок постоянной (например, единичной) Длины, равновероятны.
Если ЙЙЙ , то случайная величина X, равная числу точек, попадающих на заданный отрезок единичной длины (которая может принимать значения О, 1, …, т, …)» распределяется по закону Пуассона.
б) Если п равно среднему числу вызовов абонентов, поступающих за один час на данную телефонную станцию, то число вызовов, поступающих за одну минуту, приближенно распределяется по закону Пуассона, причем а = /г/60.
Математическое ожидание и дисперсия случайных величин, распределенных по биномиальному закону и закону Пуассона, определяются по следующим формулам:
для биномиального закона: М(Х) = пр; D(X) = npq;
для закона Пуассона: М(Х) = а; D(X) = a.
29. Закон Бо́йля — Марио́тта — один из основных газовых законов, открытый в 1662 году Робертом Бойлем и независимо переоткрытый Эдмом Мариоттом в 1676 году. Закон является частным случаемуравнения состояния идеального газа.
Закон Бойля — Мариотта гласит:
При постоянной температуре и массе идеального газа произведение его давления иобъёма постоянно.
В математической форме это утверждение записывается следующим образом
pV = const,
где p — давление газа; V — объём газа.
28.
Уравнение
состояния идеального газа. (Уравнение
Менделеева—Клапейрона.)
Изопроцессы.
Состояние
данной массы газа полностью определено,
если известны его давление, температура
и объем. Эти величины называют параметрами
состояния газа. Уравнение, связывающее
параметры состояния, называют уравнением
состояния.
Для произвольной массы газа состояние
газа описывается уравнением
Менделеева—Клапейрона: pV = mRT/M, где р —
давление, V — объем, m — масса, М — молярная
масса, R — универсальная газовая
постоянная. Физический смысл универсальной
газовой постоянной в том, что она
показывает, какую работу совершает один
моль идеального газа при изобарном
расширении при нагревании на 1 К (R = 8,31
ДжДмоль • К)).
Уравнение Менделеева—Клапейрона
показывает, что возможно одновременное
изменение трех параметров, характеризующих
состояние идеального газа. Однако многие
процессы в газах, происходящие в природе
и осуществляемые в технике, можно
рассматривать приближенно как процессы,
в которых изменяются лишь два параметра.
Особую роль в физике и технике играют
три процесса: изотермический, изохорный
и изобарный.
Изопроцессом называют процесс,
происходящий с данной массой газа при
одном постоянном параметре — температуре,
давлении или объеме. Из уравнения
состояния как частные случаи получаются
законы для изопроцессов.
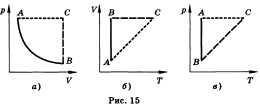
Изотермическим называют процесс,
протекающий при постоянной температуре.
Т = const. Он описывается законом
Бойля—Мариотта: pV = const.
Изохорным называют процесс, протекающий
при постоянном объеме. Для него справедлив
закон Шарля: V = const, p/T = const.
Изобарным называют процесс, протекающий
при постоянном давлении. Уравнение
этого процесса имеет вид V/T = const прир =
const и называется законом Гей-Люссака.
Все процессы можно изобразить графически
(рис. 15).
Реальные газы удовлетворяют уравнению
состояния идеального газа при не слишком
высоких давлениях (пока собственный
объем молекул пренебрежительно мал по
сравнению с объемом сосуда,