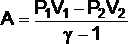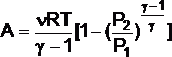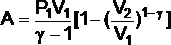- •Робота , потужність , коефіцієнт корисної дії
- •Питання
- •2.Енергія . Мех. Енергія
- •3.Кінетична енергія
- •4.Потенціальна енергія
- •Питання
- •5. Закони збереження та симетрія простору і часу
- •Питання
- •6. Удар
- •Центральний удар двох тіл
- •Абсолютно пружний удар
- •]Абсолютно непружний удар
- •Питання
- •Температура
- •Питання
- •7.Робота і теплота
- •Питання
- •8 . Перший принцип термодинаміки (ппт)
- •Питання
- •9. Застосування ппт до ізопроцесів в ідеальних газах
- •Теплоємність ідеального газу
- •Питання
- •10. Теплові і холодильні машини
- •11. Цикл Карно . 2 ппт
- •Питання
- •12.Потенціал
- •Питання
- •13. Напруженість
- •Питання
- •14. Індукція
- •15.Закон Джоуля Ленца
- •Питання
- •16.Дія електрики в електричному полі
- •17.Провідники в електричному полі
- •Питання
- •18 .Електричній струм у вакуумі
- •5. Будова й принцип дії електронно-променевої трубки та її застосування.
- •Питання
- •19.Електричній струм у металі
- •Питання
- •20.Електричній струм у газах
- •Питання
- •21.Будова ядра
- •Питання
Питання
-
що таке Перший Закон Термодинаміки ?
-
опишіть зміни внутрішньої енергії ?
-
напишіть формулу прирісту внутрішньої енергії
9. Застосування ппт до ізопроцесів в ідеальних газах
Ізопроцесом називається термодинамічний процес, при якому значення деякого термодинамічного параметра при сталій масі зберігається. Наприклад, Т=const ізотермічний, V=const ізохоричний, Р=const ізобаричний.
Ізотермічний процес ідеального газу процес, що переводить термодинамічну систему в різні рівноважні стани при сталій температурі й зв'язок між термодинамічними параметрами описується законом Бойля - Маріотта
![]() ,
,
де ![]() тиск
і об'єм газу після і-го ізотермічного
процесу.
тиск
і об'єм газу після і-го ізотермічного
процесу.
Ізобаричний процес ідеального газу процес, що переводить термодинамічну систему в різні рівноважні стани при сталому тискові й зв'язок між термодинамічними параметрами описується законом Шарля
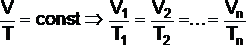 ,
,
де ![]() температура
й об'єм газу після і-го ізобаричного
процесу.
температура
й об'єм газу після і-го ізобаричного
процесу.
Ізохоричний процес ідеального газу процес, що переводить термодинамічну систему в різні рівноважні стани при сталому об'ємі й зв'язок між термодинамічними параметрами описується законом Гей-Люсака
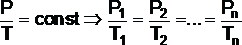 ,
,
де ![]() температура
й тиск газу після і-го ізохоричного
процесу.
температура
й тиск газу після і-го ізохоричного
процесу.
Об’єднаний газовий закон при будь-яких переходах ідеального газу з одного рівноважного стану в інший рівноважний стан виконується співвідношення виду
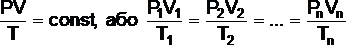 ,
,
де ![]() температура
й об'єм газу після і-го будь-якого
процесу.
температура
й об'єм газу після і-го будь-якого
процесу.
Закон Авогадро:
при однакових тисках і температурах у
рівних об'ємах різних ідеальних газів
міститься однакове число молекул або
теж саме: при однакових тисках і
температурах моль різних ідеальних
газів займає однаковий об'єм. За нормальних
умов (![]() t) моль
будь-яких ідеальних газів займає об'єм
t) моль
будь-яких ідеальних газів займає об'єм ![]() .
.
стану ідеального газу описується рівнянням Клапейрона - Менделєєва
![]() ,
,
де ![]() маса
газу,
маса
газу, ![]() його
молярна маса, а
його
молярна маса, а ![]() кількість
молів газу, R = 8. 31 Дж/(моль
К) - універсальна
газова стала.
кількість
молів газу, R = 8. 31 Дж/(моль
К) - універсальна
газова стала.
З рівняння Клапейрона - Менделєєва PV = RT витікає рівняння для тиску, яке співпадає з рівнянням, обчисленим у молекулярно-кінетичній теорії,
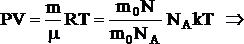
![]()
де ![]() маса
молекули, n=N/V -
концентрація частинок.
маса
молекули, n=N/V -
концентрація частинок.
Парціальний
тиск газу
в суміші - тиск,
який мав би цей газ, якщо б із суміші
були вилучені всі інші гази, а об'єм і
температура залишились би
попередніми. Закон Дальтона:
тиск суміші з N ідеальних
газів дорівнює сумі їх парціальних
тисків ![]()
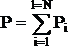 .
.
У випадку реальних газів існує декілька рівнянь стану, які описують його певну фізичну модель, наприклад, рівняння Ван-дер-Ваальса.
Таблиця . Характеристики ізопроцесів
|
Назва процесу |
Рівняння процесу |
Зв'язок між параметрами стану |
Робота в процесі |
Тепло, передане в процесі |
|
Ізохорний |
V = const |
|
A = 0, A = 0 |
Q = CVdT, Q=CV(T2 - T1) |
|
Ізобарний |
Р = const |
|
A = РdV, A = Р(V2 - V1) |
Q = CpdT, Q=Cp(T2 - T1) |
|
Ізотермічний |
T = const |
РV = const |
A = РdV, A
= RTln( A
= RTln( |
Q = A, Q = A |
|
Адіабатний |
Q = 0 |
PV = const
TV(- 1)=const |
A = pdV = - dU A = - U = CV(T1 - T2)
|
Q = 0, Q = 0 |