
- •1 Семестр
- •1701000000 Без объявл.
- •Электролитическая диссоциация для самоподготовки
- •Лабораторная работа № 2 электролитическая диссоциация
- •Приборы, посуда и реактивы
- •Порядок выполнения работы
- •Кинетика и химическое равновесие для самоподготовки
- •Лабораторная работа № 3 кинетика и химическое равновесие
- •Приборы, посуда и реактивы
- •Порядок выполнения работы
- •Запись данных опыта.
- •Произведение растворимости. Водородный показатель. Гидролиз солей
- •Приборы, посуда и реактивы
- •Порядок выполнения работы
- •Лабораторная работа № 6 окислительно-восстановительные реакции
- •Приборы, посуда и реактивы
- •Лабораторная работа № 7 электрохимия
- •Приборы, посуда и реактивы
- •Комплексные соединения
- •Комплексные соединения
- •Приборы, посуда и реактивы
- •Приложение
- •Специальности
- •020201 Фундаментальная и прикладная химия
- •1 Семестр
Лабораторная работа № 7 электрохимия
Цель работы: экспериментальное определение направления окислительно-восстановительных реакций, составление гальванических элементов и изучение их работы, экспериментальное изучение процессов электролиза и коррозии.
Приборы, посуда и реактивы
Химические стаканы вместимостью 100 см3 – 2 шт.,
электролитный мостик,
электролизер (U - образная трубка, закрепленная в штативе),
гальванометр,
электроды (грфитовые – 2 шт., цинковый, медный),
источник постоянного тока (6 В) или выпрямитель,
наждачная бумага,
медная и алюминиевая проволока,
металлические пластинки (медная, цинковая).
Растворы солей: сульфата меди (II), сульфата цинка с концентрацией 0.5 моль/дм3, сульфата хрома (III), иодида калия, сульфата натрия, сульфата цинка с концентрацией эквивалента 1 моль/дм3, сульфата калия, дихромата калия, тиосульфата натрия, хлорида натрия. Раствор серной кислоты, сульфита натрия.
Растворы нейтрального лакмуса, фенолфталеина.
Опыт 1. Направление окислительно-восстановительных процессов
Определите направление окислительно-восстановительной реакции:
Cr2(SO4)3 + K2SO4 + Na2SO4 + H2O = K2Cr2O7 + Na2SO3 + H2SO4
Внесите в пробирку по 2 – 3 капли растворов сульфата хрома (III) и сульфата калия и добавьте к ним 1 – 2 капли сульфата натрия. Происходит ли окисление хрома (III) Na2SO4, которое должно сопровождаться изменением окраски раствора?
В другую пробирку внесите по несколько капель растворов дихромата калия и серной кислоты, затем добавьте 3 – 4 капли Na2SO3. Почему раствор изменил цвет? В прямом или обратном направлении протекает данная окислительно-восстановительная реакция?
Запись данных опыта. Составьте уравнения полуреакций окисления и восстановления для протекающей окислительно-восстановительной реакции. Рассмотрите данную реакцию как процесс, протекающий при работе гальванического элемента. Выпишите значения соответствующих электродных потенциалов и вычислите ЭДС. Отметьте тот факт, что окислителем является окисленная форма гальванической пары, имеющая более высокий электродный потенциал, а восстановителем – восстановленная форма пары с меньшим электродным потенциалом.
Пользуясь электродными потенциалами, решите вопрос, возможна ли при стандартных условиях реакция:
MnO4- + Br2 + H+ = Mn2+ + BrO3- + H2O ?
Ответ мотивируйте.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вывод: ________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________
Опыт 2. Составление медно-цинкового гальванического элемента
В один из стаканчиков налейте на 2/3 раствор сульфата цинка, в другой – столько же раствора сульфата меди. Опустите в стаканчик с раствором соли цинка, цинковую пластинку, в раствор сульфата меди - медную. Соедините пластинки с клеммами гальванометра, замкните цепь, соединив стаканчики электролитным мостиком. Наблюдайте отклонение стрелки гальванометра.
Пример: медно-цинковый элемент
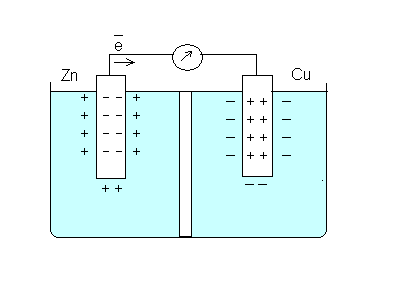
Zn2+ SO42–
ZnSO4 CuSO4
Запись данных опыта. Запишите уравнения реакции, протекающих на медном и цинковом электродах. Вычислите ЭДС гальванического элемента, исходя из значений стандартных электродных потенциалов. Сравните со значением практической ЭДС. Чем можно объяснить несовпадение значения ЭДС? Укажите на рисунке, какой металл является катодом (К), а какой анодом (А). В выводе напишите, за счет чего возникает электрический ток в гальваническом элементе?
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вывод: ________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________
Опыт 3. Электролиз раствора йодида калия
Налейте в электролизёр раствор йодида калия и добавьте 5-6 капель фенолфталеина. Опустите графитовые электроды. Пропустите электрический ток.
После проведения этого опыта электроды следует сначала промыть раствором тиосульфата натрия (для удаления йода), а затем - дистиллированной водой.
Запись данных опыта. Объясните появление окраски в катодном и анодном пространствах. Запишите уравнения реакций, протекающих на аноде и катоде и общее уравнение электролиза раствора иодида калия. В выводе укажите, какая реакция протекает при действии электрического тока?
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вывод: ________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________
Опыт 4. Коррозия металла в присутствии кислорода
Налейте в пробирку на 1/3 её вместимости раствор хлорида натрия, добавьте 5-6 капель раствор фенолфталеина и опустите в неё цинковую или алюминиевую проволоку.
Запись данных опыта. В какой цвет через некоторое время окрасится раствор вблизи поверхности металла? Какими ионами обусловлено появление окраски фенолфталеина? Какая часть проволоки является катодом, а какая – анодом? Составьте уравнения реакций катодного и анодного процессов.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вывод: ________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________
