
- •36.01.04. «Оборудование и технология высокоэффективных процессов обработки материалов» машиностроительного факультета.
- •Лабораторная работа №1 реагентные способы разделения сож
- •Лабораторная работа №2 влияние структурной неоднородности на кинетику электрохимической коррозии металлов
- •Лабораторная работа №3 оксидирование стали
- •3. Обработка опытных данных
- •4. Выводы
- •1. Теоретическая часть
- •1.1. Физико-химические свойства воды. Понятие – жесткость воды
- •1.2. Умягчение и обессоливание воды
- •2. Экспериментальная часть
- •2.1. Описание лабораторной установки
- •2.2. Методика проведения работы
- •2.2.1. Определение жесткости воды
- •2.2.2. Определение эффективности умягчения воды
- •2.3. Обработка результатов эксперимента
- •Жесткость питьевой артезианской воды после ее умягчения
- •Эффективность умягчения воды на ионитах в зависимости от ее расхода
- •3. Задание
- •Определение окисляемости природных и сточных вод
- •1. Теоретическая часть
- •1.1. Перманганатная окисляемость (метод Кубеля)
- •1.2. Бихроматная окисляемость
- •2. Экспериментальная часть
- •2.1. Определение степени загрязнения воды
- •2.2. Определение степени загрязнения методом бихроматной окисляемости
- •Лабораторная работа №6 определение общего содержания примесей в питьевой и сточной воде
- •1. Теоретическая часть
- •2. Экспериментальная часть
- •2.1. Определение общего содержания примесей, остатка при прокаливании и потерь при прокаливании
- •2.2. Определение растворённых веществ.
- •2.3. Определение взвешенных веществ.
- •2.4. Обработка результатов эксперимента
- •Во всех определениях необходимо округлять результаты до целых мг., а значение, превышающие 1000мг. – до 10 мг.
- •Определение нитратов в природных и сточных водах
- •1. Теоретические основы
- •1.1. Общие сведения и характеристика метода определения нитратов
- •1.2. Фотометрический метод анализа
- •2. Экспериментальная часть
- •2.1. Устройство и принцип работы фотоэлектроколориметра (кфк-2)
- •2.2. Методика проведения работы
- •2.2.1. Построение калибровочного графика.
- •2.2.2. Определение нитратов в пробах воды
- •2.3. Обработка результатов эксперимента
- •3. Задание
- •Определение фосфатов в природной и сточной воде
- •1. Теоретическая часть
- •2. Экспериментальная часть
- •3. Задание
- •Приложение
3. Задание
1. Определить жесткость:
-
питьевой воды сырой;
-
питьевой воды кипяченой и охлажденной;
-
питьевой воды сырой, обработанной содой (0,5 г
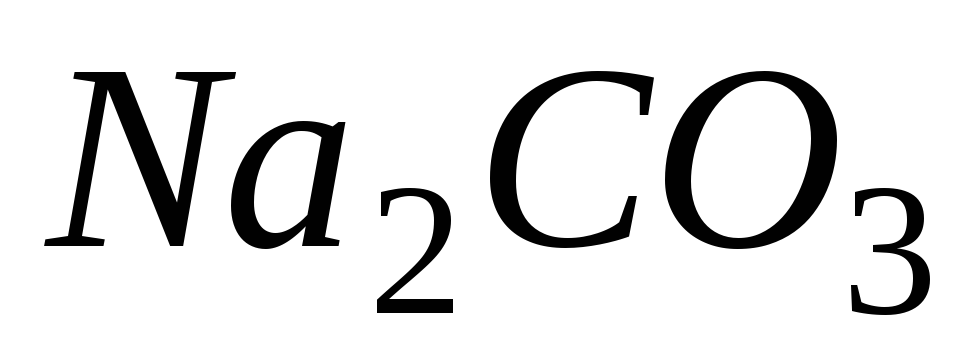 на 20 л) и осветленной (фильтрование
через бумажный фильтр);
на 20 л) и осветленной (фильтрование
через бумажный фильтр); -
питьевой воды кипяченой и охлажденной, обработанной содой и осветленной;
-
дистиллированной воды.
Определить жесткость воды в указанных пробах (в трех повторностях).
Сделать выводы об эффективности различных методов умягчения и дать оценку жесткости воды по наличию солей постоянной и временной жесткости.
2. Определить эффективность умягчения воды методом ионного обмена.
3. Определить эффективность умягчения (обессоливания) воды при ее различном времени контактирования с ионитами.
4. Построить
график зависимости
![]() и рассчитать оптимальное время
контактирования воды на фильтрующей
установке.
и рассчитать оптимальное время
контактирования воды на фильтрующей
установке.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Обессоливание и умягчение воды - общее и различие в методах обработки.
2. Требуется ли какая-либо дополнительная обработка воды перед ее катионированием и анионированием?
3. Самые дешевые и самые дорогие методы умягчения воды. Их эффективность.
4. Единицы измерения жесткости воды и их значения.
5. Что такое регенерация ионитов и как она осуществляется?
ТЕХНИКА БЕЗОПАСНОСТИ
1. Проверить исправность работы титровального прибора (индикатор света, работа перемешивающего устройства и пр.).
2. Проверить целостность стеклянной посуды.
3. Проверить работу водоструйного насоса.
4. Растворы отбирать соответствующей пипеткой.
5. Использовать в работе только чистую посуду.
ЛАБОРАТОРНАЯ РАБОТА № 5
Определение окисляемости природных и сточных вод
Цель работы – дать общую оценку качества воды (степени ее загрязнения) по перманганатной и бихроматной окисляемости.
1. Теоретическая часть
Общую оценку
загрязненности воды, как природной, так
и сточной, можно достаточно быстро
получить по ее окисляемости (ХПК –
химическая потребность в кислороде).
Под окисляемостью понимают количество
кислорода, необходимое для окисления
примесей, содержащихся в одном литре
(дм3) исследуемой воды (мг О2/л).
Окисляемость может быть общей, т.е.
показывать количество всех веществ в
воде, органических и минеральных, или
«окисляемость с поправкой», если
определяется содержание только
органических веществ. На практике при
анализе воды в качестве окислителя
используют не кислород, а растворы таких
сильных окислителей как перманганат
калия (![]() )
или бихромат калия (
)
или бихромат калия (![]() ).
Для удобства использования полученных
результатов их пересчитывают и
представляют в виде количества кислорода
эквивалентного израсходованному
окислителю. В зависимости от применяемого
окислителя различают окисляемость
перманганатную, бихроматную и др. Выбор
метода определения зависит от количества
загрязнений в воде и от их природы
(органические или минеральные). Так для
анализа питьевой воды и слабо загрязненных
поверхностных вод (окисляемость которых
не выше 100 мг О2/л) применяют
перманганатный метод. Для определения
общей окисляемости сильно загрязненных
и сточных вод (окисляемость 100 и более
мг О2/л) используют бихроматный
метод.
).
Для удобства использования полученных
результатов их пересчитывают и
представляют в виде количества кислорода
эквивалентного израсходованному
окислителю. В зависимости от применяемого
окислителя различают окисляемость
перманганатную, бихроматную и др. Выбор
метода определения зависит от количества
загрязнений в воде и от их природы
(органические или минеральные). Так для
анализа питьевой воды и слабо загрязненных
поверхностных вод (окисляемость которых
не выше 100 мг О2/л) применяют
перманганатный метод. Для определения
общей окисляемости сильно загрязненных
и сточных вод (окисляемость 100 и более
мг О2/л) используют бихроматный
метод.
Происхождение и содержание органических веществ, находящихся в природных водах, весьма разнообразны. Различны и их химические свойства по отношению к кислороду: одни вещества устойчивы к окислению, другие, наоборот, легко окисляются. Прямое определение органических веществ в природных водах является сложной и трудоемкой задачей. Поэтому пользуются более простыми косвенными методами. Метод перманганатной окисляемости дает представление о содержании в воде легко окисляющихся органических веществ. Метод бихроматной окисляемости соответствует полному окислению органических веществ (легко и трудно окисляющихся), за исключением некоторых белковых соединений. Обычно перманганатная окисляемость составляет 40–50 % от истинной окисляемости органических веществ, то есть полного окисления органического углерода до СО2.
Повышенная окисляемость может указывать на загрязнение воды. Наименьшую окисляемость (до 1–2 мг/л О2) имеют глубокие подземные воды, относящиеся к 1-му классу. Окисляемость подземных вод, относящихся ко 2-му и 3-му классам, может быть повышена, но не более 5 и 15 мг/л О2 соответственно. В грунтовых водах окисляемость обычно выше (до 2–4 мг/л), причем тем больше, чем выше цветность воды. Поэтому высокая окисляемость при небольшой цветности вероятнее указывает на загрязнение воды. В воде открытых водоемов окисляемость повышается до 5–6 мг/л в реках и до 6–8 мг/л в водохранилищах, достигая еще больших величин в водах болотного происхождения. Вода считается пригодной для хозяйственных и питьевых целей, если перманганатная окисляемость ее не превышает 3,0 мг/л О2. Установлено, что с повышением содержания в воде органических веществ увеличивается и ее бактериальное загрязнение.
Необходимо помнить, что при определении окисляемости воды, как перманганатной, так и бихроматной, аналитик получает условные сведения о качестве воды, указывающие лишь на химическую природу загрязнителей и их косвенное количество по израсходованному окислителю. Конкретного ответа о качественном составе загрязнителей, присутствующих в воде, окисляемость не дает. В то же время это всегда и необходимо. Так для определения оценки качества воды для различных категорий водопользования окисляемость является важнейшим показателем, т.к. дает возможность очень быстро получить ответ об общем состоянии воды в исследуемом объекте.
