
- •Конспект лекций по физике
- •Раздел 2 Молекулярная физика и термодинамика
- •Основы молекулярно-кинетической теории. Термодинамика
- •Основы молекулярно-кинетической теории. Основные положения молекулярно-кинетической теории. Сила и энергия взаимодействия молекул. Шкалы измерения температуры
- •Сила и энергия взаимодействия молекул
- •Контрольные вопросы:
- •Идеальный газ. Давление газа. Основное уравнение молекулярно-кинетической теории идеального газа
- •Контрольные вопросы:
- •Зависимость давления газа от температуры при постоянном объеме. Температура как мера средней кинетической энергии движения молекул
- •Связь между абсолютной температурой и кинетической энергией поступательного движения молекул
- •Контрольные вопросы:
- •Уравнение Клапейрона - Менделеева. Закон Дальтона
- •Количество молекул в 1 моле любого вещества одинаково и называется числом Авогадро:
- •2. 1 Моль любого газа при нормальных условиях занимает объём 22,4 дм3. (закон Авогадро).
- •Контрольные вопросы:
- •Изопроцессы и их графики
- •Контрольные вопросы:
- •Выберете правильный ответ на поставленный вопрос
- •Закон Максвелла о распределении молекул идеального газа по скорости и энергии теплового движения
- •Контрольные вопросы:
- •Барометрическая формула. Распределение Больцмана
- •Контрольные вопросы:
- •Реальные газы. Уравнение Ван-дер-Ваальса
- •Изотермы Ван-дер-Ваальса и их анализ. Критическое состояние вещества
- •Контрольные вопросы:
- •Среднее число столкновений и средняя длина свободного пробега молекул
- •Контрольные вопросы:
- •Выберите правильный ответ на поставленный вопрос
- •Основы термодинамики Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы
- •Изменение внутренней энергии тела в процессе теплообмена и совершения работы. Уравнение теплового баланса
- •Уравнение теплового баланса
- •Контрольные вопросы:
- •Первое начало термодинамики. Адиабатный процесс
- •Контрольные вопросы:
- •Выберите правильный ответ на поставленный вопрос
- •Работа газа. Круговой процесс. Кпд кругового процесса Работа газа при изменении объема
- •Контрольные вопросы:
- •Принцип действия тепловой машины. Цикл Карно
- •Кпд тепловой машины
- •Контрольные вопросы:
- •Необратимые процессы. Понятие о втором начале термодинамики
- •Контрольные вопросы:
- •Явления переноса в термодинамически неравновесных системах
- •Контрольные вопросы:
- •Выберите правильный ответ на поставленные вопросы:
- •Агрегатные состояния вещества и фазовые переходы
- •Свойства паров. Влажность воздуха. Способы определения влажности воздуха. Парообразование
- •Влажность воздуха. Точка росы. Способы определения влажности
- •Приборы для определения влажности воздуха
- •Контрольные вопросы:
- •Кипение.
- •Контрольные вопросы:
- •Характеристика жидкого состояния вещества.
- •Молекулярное давление поверхностного слоя жидкости
- •Энергия поверхностного слоя жидкости.
- •Поверхностное натяжение
- •Смачивание
- •Капиллярность
- •Контрольные вопросы:
- •Кристаллическое состояние вещества. Типы связей в кристаллах, виды кристаллических структур
- •Полиморфизм
- •Применение кристаллов
- •Жидкие кристаллы
- •Контрольные вопросы:
- •Механические свойства твердых тел
- •Закон Гука. Модуль упругости
- •Диаграмма растяжения твердого тела
- •Контрольные вопросы:
- •Тепловое расширение твердых тел.
- •Плавление и кристаллизация. Диаграмма фазовых состояний
- •Контрольные вопросы:
Контрольные вопросы:
-
Расскажите об опыте по определению зависимости давления газа от температуры и результатах этого опыта.
-
Изложите закон Шарля. Что такое температурный коэффициент давления?
-
Как температура газа связана с кинетической энергией молекул?
-
Как давление газа связано с его абсолютной температурой?
Уравнение Клапейрона - Менделеева. Закон Дальтона
За единицу количества вещества в системе СИ принят 1 моль.
Строго говоря, 1
моль – это количество вещества системы,
содержащей столько же элементов (молекул,
атомов, ионов и т.п.), сколько содержится
атомов в массе 0,012 кг изотопа углерода
![]() .
.
Вместе с тем, при решении задач удобнее применять следующее определение моля: молем (грамм - молекулой) называется количество вещества, масса которого в граммах равна его относительной молекулярной массе.
Моль газа обладает двумя свойствами:
-
Количество молекул в 1 моле любого вещества одинаково и называется числом Авогадро:
2. 1 Моль любого газа при нормальных условиях занимает объём 22,4 дм3. (закон Авогадро).
Нормальными условиями являются:
температура
![]() (t = 0°С) и давление
(t = 0°С) и давление
![]() =105
Па.
=105
Па.
Давление газа:![]() ;
;![]() ,
где N - число молекул в
объеме
,
где N - число молекул в
объеме
![]() .
.
![]()
![]() =
1,38
=
1,38![]() - постоянная Больцмана.
- постоянная Больцмана.
При постоянной массе газа число
молекул газа N неизменно,
поэтому
![]() - уравнение Клапейрона, в котором B
– газовая постоянная величина, различная
для разных газов.
- уравнение Клапейрона, в котором B
– газовая постоянная величина, различная
для разных газов.
Д.И. Менделеев объединил уравнение
Клапейрона с законом Авогадро, применив
молярный объем газов
![]() ,
который одинаков для различных газов
(при постоянных значениях p
и Т):
,
который одинаков для различных газов
(при постоянных значениях p
и Т):
![]() , где:
, где:![]() - универсальная газовая постоянная.
- универсальная газовая постоянная.
Общее число молекул газа
![]() ,
,
где g - число молей в
массе газа m. Число молей
газа также равно
массе всего газа
![]() ,
деленной на массу 1 моля газа
,
деленной на массу 1 моля газа
![]() :
:
![]()
![]() . Отсюда:
. Отсюда:
![]()
![]() -
-
- уравнение Клапейрона - Менделеева.
Уравнение Клапейрона-Менделеева
определяет соотношение давления,
объёма и абсолютной температуры любой
массы любого идеального газа.
Плотность газа:
![]() .
.
Закон Дальтона: если в сосуде находится смесь нескольких газов, не вступающих друг с другом в химические реакции, то эта смесь газов оказывает на стенки сосуда давление, равное сумме давлений, производимых каждым газом в отдельности, если бы он один занимал весь сосуд.
![]() ,
где
,
где
![]() –
парциальное давление.
–
парциальное давление.
Число Лошмидта – это число молекул, содержащихся в 1 м3
любого газа при нормальных условиях
![]() :
:
![]()
Контрольные вопросы:
-
Что такое моль газа? Какими свойствами он обладает?
-
Изложите уравнение Клапейрона-Менделеева. Какие параметры газа оно связывает?
-
Изложите закон Дальтона.
-
По какой формуле можно вычислить плотность газа?
-
Что такое число Лошмидта?
Изопроцессы и их графики
Процессы, при которых масса газа и один из его параметров остаются постоянными, называются изопроцессами (от греческого "изос" - равный, одинаковый). Для определенной массы газа:
![]() =
=
![]() Поскольку газ имеет три основных
параметра: давление p,
объем V и абсолютная
температура T, то
соответственно существуют и три
изопроцесса.
Поскольку газ имеет три основных
параметра: давление p,
объем V и абсолютная
температура T, то
соответственно существуют и три
изопроцесса.
И
![]()
![]() ,
,
тогда
![]() ,
или
,
или ![]()
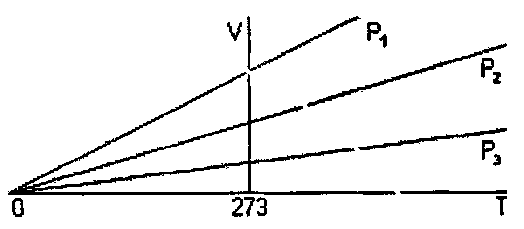
Давление газа прямо пропорционально его абсолютной температуре. Закон Шарля (рисунок 4). Линии на графике называются изохорами.
Изобарический (изобарный) процесс
- процесс в газе, который происходит при
постоянной массе и неизменном давлении
(от греческого "барос" - тяжесть.)
![]() ,
,
![]()
![]() или Объем газа прямо
пропорционален его абсолютной температуре.
Закон Гей-Люссака (рисунок 5).
или Объем газа прямо
пропорционален его абсолютной температуре.
Закон Гей-Люссака (рисунок 5).
![]()
Рисунок 5. График изобарического
процесса.
![]() .
Линия зависимости
.
Линия зависимости
![]() называется изобарой.
называется изобарой.
Изотермический процесс – процесс в газе, который происходит при постоянной массе и неизменной температуре. Т=const, тогда:
![]()
![]()
![]() ,
или:
,
или:
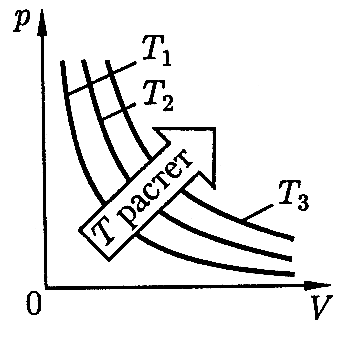
давление газа обратно пропорционально его объёму - закон Бойля-Мариотта (рисунок 6) , из которого следует, что:
![]() ,
где
,
где
![]() плотность
газа.
плотность
газа.
Рисунок 6. График
изотермического процесса. Линия
зависимости давления от объема
называется изотермой.
При изотермическом процессе плотность газа прямо пропорциональна давлению.
