
- •Конспект лекций по физике
- •Раздел 2 Молекулярная физика и термодинамика
- •Основы молекулярно-кинетической теории. Термодинамика
- •Основы молекулярно-кинетической теории. Основные положения молекулярно-кинетической теории. Сила и энергия взаимодействия молекул. Шкалы измерения температуры
- •Сила и энергия взаимодействия молекул
- •Контрольные вопросы:
- •Идеальный газ. Давление газа. Основное уравнение молекулярно-кинетической теории идеального газа
- •Контрольные вопросы:
- •Зависимость давления газа от температуры при постоянном объеме. Температура как мера средней кинетической энергии движения молекул
- •Связь между абсолютной температурой и кинетической энергией поступательного движения молекул
- •Контрольные вопросы:
- •Уравнение Клапейрона - Менделеева. Закон Дальтона
- •Количество молекул в 1 моле любого вещества одинаково и называется числом Авогадро:
- •2. 1 Моль любого газа при нормальных условиях занимает объём 22,4 дм3. (закон Авогадро).
- •Контрольные вопросы:
- •Изопроцессы и их графики
- •Контрольные вопросы:
- •Выберете правильный ответ на поставленный вопрос
- •Закон Максвелла о распределении молекул идеального газа по скорости и энергии теплового движения
- •Контрольные вопросы:
- •Барометрическая формула. Распределение Больцмана
- •Контрольные вопросы:
- •Реальные газы. Уравнение Ван-дер-Ваальса
- •Изотермы Ван-дер-Ваальса и их анализ. Критическое состояние вещества
- •Контрольные вопросы:
- •Среднее число столкновений и средняя длина свободного пробега молекул
- •Контрольные вопросы:
- •Выберите правильный ответ на поставленный вопрос
- •Основы термодинамики Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы
- •Изменение внутренней энергии тела в процессе теплообмена и совершения работы. Уравнение теплового баланса
- •Уравнение теплового баланса
- •Контрольные вопросы:
- •Первое начало термодинамики. Адиабатный процесс
- •Контрольные вопросы:
- •Выберите правильный ответ на поставленный вопрос
- •Работа газа. Круговой процесс. Кпд кругового процесса Работа газа при изменении объема
- •Контрольные вопросы:
- •Принцип действия тепловой машины. Цикл Карно
- •Кпд тепловой машины
- •Контрольные вопросы:
- •Необратимые процессы. Понятие о втором начале термодинамики
- •Контрольные вопросы:
- •Явления переноса в термодинамически неравновесных системах
- •Контрольные вопросы:
- •Выберите правильный ответ на поставленные вопросы:
- •Агрегатные состояния вещества и фазовые переходы
- •Свойства паров. Влажность воздуха. Способы определения влажности воздуха. Парообразование
- •Влажность воздуха. Точка росы. Способы определения влажности
- •Приборы для определения влажности воздуха
- •Контрольные вопросы:
- •Кипение.
- •Контрольные вопросы:
- •Характеристика жидкого состояния вещества.
- •Молекулярное давление поверхностного слоя жидкости
- •Энергия поверхностного слоя жидкости.
- •Поверхностное натяжение
- •Смачивание
- •Капиллярность
- •Контрольные вопросы:
- •Кристаллическое состояние вещества. Типы связей в кристаллах, виды кристаллических структур
- •Полиморфизм
- •Применение кристаллов
- •Жидкие кристаллы
- •Контрольные вопросы:
- •Механические свойства твердых тел
- •Закон Гука. Модуль упругости
- •Диаграмма растяжения твердого тела
- •Контрольные вопросы:
- •Тепловое расширение твердых тел.
- •Плавление и кристаллизация. Диаграмма фазовых состояний
- •Контрольные вопросы:
Контрольные вопросы:
-
Что такое идеальный газ?
-
Что такое давление газа и какие единицы измерения давления Вам известны?
-
Изложите основное уравнение молекулярно-кинетической теории газа (без вывода).
Зависимость давления газа от температуры при постоянном объеме. Температура как мера средней кинетической энергии движения молекул
Рассмотрим, как зависит давление газа
от температуры, если его объём и масса
остаются постоянными. Возьмём закрытый
сосуд с газом и поместим его в сосуд с
таящим снегом (Рисунок 3). Давление при
0°С обозначим
![]() .
Затем постепенно будем нагревать сосуд
с водой, и измерять температуру
термометром, а давление – манометром
М. График зависимости
.
Затем постепенно будем нагревать сосуд
с водой, и измерять температуру
термометром, а давление – манометром
М. График зависимости
![]() будет выглядеть в виде прямой линии
(рисунок 3а). Если продлить линию графика
влево, то она пересечёт ось температур
в точке А, соответствующей нулевому
давлению газа. Повторяя этот опыт для
разных масс (рисунок 3б), можно заметить,
что точка А для всех графиков одна и та
же, а именно - 273°С. Эту температуру, при
которой давление становится равным 0,
называют абсолютным нулем. Точное
значение абсолютного нуля: - 273,15°С.
будет выглядеть в виде прямой линии
(рисунок 3а). Если продлить линию графика
влево, то она пересечёт ось температур
в точке А, соответствующей нулевому
давлению газа. Повторяя этот опыт для
разных масс (рисунок 3б), можно заметить,
что точка А для всех графиков одна и та
же, а именно - 273°С. Эту температуру, при
которой давление становится равным 0,
называют абсолютным нулем. Точное
значение абсолютного нуля: - 273,15°С.

Рисунок 3 Эксперимент по определению зависимости давления газа от его температуры при постоянном объеме
Из подобия треугольников на рисунок
3а) можно записать:
![]() ,
отсюда
,
отсюда
![]() .
.
Если обозначить
![]() то
то
![]() ,
величина
,
величина
![]() называется температурным коэффициентом
давления. Температурный коэффициент
давления
называется температурным коэффициентом
давления. Температурный коэффициент
давления
![]() показывает, на какую часть давления
газа, взятого при 0°С, изменится его
давление при нагревании на 1 °С.
показывает, на какую часть давления
газа, взятого при 0°С, изменится его
давление при нагревании на 1 °С.
Единица измерения
![]()
![]() .
.
Температурный коэффициент давления
![]() не зависит от рода газа и равен
не зависит от рода газа и равен
![]() .
Из полученных графиков:
.
Из полученных графиков:
![]()
![]() Подставив эти выражения в
Подставив эти выражения в
![]() ,
получим
,
получим
![]() , или
, или
![]() - закон Шарля. Он справедлив только
для идеального газа.
- закон Шарля. Он справедлив только
для идеального газа.
Связь между абсолютной температурой и кинетической энергией поступательного движения молекул
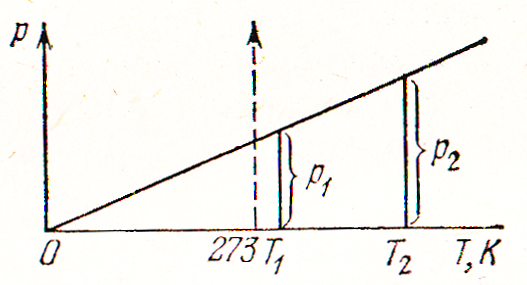
На рисунке 4 приведен закон Шарля в координатах давление р – абсолютная температура Т.
Рисунок 4. Зависимость давления газа
![]() от абсолютной температуры T.
от абсолютной температуры T.
Из подобия треугольников следует:
![]()
Между давлением p и его
абсолютной температурой Т существует
прямая пропорциональная зависимость
(рисунок 4). Но и между давлением p
и средне-кинетической энергией
поступательного движения молекул
![]() тоже существует прямая пропорциональная
зависимость. Это означает, что энергия
тоже существует прямая пропорциональная
зависимость. Это означает, что энергия
![]() прямо пропорциональна абсолютной
температуре газа T.
прямо пропорциональна абсолютной
температуре газа T.
![]()
![]() ,
,
где
![]() - постоянная Больцмана.
- постоянная Больцмана.
![]() =
1,38
=
1,38![]() ..
..
Среднее значение кинетической энергии поступательного движения молекул не зависит от рода газа, а определяется только его абсолютной температурой.
П
![]()
![]() в основное уравнение молекулярно-кинетической
теории, получим:
в основное уравнение молекулярно-кинетической
теории, получим:
.
Давление газа не зависит от рода газа, а определяется только концентрацией молекул no и абсолютной температурой газа Т.
Поскольку для данной температуры средние
значения энергии поступательного
движения молекул различных газов
одинаковы, можно записать:
![]()
![]()
При одинаковой температуре средние квадратические скорости молекул обратно пропорциональны корням квадратным из масс молекул.
