- •Билет 1
- •Билет 2
- •Билет 3
- •Гамк транс-фераза
- •Билет №9
- •Потенциал деятельности.
- •2. Дофамин.
- •Потенциал действия мышечных клеток сердца.
- •Дофамин в черной субстанции.
- •3. Гиппокамп.
- •Распространите пд.
- •Участие дофаминовых нейронов покрышки в работе больших полушарий.
- •Модификация синапсов как основа обучения: сравнительный анализ процессов, наблюдаемых в коре больших полушарий и коре мозжечка.
- •1. Впсп и Тпсп и Пд.
- •2. Серотонин.
- •Билет 21
- •1.Синтез медиаторов в теле нейрона.
- •2. Стресс.
- •Локомоция.
- •Билет №26
- •Билет №27
- •Билет №28
- •Билет №29
- •Билет №30
Билет 3
Внутриклеточные органоиды: разнообразие м функции в нервных клетках. ЭПС и комплекс Гольджи. Роль митохондрий и АТФ. Рибосомы и синтез белка.
1. Клеточная мембрана: два слоя липидов + встроенные белки (каналы, насосы, ферменты, рецепторы и др.)
2. Ядро: место хранения и репликации ДНК, образования РНК. и-РНК (копия того или иного гена), выходя из ядра, вступает в контакт с рибосомами, управляя сборкой соответствующ. белка.
Нуклеиновые кислоты (ДНК и РНК).
ДНК – несет генетическую информацию и передает ее потомству.
Передача потомству = репликация ДНК (размножение на молекулярном уровне).
Генетическая информация = информация о первичной структуре белков.
Ген – фрагмент молекулы ДНК, несущий информацию о структуре определенного белка. Всего ДНК человека (23 молекулы) содер-жит около 30 тыс. генов. Каждая молекула ДНК (хромосома) в обычных клетках присутствует в двух экземплярах: отцовском и материнском.
РНК выполняет вспомогательную функцию, обеспечивая превращение генетической информации в конкретные белки (и-РНК – связующее звено между ДНК и рибосомами).
3. Рибосомы: комплекс РНК и белков-ферментов; здесь идет синтез белка по «инструкции» и-РНК; в нейронах очень много рибосом (признак чрезвычайно активного обмена веществ).
4. Эндоплазматическая сеть (ретикулум): ЭПС – система тонких разветвленных мембранных каналов, пронизывающая всю цитоплазму; транспортная функция.
5. Комплекс Гольджи: система плоских мемб-ранных цистерн; здесь происходит накопление веществ и их упаковка в пузырьки-везикулы («почкование» везикул).
Далее везикулы направля-ются к клеточной мембра-не и сливаются с нею. В результате происходит выброс (экзоцитоз) содержимого пузырьков в межклеточную среду. Таким путем осуществля-ется выделение пищева-рительных ферментов, гормонов, медиаторов.
6. Митохондрии (м/х): «электро-станции» клетки (в нейронах – боль-шое кол-во м/х); здесь завершается окисление органических веществ (прежде всего, глюкозы); при этом расходуется О2, выделяется СО2 и из АДФ образуется АТФ.
АТФ – универсальный внутриклеточный переносчик энергии; в организме человека ежедневно синтезируется и распадается более 50 кг этого вещества
АТФ – аденозинтрифосфорная к-та АДФ – аденозиндифосфорная к-та
АДФ + фосфорная к-та ® АТФ (реакция запасания энергии; ею управляют особые дыхательные фер-менты, расположенные на складках-кристах внутренней мембраны м/х)
АТФ ® АДФ + фосфорная к-та (реакция выделения энергии; идет в любой части клетки, где необходимо «привести в действие» белки-насосы, ферменты и т.п.)
Роль норадреналина (НА) в деятельности симпатической нервной систем: строение и работа НА-синапсов, типы и подтипы рецепторов, аутоторможение.
Полностью 6 лекция
Вкусовые и обонятельные рецепторы; вкусовые и обонятельные центры головного мозга. Центры кожной и мышечной чувствительности таламуса и коры.
Вкусовые центры продолговатого мозга и моста (сигналы от языка VII и IX н.; от глотки – X н.):
в зависимости от «хорошего» и «плохого» вкуса запускаются пищевые либо оборонительные реакции.
«Хороший» вкус (рецепторы глюкозы и Glu; биологически полезные вещества): сосание, жевание, глотание, выделение желудочного сока и «густой» слюны с пищеварительными ферментами (парасимпатическая реакция).
«Плохой» вкус (рецепторы горького – растительные токсины; избыток кислого и соленого): выплевывание, плач, рвота, выделение большого количества жидкой слюны (смыть «эту гадость»; симпатическая реакция).
Вестибулярная информация (информация о положении тела в пространстве) необходима для оперативной коррекции движений; в связи с этим она очень быстро расходится по 4-м направлениям:
-
через таламус в кору (управление произвольными движениями);
-
в мозжечок (управление автоматизированными движениями);
-
в глазодвигательные центры среднего мозга;
-
в спинной мозг (вестибуло-спинальные тракты).
Билет 4
Клетки скелетных мышц, сердца, гладких мышц: особенности строения, сокращения, проведения сигнала и связей с нервной системой
Электрический синапс: прямая передача электрического возбуждения. Основная область электрическ. синапса – «щелевой контакт», в котором мембраны клеток находятся на расстоянии 2 нм (хим. синапс – 20-30 нм). В мембраны друг напротив друга встроены каналы-коннексоны (каждый состоит из 6 белков-коннексинов). Через коннексоны легко движутся любые ионы, что позволяет ПД напрямую перехо-дить с клетки на клетку.
Наиболее яркий пример работы коннексонов в нашем организме – сер-дечная мышца. Следует особо отметить, что мышечные клетки всех типов обладают ПП и генерируют ПД, кото-рые необходимы для запуска сокращения (взаимное скольжение белковых нитей актина и миозина с затратой энергии АТФ).
ПД поперечно-полосатой мышечной клетки близок к ПД нейрона: от ПП=-80 мВ вверх до +40 мВ; длительность 1-2 мс; сначала вход Na+, затем выход К+.
ПД сердечного волокна гораздо более длительный: от ПП=-90 мВ вверх до +20 мВ; длительность 200-400 мс; сначала вход Na+, затем – плато, и лишь затем (из-за нараста-ющего выхода К+) – возврат в ПП.
ПД мышечной клетки сердца и его стадии:
0 – деполяризация
1 – быстрая реполяризация
2 – плато
3 – окончательная реполяризация
4 – восстановление ПП
Причина плато – входящий ток ионов Са2+, который на время уравновешивает выход К+.
Ионов Са2+ в сотни и тысячи раз больше в межклеточной среде (по сравнению с цитоплазмой); на многих клетках (сердце, гладкие мышцы, нейроны) имеются электрочувствительные Са2+-каналы.
При их открывании начинается вход Са2+ (в клетку вносится положительный заряд плюс влияние Са2+ на активность многих белков); закрывание каналов – при возврате к ПП. ПД с плато регистрируется у «рабочих» клеток сердца; назначение плато – дать войти в цитоплазму порции Са2+, который запустит сокращение (взаимное скольжение нитей актина и миозина); у пейсмекеров сердца нет фазы плато, ПД гораздо более короткий; суммарный ПД всех клеток сердца – электрокардиограмма (ЭКГ); распространение ПД по сердцу – за счет электрических синапсов; параметры ПД клеток гладких мышц – между параметрами ПД сердца и скелетных мышц; вход Са2+ наблюдается, но слабее.
Основное скопление клеток-пейсмекеров сердца – в верхней части правого пред-сердия («водитель сердечного ритма»). Отсюда ПД распрост-раняется сначала по предсердиям, потом по желудочкам. Пейсмекеры сердца – видоизмененные мышечные клетки.
У электрических рыб (например, электрического угря) имеются особые видоизмененные мышечные клетки – электроциты. Они собраны в «батарею», способную генерировать разряд в сотни Вольт. Этот разряд – суммарный ПД электроцитов.
Для описания электрических процессов в нервных клетках часто используется понятие «проводимость» того или иного иона (g); оно означает, по сути, количество открытых каналов, пропускающих данный ион; для сдвига равновесия процессов на мембране достаточно изменить g одного из ионов (например, увеличение g для К+ приведет к гипер-поляризации, а для Na+ и Са2+ – к деполяризации);
В реальном мозге электрической стимуляции, конечно, нет; вместо нее – пейсмекеры, действие сенсорных стимулов на рецепторы и (в подавляющем большинстве случаев) выделение возбуждающих медиаторов в синапсах.
Постсинаптич. мембрана мышечной клетки складчатая, что увеличивает кол-во никотино-вых рецепторов; от поверхности клетки внутрь цитоплазмы идут особые каналы – Т-трубочки.
1. Приход ПД приводит к экзоцитозу Ацх и активации никотиновых рецепторов
2. На мембране мышечной клетки возникает ПД, распространяю-щийся внутрь Т-трубочек.
3. ПД приводит к выбросу из ка-налов ЭПС, контактирующих с Т-трубочкой, ионов Са2+.
4. Са2+ запускает взаимное скольжение нитей актина и миозина, приводящее к сокра-щению мышечной клетки.
3. ПД приводит к выбросу из ка-налов ЭПС, контактирующих с Т-трубочкой, ионов Са2+.
4. Са2+ запускает взаимное скольжение нитей актина и миозина, приводящее к сокра-щению мышечной клетки.
Гладкие мышечные клетки:
Сократимые, слабо утомляемые эле-менты стенок внутренних органов (в перв. очередь, полых: сосуды, ЖКТ, бронхи, мочеточники, матка и др.).
Сокращения могут быть кратковремен-ными (матка), ритмическими (кишеч-ник), тоническими (сосуды).
Сокращение запускается ПД, который может возникать в результате:
-
срабатывания химического синапса;
-
активности клеток-пейсмекеров;
-
распространения возбуждения через щелевые контакты.
ПД, а также медиаторы (NЕ, Ацх) и гормоны вызывают открывание Са2+-каналов; в гладкомышечную клетку входит Са2+, запускающий движение белковых нитей актина и миозина.
Длительность ПД = 20-30 мс; фаза плато и вход Са2+ выра-жены слабее, чем в сердце (значительная часть Са2+, в отличие от сердца, входит через хемочувствит. каналы).
Управление работой сердца:
С клетками-пейсмекерами («води-телями ритма») контактируют как симпатич., так и парасимпатич. волокна; выделяя NЕ и Ацх, они регулируют соотношение постоянно открытых Na+ и К+-каналов, управляя частотой сердцебиений. С «рабочими» клетками сердца контактируют только симпатич. волокна; выделяя NЕ, они увеличивают открывание Са2+-каналов. В результате на фазе плато в мышечную клетку входит больше Са2+, и сокращение усиливается. В целом симпатич. НС учащает и усиливает сокращения; аналогич-ным образом действует выделяемый надпочечниками адреналин
Парасимпатич. НС в ос-новном лишь урежает со-кращения сердца (вплоть до полной остановки). Стимуляция симпатич. нервов: частота разрядов пейсмекера растет за счет увеличения Na+-про-водимости и снижения К+-проводимости.
Пресинаптические эффекты NЕ.
Эти эффекты идут, прежде всего, через a2-рецепторы и носят тормозный знак: ослабление активности Са2+-каналов и снижение экзоцитоза медиатора
Два основных варианта:
- самоторможение («аутоторможение») выброса NЕ из пресинаптического окончания (экономия медиатора,что особенно важно в условиях длительного стресса);
- торможение выброса Ацх из пресинаптического окончания (один из уровней конкуренции влияний симпатической и парасимпатической систем на внутренние органы).
Симпатическая система повышает тонус мышечных клеток в стенках большинства сосудов (происходит сжатие сосудов). Но известно, что в работающих мышцах, сердце, мозге кровоток возрастает («кровь прилила к мозгу»). Это заслуга не ВНС, а местных процессов (определенные вещества-регуляторы вызывают расслабление гладкомышечных клеток). Следовательно, ВНС не нужно знать, например, в какой из 400 мышц нашего организма при определенном виде движений требуется усилить кровоток – все происходит «само собой» за счет местных факторов. Так, сосуды головного мозга наиболее чувствительны к содержанию СО2 в крови: при росте – расширение, при гипервентиляции – сужение (парадок-сальный эффект). Расширение вызывают также ионы К+, Н+ и аденозин (продукт распада АТФ). Дефицит О2 в мозге (ишемия) приводит к общему расширению сосудов (через сосудодвигательный центр продолговатого мозга и моста).
Ацетилхолин и норадреналин: медиаторная функция в ЦНС (регуляция уровня бодрствования, болевой чувствительности, эмоционального состояния и др.)
Центры вестибулярной чувствительности, слуха и зрения головного мозга (таламус, кора, продолговатый мозг и мост, четверохолмие, супрахиазменные ядра и др.)
Вестибулярные и слуховые ядра – по углам ромбовидной ямки; вестиб. ядра ме-диальнее, как эволю-ционно более древние.
Далее слуховая информация идет в средний мозг (нижние холмики ч/х) и таламус; у дельфинов и летучих мышей здесь – центры эхолокации; у нас – сравнение сигналов от правого и левого уха, определения направления на источник сигналов.
В последнем случае возможен запуск ряда врожденных рефлексов: ровная установка головы («ребенок начинает держать голову», органы зрения и слуха приводятся в оптимальное положение); экстренное распрямление конеч-ностей при потере равновесия (рассчитан на четвероногих; у чело-века рефлекторное разгибание рук при падении увеличивает вероятность травмы); другие разгибат. движе-ния (например, при локомоции). Вестибулярные ядра: информация от мешочков и полукружных каналов
Слуховые ядра: от улитки
5-1. Симпатическая нервная система: функции, анатомическая организация, особенности работы синапсов, примеры влияния на внутренние органы.
Вегетативная нервная система (ВНС) – часть нервно системы, управляющая работой внутренних органов. Делится на: симпатическую нервную систему и на парасимпатическую нервную систему.
Симпатическая НС: эрготропная функция (управляет органами в ситуации затраты энергии: физич. и эмоц. нагрузка, стресс, бегство, нападение).
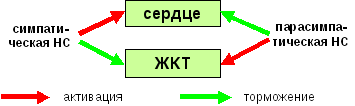
Таким образом, органы, активные во время стресса, возбуждает симпатическая система и тормозит парасимпатическая (пример: сердце).
Органы, обеспечивающие восстановление сил, напротив, возбуждает парасимпатическая система и тормозит симпатическая (пример: все отделы и железы желудочно-кишечного тракта – ЖКТ).
Анатомически две части ВНС разобщены: симпатич. нейроны лежат в боковых рогах сер. в-ва грудных и верхних поясничн. сегментов спинного мозга; парасимпатич. – в крестцовых сегментах и головном мозге.

Все внутренние органы также можно разделить на 4 группы («этажа»): [1] органы головы (железы, мышцы зрачка и хрусталика), [2] грудной клетки (сердце, бронхи), [3] брюшной полости (ЖКТ), [4] органы таза (мочеполовая система, нижняя часть ЖКТ).
Кроме того, на всех «этажах» есть сосуды.
Основные эффекты: конкурируют с парасимпатич. + сужение большинства сосудов, потоотделение, выделение адреналина надпочечниками и др.
Автономная (вегетативная) система из нервной системы выделена в связи с особенностями ее строения и функций. Вегетативная {автономная) нервная система регулирует работу внутренних органов. Она управляет активностью гладкой и сердечной мускулатуры, а также желез, координируя их деятельность. Человек не может сознательно управлять работой этой системы, т. е. она непроизвольная. Вегетативная часть нервной системы осуществляет иннервацию всех обменных процессов в теле человека, поддерживает постоянство внутренней среды, координирует функции внутренних органов, желез, сердечно-сосудистой системы.
Структурными отличиями автономной части нервной системы от соматической нервной системы являются очаговое расположение вегетативных центров (в трех отделах мозга), наличие вегетативных нервных узлов (скоплений тел нервных клеток) в нервных сплетениях, двухнейронность эфферентного нервного пути от мозга до рабочего органа, отсутствие сегментарности.
Автономную нервную систему на основании строения, топографии вегетативных ядер в спинном и головном мозге, а также особенностей функции подразделяют на симпатическую и парасимпатическую части.
Симпатическая часть вегетативной нервной системы иннервирует все органы и ткани тела человека — кожу, мышцы, внутренние органы, кровеносные и лимфатические сосуды и другие структуры.
И симпатическая, и парасимпатическая части имеют центральные отделы в виде ядер (скоплений клеток вегетативной природы), расположенных в различных отделах мозга, и периферический отдел. Периферический отдел вегетативной нервной системы включает находящиеся за пределами мозга (вне полости черепа и позвоночного канала) вегетативные нервы, нервные волокна, узлы (ганглии), вегетативные сплетения и нервные окончания.
У симпатической части к центральному ее отделу принадлежат ядра, расположенные в боковых рогах спинного мозга с VIII шейного (I грудного) по II поясничный сегмент. К периферическому отделу симпатической части относятся парный
симпатический ствол, расположенный по сторонам от позвоночного столба (справа и слева) с его соединительными ветвями (белыми и серыми); нервы, идущие от симпатического ствола к внутренним органам и сосудам, к крупным симпатическим сплетениям, находящимся в брюшной полости и в полости таза, нервные окончания симпатической природы.
Симпатические нервные сплетения располагаются на брюшной аорте, на передней поверхности крестца и состоят из групп нервных узлов, подходящих к ним и отходящих от них нервов. К числу наиболее крупных сплетений относится чревное (солнечное) сплетение, расположенное вокруг чревного ствола. Из узлов этого сплетения отходят симпатические волокна, иннервирующие почти все органы брюшной полости. Симпатические волокна, отходящие от симпатического ствола, идут также в составе всех спинномозговых и черепных нервов. Существуют и самостоятельные симпатические нервы — сердечные, сонные, пищеводные, легочные, осуществляющие симпатическую иннервацию сердца, органов головы, шеи, грудной и брюшной полостей. Симпатическая нервная система иннервирует все ткани и органы тела человека.
Медиатором (химическим посредником передачи возбуждения) окончаний симпатических нервных волокон в большинстве случаев является норадреналин. Под его влиянием увеличивается ритм и сила сердечных сокращений, происходит сужение сосудов, расширение зрачка, снижение секреции желез желудка и кишечника, расслабление гладкой мускулатуры кишечника.
Таким образом, в отличие от других органов и частей тела, внутренние органы получают двойную вегетативную иннервацию: и симпатическую, и парасимпатическую. Обе эти части вегетативной нервной системы действуют на одни и те же внутренние органы, создавая наиболее оптимальный режим их работы. В зависимости от жизненных обстоятельств, от величины функциональных нагрузок вегетативная нервная система или усиливает функции тех или иных внутренних органов, включая работу сердца, или ослабляет их. При этом в каждый момент в соответствии с потребностями организма большую активность в отношении внутренних органов проявляет или симпатическая, или парасимпатическая части вегетативной нервной системы. Что касается остальных органов и тканей (опорно-двигательного аппарата, кожи с ее структурными элементами, стенок сосудов и др.), все обменные процессы в них регулирует симпатическая часть вегетативной нервной системы.
Координацию работы всех отделов вегетативной нервной системы осуществляют гипоталамус и кора большого мозга.
Симп. система: ганглии образуют идущие вдоль спинного мозга цепочки; часть постганглионарн. нейронов находится в чревном (celiac)и брыжеечных (mesenteric) ганглиях.
Управление работой сердца: с клетками-пейсмекерами («водителями ритма») контактируют как симпатич., так и парасимпатич. волокна; выделяя NЕ и Ацх, они регулируют соотношение постоянно открытых Na+ и К+-каналов, управляя частотой сердцебиений.
С «рабочими» клетками сердца контактируют только симпатич. волокна; выделяя NЕ, они увеличи-вают открывание Са2+-каналов. В результате на фазе плато в мышечную клетку входит больше Са2+, и сокращение усиливается.
В целом симпатич. НС учащает и усиливает сокращения; аналогичным образом действует выделяемый надпочечниками адреналин.
Стимуляция симпатич. нервов: частота разрядов пейсмекера растет за счет увеличения Na+-проводимости и снижения К+-проводимости.
5-2. Синтез ацетилхолина (Ацх). Ацетилхолинэстераза и инактивация Ацх. Эффекты блокаторов Ацх-эстразы. Миастения и ее лечение.
По химическому строению ацетилхолин представляет собой соединение двух молекул — азотсодержащего холина и остатка уксусной кислоты.
Синтез ацетилхолина осуществляется в основном в пресинаптических окончаниях с помощью фермента холин ацетил-трансферазы. Затем медиатор переносится в пустые везикулы и хранится в них до момента выброса.
Появление ПД запускает выброс Ацх в синаптическую щель, после чего он действует на рецепторы постсинаптической мембраны.
Инактивация Ацх происходит с помощью фермента ацетилхолинэстеразы. Ацх-эстераза расположена на постсинаптической мембране и в синаптической щели. Она очень быстро «разрывает» Ацх на холин и остаток уксусной кислоты (ацетат). На следующем шаге холин переносится с помощью особого белка-насоса обратно в пресинаптическое окончание и вновь используется для синтеза Ацх.
Блокаторы Ацх-эстеразы активируют передачу сигнала в ацетилхолиновых синапсах, вызывая в больших дозах судороги (нервно-мышечные синапсы), спазм бронхов и остановку сердца (парасимпатические синапсы).
Примеры блокаторов:
-токсин малабарских бобов эзерин (физостигмин);
-фосфорорганические инсекти-циды (хлорофос, дихлофос и т.п.; могут вызывать токсикоманию);
-боевые нервно-паралитические газы (зарин, табун).
Пиридостигмин (на основе эзерина): лекарственное средство при миастении (50 на 1 млн.; аутоиммунное заболевание: антитела атакуют никотиновые рецепторы; развивается мышечная слабость, вялость, быстрая утомляемость; характерн. признак – опущенные веки). Основное лечение – иммуносупрессия.
Пиридостигмин и сходные препараты (амиридин), а также ряд агонистов ацетилхолина используются для лечения болезни Альцгеймера – самого распространенного нейродегенеративного заболевания, при котором первыми страдают Ацх-нейроны больших полушарий.
5-3. Экстрапирамидная система: функции основных структур и трактов. Рубро-, вестибуло- и ретикулоспинальные тракты. Тектоспинальный тракт.
Руброспинальный тракт – предшественник кортико-спинального (пирамидного) тракта; еще не способен обеспечить тонкое управление моторикой пальцев, может лишь вызвать совместное (си-нергичное) их сгибание. Руброспиный тракт – часть так называемой экстрапирамидной системы управления движениями, в которую входят также вестибуло-спинальный и ретикуло-спинальный тракты.
Руброспинальный тракт – сгибание конечностей (в том числе при локомоции – то есть ходьбе, беге и т.п.). Вестибулоспинальный тракт –разгибание конечностей (рефлексы, локомоция).Ретикулоспинальные тракты – идут от РФ, сгибание и разгибание туловища (самые древние двигательные тракты, с их помощью плавают рыбы).
6-1. Парасимпатическая нервная система: функции, анатомическая организация, особенности работы синапсов, примеры влияния на внутренние органы.
Парасимп. система: ганглии рядом с органами или в стенках органа.
Парасимпатическая часть иннервирует только внутренние органы, которые, таким образом, имеют двойную вегетативную иннервацию — и симпатическую, и парасимпатическую. Все остальные органы и ткани получают только симпатическую вегетативную иннервацию.
У парасимпатической части нервной системы центральный отдел расположен в стволе головного мозга в виде ядер черепных нервов (глазодвигательного, лицевого, языкоглоточного, блуждающего) и в боковых рогах крестцовых сегментов спинного мозга (с II по IV).
Периферический отдел парасимпатической части нервной системы представлен нервными волокнами в составе черепных и тазовых нервов, нервными узлами, расположенными в стенках внутренних органов или в непосредственной близости от органов, нервными окончаниями парасимпатической природы. Ко многим внутренним органам парасимпатические волокна идут в составе блуждающих нервов (X пара черепных нервов). Этот нерв иннервирует почти все органы грудной и брюшной полостей. Половые органы, мочевой пузырь и конечная часть толстой кишки получают парасимпатическую иннервацию из крестцового отдела спинного мозга.
Медиатором, образующимся в окончаниях парасимпатических нервных волокон, является ацетилхолин, который уменьшает ритм и силу сердечных сокращений, суживает
просвет бронхов, усиливает желудочно-кишечную перистальтику, активизирует секрецию желез желудка, кишечника, поджелудочной железы, суживает зрачок.
Парасимпатич. НС в ос-новном лишь урежает со-кращения сердца (вплоть до полной остановки).
6-2. Синтез моноаминов (норадреналина, дофамина, серотонина, гистамина). Инактивация моноаминов, роль МАО-А и МАО-Б, применение блокаторов МАО.
Норадреналин, дофамин, серотонин, гистамин в связи с особенностями химического строения относят к моноаминам – производ-ным аминокислот (пищевых), потерявших СО2 (декарбоксилирование). Это обуславливает сходство ряда их свойств и, прежде всего, наличие общих путей синтеза и инактивации.
На стадии дофамина реакция останавливается в нейронах:
А) черной субстанции среднего мозга
(аксоны идут в базальные ганглии)
Б) вентральной покрышки среднего
мозга (аксоны идут в кору б. п/ш.)
В) гипоталамуса (короткие аксоны,
локальные влияния и нейро-
эндокринная функция).
Жизненный цикл DA:
1. Синтез в пресинаптическом окончании и экзоцитоз при приходе ПД
2. Действие на постсинаптичес-кие рецепторы, связанные с G-белками.
3. Действие на пресинаптические рецепторы: аутоторможение экзо-цитоза (как и в случае NE).
4. Инактивация: обратный захват и последующее повторное использование либо разрушение с помощью МАО.
МАО – фермент моноаминоксидаза; расщепляет самые разные моноамины, в т.ч. медиаторы и гормоны.
Особая группа препаратов, влияющая на работу DA-синапсов: амфетамин и его производные.Эти вещества относятся к группе психомоторных стимуляторов и действуют преимущественно на пресинаптическом уровне.
Амфетамины:
-
ослабляют обратный захват DA и даже обращают работу белков-насосов;
-
активируют загрузку DA в везикулы (каждая везикула содержит теперь больше DA);
-
частично блокируют МАО.
При введении высоких доз действие амфетаминов начинает распространяться на систему NE.
В результате появляется бодрость, прилив сил, снимается утомление, голод. Амфетамины пыта-лись использовать для похудания; они были первыми спортивными допингами; сейчас это – «наркотики дискотек» и группа лекарственных препаратов (используются при тяжелых депрессиях).
Привыкание и зависимость: через 20-30 приемов; не дают реальной энергии, а лишь заставляют мозг расставаться с «неприкосновенными запасами» DA; быстро развиваются эндокринные нарушения, страдает сердечно-сосудистая система. Как допинги давно ушли в прошлое (им далеко до EPO – эритропоэтина, увеличиваю-щего в крови содержание эритроцитов…).
Инактивация DA: обратный захват с помощью белка-насоса и далее повторная загрузка в везикулу либо разрушение с помощью МАО (находится на мембране митохондрий).
Синтез серотонина (5-НТ) идет в 2 стадии:
1. Из пищевой аминокислоты триптофана образуется 5-гидрокситриптофан; фермент триптофангидроксилаза.
2. Из 5-гидрокситриптофана образуется 5-гидрокситриптамин (5-НТ; серотонин); фермент декарбоксилаза ароматических аминокислот.
Серотонин является тканевым гормоном (увеличивает тонус гладких мышечных клеток в стенках сосудов и ряда других внутренних органов). Кроме того, серотонин – медиатор ЦНС; вырабатывают нейроны ядер шва (верхне-центральная зона среднего мозга, моста и продолговатого мозга с переходом в спинной мозг); аксоны клеток ядер шва расходятся по всей ЦНС, образуя контакты обычного и варикозного типа.
Антидепрессанты – препараты, активирующие системы NE, DA и 5-НТ (NE и DA поднимают уровень положит. эмоций, а серотонин сдерживает отрицательные эмоции).
Механизм действия: блокаторы МАО и обратного захвата.
В случае МАО выделяют 2 подтипа фермента:
МАО-А – разрушает NE и 5-НТ;
МАО-Б – разрушает дофамин.
Ранее использовали неспецифические блокаторы МАО (ниаламид); теперь – более мягко действующие блокаторы МАО-А (пиразидол). Блокаторы МАО-Б (депренил) применяют при паркинсонизме.
На фоне блокаторов МАО может возникать «сырный синдром»: тирамин, которого много в сыре, бобовых, копченостях, не разрушается и оказывает NE-подобное действие (нервное возб-е, гипертония).
В случае обратного захвата белки-насосы для каждого из медиаторов хотя и похожи, но все же разные. Используют неспецифические блокаторы обратного захвата (амитриптилин) и наиболее мягко работающие блокаторы захвата 5-НТ (флуоксетин = прозак). Прозак: применение повышает уровень оптимизма и увереннос-ти в себе.
Синтез дофамина (DA):
Уже знакомая последовательность реакций:
-
Тирозин превращается в L-дофа; фермент тирозин-гидроксилаза
-
L-дофа дает дофамин (декарбоксилирование v )
-
Дофамин превращается в NЕ и т.д.
НОРАДРЕНАЛИН (NE).
Как и к ацетилхолину, к NЕ существует два основных типа рецепторов (альфа- и бета-адренорецепторы). К рецепторам Ацх агонисты и антагонисты создала сама природа, они издавна известны человечеству.В случае NЕ потрудиться пришлось химикам; избирательные альфа-агонисты и антагонисты, а также бета-агонисты и антагонисты стали появляться лишь после 1948 г.
Норадреналин – образуется в результате цепи химических ре-акций из пищевой аминокислоты тирозина; характерный элемент структуры – ароматическое (бензольное) кольцо.
Синтез – в пресинаптическом окончании, после чего NЕ переносится внутрь везикул и готов к экзоцитозу.

Появление ПД запускает вход Са2+ и выброс NЕ в синаптическую щель, после чего он действует на рецепторы как пост-синаптической, так и пресинаптической мембраны.
NE в головном мозге: в передней верхней части моста («голубое пятно»), на дне ромбовидной ямки; всего несколько млн. клеток (< 1% нейронов ЦНС), однако их аксоны расхо-дятся по всему головному и спинному мозгу, влияя на многие функции.
Медиатор норадреналин относится к катехоламинам — производным аминокислоты тирозина. Тирозин — одна из незаменимых аминокислот, которые мы получаем только с пищей.
Синтез норадреналина осуществляется в пресинаптических окончаниях, затем он переносится в пустые везикулы и хранится до момента выброса. Выделяясь в синаптическую щель, норадреналин действует на постсинаптические рецепторы, которые неоднородны и подразделяются на два типа — альфа- и бета-адренорецепторы. Оба они являются метаботропными, но разница состоит в том, что альфа-адренорецепторы в качестве вторичных посредников используют инозитолтрифосфат (ИТФ), диацилглицерол (ДАТ) и ионы Са2+, а бета-адренорецепторы соединены с ферментом аденилатциклазой, продуцирующей циклический аденозинмонофосфат (цАМФ).
Норадренергические (вырабатывающие норадреналин в качестве медиатора) нейроны расположены в голубом пятне и межножковом ядре среднего мозга, их аксоны образуют чрезвычайно широкую сеть проекций, в результате чего соответствующие синапсы можно обнаружить в большой концентрации в разных отделах ЦНС от спинного до конечного мозга, в том числе в коре мозжечка и больших полушарий (содержат как
альфа-, так и бета-адренорецепторы).
Обе эти группы препаратов (препараты с нейролептическими свойствами, антидепрессанты.) способны влиять на активность норадренергической системы, но ситуация осложняется тем, что в регуляции уровня эмоций и двигательной активности, кроме норадреналина, участвуют и другие медиаторы, в частности, дофамин и серотонин.
Обратный захват норадреналина осуществляется особыми белками-насосами. Попав в пресинаптическое окончание, норадреналин может повторно «загружаться» в везикулы, но может и разлагаться с помощью фермента моноаминоксидазы (МАО). Инактивация происходит внутри митохондрий, на внутренней мембране которых располагается МАО. Чрезвычайно важно, что этот фермент осуществляет разложение и других моноаминов — дофамина и серотонина. Оказалось, что использование блокаторов МАО позволяет повысить активность всех трех медиаторных систем (антидепрессантные эффекты).
Дофамин. Дофамин относится к катехоламинам. Дофаминергические нейроны встречаются в трех отделах головного мозга: черной субстанции (ее компактной части), покрышке среднего мозга и в различных ядрах гипоталамуса. В периферической нервной системе его практически нет.
Синтез дофамина протекает так же, как и норадреналина, но в дофаминергических нейронах цепочка химических превращений тирозина останавливается на одно звено раньше. Далее происходит перенос медиатора в везикулы и выброс в синаптическую щель по мере надобности.
В норме инактивация дофамина осуществляется тем же способом, который описан для норадреналина (обратный захват, а затем повторная загрузка в везикулы либо разложение с помощью МАО). Отличие состоит в функции пресинаптических рецепторов. В случае дофамина их включение тормозит активность синапса, т. е. уменьшает дальнейший выброс медиатора. Этот механизм позволяет нервным клеткам экономно расходовать запасы дофамина, но подразумевается, что чувствительность пре- и постсинаптических рецепторов к дофамину тонко сбалансирована. Смещение этого
баланса, вероятно, является причиной некоторых видов шизофрении, при которых пресинаптические рецепторы «опаздывают» с торможением выброса медиатора, поэтому оказывается полезным введение специфических агонистов пресинаптических рецепторов (например, апоморфина в малых дозах).
Серотонин. Серотонин — медиатор, относящийся к группе моноаминов, к ней же принадлежат катехоламины и гистамин. Образуется серотонин в результате химического
преобразования аминокислоты триптофана. В ЦНС серотонин синтезируют в основном нейроны, находящиеся в ядрах шва; последние расположены вдоль средней линии продолговатого мозга, моста и среднего мозга. Синтез серотонина осуществляется преимущественно в пресинаптических окончаниях. Выделяясь в дальнейшем в синаптическую щель, серотонин связывается с соответствующими рецепторами, которых в настоящее время известно 3 типа. Сокращенно они называются 5HTj-, 5HT2- и 5НТ3-ре-
цепторы. Последний слабо представлен в ЦНС, поэтому подробнее остановимся только на свойствах рецепторов первого и второго типов.
5НТГ и 5НТ2-рецепторы являются метаботропными и сопряжены соответственно с аденилатциклазои и фосфолипазои С (ферментом, с помощью которого осуществляется синтез диацилглицерола и инозитолтрифосфата). 5НТ2-рецепторы более распространены на постсинаптических мембранах мозга, особенно высока их концентрация в лобной коре; несколько меньше 5НТ2-рецепторов в поясной извилине, гипоталамусе, миндалине. 5НТ,-рецепторы чаще являются пресинаптическими. Будучи более чувствительными к серотонину, чем 5НТ2-тип, они способны эффективно блокировать его выброс в синаптическую щель. Этот механизм в целом аналогичен механизму, описанному в случае дофамина. Кроме того, активация пресинаптических рецепторов снижает синтез серотонина.
Серотонин, как и катехоламины, возвращается в пресинаптическое окончание с помощью механизма обратного всасывания. Деградация медиатора идет с помощью все той же МАО. Ослабляя обратный захват либо блокируя МАО, можно достичь активации серотонинергических синапсов. При этом воздействие на МАО приведет к параллельной активации и катехоламинергических систем. Блокаторы МАО, усиливающие работу сразу трех медиаторов-моноаминов (серотонина, норадреналина и дофамина), образуют отдельное семейство психотропных препаратов — антидепрессантов.
6-3. Центры сна и бодрствования головного мозга (ретикулярные ядра, центральное серое вещество, голубое пятно и др.) Электроэнцефаграмма сна и бодрствования.
Сон и наркоз. Мозговые центры, регулирующие смену сна и бодрствования – одни из самых древних структур НС. Засыпаем мы по многим причинам, в т.ч. при снижении сенсорного притока; это снижение имитируют снотворные препараты. Но сон – не только фаза отдыха мозга; он включает в себя т.н. парадоксальную фазу (REM-sleep), во время которой ЦНС обрабатывает накопленную за день информацию («фаза сновидений»).
Барбитураты, вызывая избыточно сильное торможение, блокируют эту фазу, мешая, прежде всего, полно-ценной «очистке» контуров памяти. Сон, вызванный бензодиазепинами, ближе к естественному, однако и в этом случае всегда есть риск привыкания и зависимости.


Снотворные – препараты для «аварийного» (но не для ежедневного) применения! Барбитураты в большей степени (чем бензодиазепины) подходят для длительного наркоза во время операций (гексенал). Сверхдозы агонистов ГАМК способны вызвать остановку дыхания (самый частый способ суицида).
Центры сна и бодрствования.
Эволюционно очень древние, постоянно конкурируют друг с другом, учитывают значительное число факторов (прежде всего, сенсорных).
1. Главный центр бодрствования: ретикулярные ядра моста; сюда поступает часть информации от всех сенсорных систем; далее происходит оценка общего уровня «сенсорного давления» на ЦНС, и чем оно больше, тем мозг активнее (нас будит сигнал, поступивший от любой сенсорной системы); аксоны (в т.ч. Ацх) расходятся по всей ЦНС, задавая ее тонус («блок питания» мозга); в тихом и темном месте, а также при торможении сенсорных потоков с помощью агонистов ГАМК мы засыпаем.
2. Главный центр сна: центральное серое вещество среднего мозга и ядра шва (5-НТ); аксоны нейронов ядер шва также расходятся по всей ЦНС, снижая ее тонус и тормозя, в числе прочего, центры бодрствования. Торможение коры происходит за счет снижения активности Glu-нейронов таламуса, чьи аксоны идут в большие полушария.
3. Голубое пятно: вспомогательный центр бодрствования, получив сигнал из [1], тормозит [2] за счет выделение NE.
При стрессе, приближении потенциально опасной ситуации трудно заснуть
(поездка, соревнования, экзамен…)
4. Супрахиазменные ядра переднего гипоталамуса: находятся напротив перекреста зрительных нервов, получают информацию об общем уровне освещенности и настраиваются на суточный ритм («биологические часы»; часть нейронов активны днем и влияют на [1], часть – ночью и влияют на [2], намекая, что пора спать). В яркой форме эффект «биологич. часов» проявляется при резкой смене часового пояса. В основе поддержания ритма – медленные цепи внутриклеточных химических реакций.
5. Вспомогательный центр сна – ретикулярные ядра продолговатого мозга: реакция на химический состав крови, появление аденозина и других «отходов обмена веществ», токсинов (при заболеваниях и отравлениях), рост концентрации инсулина и глюкозы (после еды хочется спать); оказывает постоянное возбуждающее действие на [2].
Но все еще сложнее, и выделяют стадии сна (на основе анализа ЭЭГ): Бодрствование: альфа-ритм – 10-12 Гц, бета-ритм – 15-30 Гц
Стадия 1: появление тета-ритма – 4-8 Гц
Стадия 2: сонные веретена и К-комплексы
Стадии 3 и 4: все более медленный дельта-ритм – 1-3 Гц.
REM-сон: «бодрствующая» ЭЭГ

СНЫ – «окно в бессознательное», «упорядочивание» накопленной информации, «дефрагментация», продолжение ментальных процессов в ином состоянии (творческие сны, вещие сны и т.п.). Если лишать REM-сна, то человек не высыпается, а на следующую ночь «добирает» REM-сон. Развитый REM-сон – только у млекопитающих.
Стадии 1-4 (не-REM-сон) – физиологический отдых мозга разной степени глубины.
REM-сон (парадоксальный: «бодрствующая» ЭЭГ, но порог пробуждения выше) – стадия сновидений, обработка накопленной информа-ции (в первую очередь, за текущие сутки). Око-ло 20% времени сна; 4-5 раз за ночь примерно по 20 мин; в первые 3 года жизни – 30-50%.
Наиболее выражен суточный цикл сон — бодрствование. Он реализуется как за счет безусловно-рефлекторной основы, главные компоненты которой относятся к группе витальных врожденных реакций, так и за счет определенных адаптивных процессов, которые и будут рассмотрены ниже.
Состояние бодрствования характеризуется высокой нервной активностью. В это время происходит взаимодействие организма с внешней средой, формирование и реализация различных рефлекторных реакций. Бодрствующее состояние поддерживается особыми центрами бодрствования.
Сон — это физиологическое состояние, при котором значительно снижается реакция нервной системы и всего организма на внешние раздражители. Состояние сна является следствием включения особых центров сна головного мозга и сопровождается снижением интенсивности физиологических процессов, общей неподвижностью.
Кратко охарактеризуем основные центры бодрствования и сна головного мозга. Функции главного центра бодрствования нашего мозга выполняют в ЦНС ретикулярные ядра моста. Каждая сенсорная система, помимо передачи информации в специфические зрительные, слуховые, вкусовые зоны, часть сигналов направляет именно сюда. В ретикулярных ядрах моста (ретикулярная формация моста) происходит их суммирование и оценка общего уровня сенсорного «давления» на организм. Далее сигналы от ретикулярных ядер чрезвычайно широко иррадиируют по ЦНС. Анатомическую основу для этого обеспечивают коллатерали аксонов их нейронов, которые образуют возбуждающие синапсы на самых разных уровнях — от коры больших полушарий до серого вещества спинного мозга.
В качестве ключевых центров сна рассматриваются содержащие серотонин структуры среднего мозга и моста (ядра шва) и влияющее на них центральное серое вещество среднего мозга. Функции серотонина как медиатора нервной системы уже обсуждались в разделе, посвященном общей физиологии нервной системы. Напомним, что они связаны с тормозной модуляцией сенсорных входов. Как и в случае ретикулярных
ядер моста, коллатерали аксонов серотонинергических нейронов обнаруживаются на всех уровнях ЦНС.
Между ретикулярными ядрами моста и центрами сна существуют антагонистические отношения, являющиеся частным случаем проявления принципа доминанты. При этом глутаматергические нейроны центров бодрствования нуждаются в посреднике для реализации тормозного действия на центры сна. Роль такого посредника выполняет голубое пятно — область норадренергических нейронов в верхней части моста. Стимуляция этой зоны вызывает выключение центров сна и пробуждение. Следующей важной областью, связанной с регуляцией суточных ритмов, являются супрахиазменные ядра гипоталамуса. Контактируя со зрительной системой, они оказываются настроенными на суточные колебания освещенности в окружающей среде. В результате часть нервных клеток этой области обнаруживает активность в темноте, а часть — в светлое время суток. Первые посылают свои аксоны в центры сна, вторые— в центры бодрствования. Нейроны супрахиазменных ядер обладают свойством автоматизма (будучи изолированными от всего остального мозга, продолжают поддерживать суточный ритм). Их назначение состоит в том, чтобы вовремя сообщить ретикулярным ядрам моста, что уже «пора вставать», а центральному серому веществу и ядрам шва — что уже «пора спать».
Ретикулярные ядра продолговатого мозга. Не являясь самостоятельными центрами сна, они посылают в центральное серое вещество сигналы, связанные с оценкой содержания в крови различных важных для деятельности мозга веществ (глюкозы, токсинов, отходов обмена веществ). За счет активации ретикулярной формации продолговатого мозга сонное состояние может развиться после еды, при болезнях, физическом утомлении.
В целом можно заключить, что центры сна и бодрствования находятся в постоянных конкурентных отношениях и степень доминирования тех или других зависит от многих факторов: времени суток, сенсорной нагрузки, физического состояния. Это позволяет нервной системе гибко варьировать общий уровень своей активности в зависимости от значимости текущей деятельности (ожидаемого подкрепления) и степени
утомления. В результате ЦНС, с одной стороны, функционирует в режиме максимальной экономии ресурсов, с другой — в случае необходимости может быстро переходить в состояние высокой работоспособности, быстрого и адекватного реагирования на внешние стимулы.
С помощью электрофизиологических методик установлено, что естественный ночной сон состоит из нескольких повторяющихся циклов. В течение каждого такого цикла наблюдаются закономерные изменения в электроэнцефалограмме (ЭЭГ) — электрической активности коры больших полушарий. Две основные характеристики ЭЭГ — это частота и амплитуда составляющих ее волн. Известно, что в зависимости от
функционального состояния человека характер ЭЭГ меняется: чем больше активность мозга, тем больше частота и ниже амплитуда волн ЭЭГ. В спокойном бодрствующем состоянии в ЭЭГ преобладает альфа-ритм (8—12 Гц), при активной умственной деятельности он сменяется бета-ритмом A3—30 Гц). Во время засыпания активность коры снижается и в ЭЭГ появляются сначала тета-волны D—7 Гц), а затем дельта-волны A—3 Гц). Сон с преобладанием медленных дельта-волн является основной фазой сна (около 80% общей его длительности) и называется медленным сном. В ходе медленного сна наблюдается глубокое торможение большинства областей ЦНС, происходит «физиологический отдых» — восстановление запасов химических веществ и энергии, затраченных во время бодрствования. Можно наблюдать, что в течение ночи медленный сон 4—5 раз периодически сменяется другой фазой сна. В это время дельта-волны замещаются на быструю низкоамплитудную активность, сходную с ЭЭГ в состоянии бодрствования. Кроме того, наблюдается повышение температуры, частоты дыхания
и сердцебиений, артериального давления, усиление потоотделения, но порог пробуждения в этот момент оказывается еще выше, чем при медленном сне, т. е. торможение сенсорных
входов достигает максимума. Происходит также исчезновение мышечного тонуса (полное расслабление мускулатуры). Совокупность данных признаков позволила назвать данную
фазу сна парадоксальной или быстрым сном. Во время этой стадии можно наблюдать также быстрые движения глазных яблок — отсюда третье название: стадия быстрых движений глаз, или стадия БДГ (англ. rapid eye movement — REM-сон).
Во время первого цикла (после первого интервала медленного сна) стадия БДГ еще очень короткая — примерно 5 мин. Но с каждым новым циклом ее длительность нарастает и достигает 20—25 мин (суммарно около 20% от всей длительности сна). Показано, что если человеку не позволять в течение ночи находиться в этой стадии, то утром он оказывается невыспавшимся, отмечается повышенная утомляемость и раздражительность. При длительном лишении быстрого сна могут развиться неврозы. Предполагается, что во время быстрого сна мозг осуществляет обработку информации, накопленной за прошедший период бодрствования. Судя по имеющимся данным, именно эта обработка является главной причиной сновидений.
7-1. Мозговое и корковое вещество надпочечников: выделяемые гормоны и их эффекты (в т.ч. действие на нервную систему). ЦНС и управление работой надпочечников.
Надпочечник состоит из корковой и мозговой частей.
Корковая часть, выделяя гормоны, работает под управлением гипофиза.
Мозговая часть состоит из клеток того же происхожде-ния, что и клетки симпатических ганглиев. К ним подходят преганглионарные симпатические волокна и, выделяя Ацх, через никотиновые рецепторы запускают секрецию адреналина (80%) и NE (20%).
Адреналин интенсивнее, чем NE, действует на те орга-ны, где больше β-рецепторов (бронхи, сердце, сосуды сердца – в последн. случае идет расширение сосудов, конкурирующее с влиянием NE через a1-рецепторы).
В целом мозговое вещество обеспечивает эндокринную «поддержку» симпатической НС, позволяет пролонги-ровать ее эффекты на часы, сутки, недели, месяцы (что ведет к развитию многих патологических процессов, но это уже другая история…)
Надпочечники — парные железы внутренней секреции, массой по 5—7 г, расположенные на полюсах почек. В каждом надпочечнике выделяют два слоя: корковый и мозговой. Эти слои железы совершенно различны по своему происхождению. Наружный корковый слой развивается из среднего зародышевого листка (мезодермы), а внутренний слой является видоизмененным узлом вегетативной нервной
системы. Кора надпочечников подразделяется на три зоны: клубочковую, пучковую и сетчатую. Каждая из этих зон вырабатывает характерные для нее гормоны, которые жизненно не-обходимы для организма. Общее название гормонов коры надпочечников — кортикостероиды. В клубочковой зоне образуются минералокортикоиды, в пучковой — глюкокортикоиды, в сетчатой — глюкокортикоиды и некоторое количество половых гормонов. Все эти гормоны по своей химической природе — стероиды. Минералокортикостероиды получили свое название за то, что регулируют обмен таких минеральных элементов, как натрий и калий. Основным минералокортикоидом в организме человека является альдостерон, способствующий, во-первых, задержке в организме воды и натрия и, во-вторых, выведению калия. Основной орган-мишень для альдостерона — почки. Секретируемый под действием АКТГ и ренина почек альдостерон проникает в эпителиальные клетки стенок почечных канальцев, в цитоплазме этих клеток связывается со специфическим рецептором. Комплекс гормон — рецептор проникает в
ядро клетки и приводит к синтезу фермента, приводящего к задержке выделения натрия и усилению выведения калия с мочой. Секреция альдостерона усиливается также при уменьшении объема плазмы крови: при сильной жажде или кровопотерях. Под действием альдостерона жидкость задерживается в организме и объем плазмы постепенно нормализуется. Глюкокортикоиды синтезируются в клетках пучковой зоны коры надпочечников. Основной глюкокортикоид — гидрокортизон (кортизол). Глюкокортикоиды получили свое название за то, что являются регуляторами углеводного обмена, усиливая цепь реакций, приводящих к образованию главного углевода в организме — глюкозы. Кроме того, кортизол тормозит расход глюкозы в периферических органах и тканях. Под влиянием кортизола тормозится проникновение пищевых
аминокислот из крови в различные клетки и, как следствие, стимулируются процессы распада белка в различных тканях, что при некоторых патологиях может привести к снижению мышечной массы, замедлению заживления ран. Кортизол также тормозит образование жиров. Кортизол, как и все другие глюкокортикоиды, подавляет развитие воспаления. Воспаление характеризуется тремя симптомами: во-первых, притоком крови к воспаленному участку и его покраснением; во-вторых, увеличением проницаемости стенок капилляров в воспаленном участке и поступлением жидкости из капилляров в межклеточные пространства, т. е. отеком; и, в-третьих, как следствие первых двух процессов — болевыми ощущениями. Все эти три симптома устраняются кортизолом.
Глюкокортикоиды угнетают иммунитет, подавляя образование антител к чужеродным белкам, что позволяет использовать их для торможения реакций отторжения пересаженных органов. В ряде случаев, при кратковременном выбросе кортизола в кровь, описанные реакции не опасны для организма, однако длительное повышение уровня глюкокортикоидов в крови может привести к тому, что симптомы какого-либо инфекционного заболевания будут подавлены, а болезнь от этого не станет менее опасной. Поэтому применять глюкокортикоиды в качестве лекарств нужно только по назначению врача.
Кортизол необходим для создания реакции на сильные раздражители, приводящие к развитию стресса. Стресс можно определить как угрожающую ситуацию, развивающуюся под воздействием боли, кровопотери, страха. Кортизол препятствует кровопотере и, способствуя развитию сосудосуживающего эффекта норадреналина, сужает мелкие артериальные сосуды. Он усиливает сократительную способность сердечной мышцы. Кортизол помогает лучше переносить состояние физиологического шока, он обладает также пермиссивными эффектами, облегчая эффекты тироксина и норадреналина.
Секреция глюкокортикоидов регулируется АКТГ, причем под действием этого гормона не только усиливается секреция, но и стимулируется рост коры надпочечников, т. е. увеличивается масса ткани, способной вырабатывать кортизол. В течение всей жизни человека в клетках сетчатой зоны коры надпочечников вырабатываются мужские и женские половые гормоны. Так, у мужчин две трети половых гормонов — андрогенов синтезируется в семенниках, а одна треть — в коре надпочечников. При разрушении клеток коры надпочечников развивается болезнь Аддисона. Раньше хроническая недостаточность коры являлась, главным образом, следствием туберкулезной инфекции. В настоящее время это заболевание чаще возникает из-за разрушительного воздействия на кору надпочечников антител, ошибочно вырабатываемых клетками иммунной системы. У больных с болезнью Аддисона резко повышена секреция кортиколиберина и АКТГ, за счет чего организм пытается повысить выработку гормонов коры надпочечников, что невозможно по причине ее разрушения. Но кортиколиберин является также и фактором, усиливающим секрецию меланоцитстимулирующего гормона гипофиза, который, в свою очередь, приводит к синтезу большого количества пигмента меланина и потемнению кожи. У больных, кроме того, развивается мышечная слабость, снижается масса тела, страдает память и умственные способности, ослабевает концентрация внимания, иногда развиваются депрессии. Наблюдается усиленное выведение натрия с мочой и повышение уровня калия в крови. Для лечения болезни Аддисона необходимо постоянно вводить кортикостероиды. Возможна и противоположная патология: из-за усиленной секреции кортиколиберина или АКТГ наблюдается гиперфункция коры надпочечников и возникает синдром Кушинга. Еще одно заболевание, связанное с корой надпочечников, — адреногенитальный синдром, вызываемый врожденным отсутствием ферментов, необходимых для синтеза кортизола.
На систему гипоталамус — аденогипофиз нехватка кортизола оказывает стимулирующий эффект, и усиленная секреция кортиколиберина гипоталамусом и АКТГ аденогипофизом должна бы повысить уровень кортизола, что в этой ситуации невозможно. Зато естественно усиливается синтез других стероидов коры надпочечников и очень часто — мужских половых гормонов (андрогенов). При этом у девочек, несмотря на нормальный женский генотип, происходит развитие организма по мужскому типу и формируется мужской фенотип. Очень редко кора надпочечников начинает секретировать повышенные количества андрогенов в зрелом возрасте. В этом случае у женщин наблюдается оволосение по мужскому типу, облысение, уменьшение молочных желез, увеличение клитора. В мозговом веществе надпочечников содержатся специализированные клетки, синтезирующие два гормона: адреналин и норадреналин, относящиеся к классу катехоламинов и вырабатываемые из аминокислоты тирозина. Секреторную активность клеток мозгового вещества стимулирует медиатор ацетилхолин, выделяемый из окончаний преганглионарных симпатических нейронов, подходящих к этим клеткам. Таким образом, по своему эмбриональному происхождению и иннервации мозговое вещество надпочечников — симпатический нервный узел. Из клеток мозгового вещества выделяется приблизительно 80% адреналина и 20% норадреналина. Мишенями этих гормонов являются все ткани организма. Адреналин и норадреналин призваны мобилизовать все силы человека в случае ситуаций, требующих большого физического или умственного напряжения, при травме, инфекции, испуге. Под влиянием внешних или внутренних стрессовых факторов происходит секреция этих гормонов, которые увеличивают частоту сердечных сокращений и выброс крови при каждом из них; повышают давление крови для улучшения снабжения кислородом и глюкозой; учащают дыхание и расширяют бронхи; тормозят перистальтику (сокращение) желудочно-кишечного тракта. Кроме того, адреналин и норадреналин стимулируют энергетический обмен. Так как основным источником энергии в организме служит глюкоза, то под действием этих гормонов распадается полимер глюкозы гликоген, хранящийся в печени; при этом образуется много молекул глюкозы, поступающих в кровь. Стимулируется также распад жиров для покрытия энергетических затрат. Адреналин и норадреналин вызывают повышение возбудимости структур головного мозга, что также адаптирует нервную систему к работе в условиях стресса. Таким образом, когда человек или животное
находится в опасности, то гормоны мозгового вещества создают все условия для успешной борьбы или не менее успешного бегства. Многообразие эффектов адреналина и норадреналина связано с тем, что в различных тканях они реагируют с имеющимися там несколькими видами рецепторов.
Патологии мозгового вещества надпочечников возникают редко, однако при развитии в этой области опухоли (феохромоцитомы) происходят приступообразные выбросы адреналина, причем симптомы, наблюдаемые при этом, те же, что и при избыточном возбуждении симпатического отдела вегетативной нервной системы. Клинически феохромоцитома проявляется подъемом артериального давления (злокачественная гипертензия), не поддающаяся медикаментозному лечению.
Единственный метод лечения — хирургический. Любое разрушение или искусственное удаление надпочечников (адреналэктомия) приводит к быстрой гибели. Эффекты гормонов мозгового слоя надпочечников очень близки к эффектам, возникающим при возбуждении симпатического отдела вегетативной нервной системы, и обе эти системы, каждая своими путями, обеспечивает выживание организма в неблагоприятных условиях существования.
Кора надпочечников вырабатывает кортикостероиды. Часть из них («минералокортикоиды») регулирует обмен калия и натрия в почках. Вторая часть («глюкокортикоиды», ос-новной представитель кортизол) управляет обменом глюкозы в организме, в частности, усиливает ее образование из других веществ (белков, жиров); особенно ярок этот эффект при стрессе. В целом глюкокортикоиды перестраи-вают обмен веществ на усиленное потребление энергии, «сопровождая» эффекты симпатической НС и адреналина. Глюкокортикоиды, кроме того, тормозят активность иммунной системы и развитие воспаления, что позволяет использовать их как противовоспалительные препараты.
Выделение глюкокортикоидов усиливает кортикотропин = адренокортикотропный гормон (АКТГ или АСТН). Выделение АКТГ активирует кортиколиберин (CRH). Кортизол тормозит выброс АКТГ и CRH.
АКТГ (АСТН) состоит из 39 аминокис-лот. Его фрагменты длиной 7-10 а/к способны проникать в ЦНС, оказывая ноотропное действие, улучшая обуче-ние и память, снижая проявления депрессивности (препарат СЕМАКС). Кортиколиберин (CRH) стимулирует двигательную активность и эмоциональные проявления; снижает пищевую и половую мотивации. В последнее время система CRH - АКТГ – глюкокортикоиды интенсивно исследуется в связи с возможностями управления весом организма.
7-2. Синтез, взаимопревращения и инактивация глутаминовой кислоты и ГАМК. Значение аминокислот для деятельности мозга.
Медиаторы-аминокислоты являются главными медиаторами ЦНС.
Глутаминовая кислота (Glu) – главный возбуждающий меди-атор (около 40% всех нейронов); проведение основных потоков информации в ЦНС (сенсорные сигналы, двигат. команды, память).
Гамма-аминомасляная кислота (ГАМК) – главный тормозный медиатор (также около 40% всех нейронов); запрет проведения «ненужной» информации (внимание, двигательный контроль).
Нормальная деятельность ЦНС обеспечивается тонким балансом Glu и ГАМК.
Нарушение этого баланса (как правило, в сторону уменьшения торможения) негативно влияет на многие нервные процессы – вплоть до возникно-вения мощных локальных очагов возбуждения, что ведёт к развитию эпилептических припадков.
Глутаминовая кислота и ГАМК – конкуренты и партнёры.
При нарушении баланса Glu и ГАМК:
-
синдром дефицита внимания и гиперактивности детей (СДВГ);
-
повышенная нервозность и тревожность взрослых;
-
нарушения сна, бессонница;
-
эпилепсия (чаcто врожденная патология, у 0.5% населения).
В клинических целях используют агонисты ГАМК и антагонисты Glu. Антагонисты ГАМК и агонисты Glu – яды, вызывающие судороги (конвульсанты).
Глутаминовая кислота. Пищевая аминокислота – входит в состав белков пищи и белков нашего тела; самая распространенная: потребляем с едой 5-10 г в сутки. Стандартная структура; радикал -СН2-СН2-СООН. В водных растворах существует в ионизированном виде, то есть в форме отрицательно заряженного остатка глутамата («глютамата»).
Для синтеза необходимы: a-кетоглутаровая кислота (промежуточный продукт окисления глюкозы в цикле Кребса; в больших количествах образуется в митохондриях); аминогруппа любой а/к, полученной с пищей; фермент из группы аминотрансфераз. Такой синтез идет во всех клетках организма.
Другой («быстрый») путь синтеза, характерный для нейронов: взаимные превращения Glu и очень сходной пищевой а/к глутамина: замена второй ОН-группы Glu на аминогруппу NH2.
глутамин Þ Glu (фермент глутамин синтетаза;
в пресинаптических окончаниях)
Glu Þ глутамин (фермент глутаминаза; при
инактивации Glu)
Для синтеза необходимы: a-кетоглутаровая кислота (промежуточный продукт окисления глюкозы в цикле Кребса; в больших количествах образуется в митохондриях);
аминогруппа любой а/к, полученной с пищей; фермент из группы аминотрансфераз. Такой синтез идет во всех клетках организма.
Во всех тканях организма (в т.ч. в мозге) очень много Glu. В связи с этим долгое время не могли поверить, что столь распространенное вещество является медиатором ЦНС. Однако это именно так. Дело в том, что пищевой глутамат почти не преодолевает ГЭБ, и для выпол-нения медиаторных функций Glu синтезируется непосредственно в пресинаптических окончениях из глутамина; определенный вклад вносит также образование Glu из a-кетоглутаровой кислоты (a-KG).
После синтеза Glu загружается в везикулы (◄ ), выбрасывается в синаптическую щель при приходе ПД и влияет на рецепторы ( ↓↓↓ ), запуская ВПСП.

Введение Glu непосредственно в мозг (в желудочки) вызывает возбуждение ЦНС и судороги.
Сходные эффекты наблюдаются при отравлении агонистами Glu, часть из которых является токсинами растений. Пример: домоевая кислота; вырабатывается некоторыми одноклеточными водорослями; токсин накапливается в телах животных, поедающих фитопланктон (двустворчатые моллюски, некоторые рыбы) и способен отравлять птиц, млекопитающих, человека. Смертельные случаи: западное побережье Канады; «бешенство» птиц в Калифорнии (Дюморье, Хичкок).
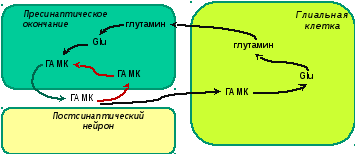
Инактивация Glu: Из синаптический щели Glu l переносится в глиальные клетки, где превращается в глутамин (Gln) l (с помощью фермента глутаминазы).
Глутамин затем может перемещаться в пресинаптическое окончание и вновь становиться Glu в митохондриях.Часть Glu возвращается из синаптической щели прямо в пресинаптич. окончание («обратное всасывание»).
ГАМК. Непищевая аминокислота: аминогруппа в 3-м (g) положении. Синтез – из глутаминовой кислоты за счет отщепления СО2 (фермент глутамат декарбоксилаза).
ГАМК может использоваться в качестве медиатора, но может терять аминогруппу (фермент ГАМК-трансфераза) и быстро окисляться с выдел. энергии.
Именно для нейронов характерна следующая цепь реакций: глюкоза ® … ® a-кетоглутаровая кислота ® Glu ® ГАМК ® … ® энергия
ГАМК на 10% проходит ГЭБ. Однако при ее системном введении (таблетки «Аминалон») наблюдается не столько торможение ЦНС, сколько «питание» нейро-нов и улучшение их общего состояния (ноотропное действие ГАМК).
Инактивация ГАМК. В значительной мере сходна с инактивацией Glu: обратное всасывание ГАМК в пресинаптическое окончание либо всасывание глиальными клетками. В последнем случае ГАМК разрушается ферментом ГАМК трансферазой: аминогруппа ГАМК переносится на a-кетоглутаровую кислоту с образованием Glu. Далее Glu может превращаться в глутамин, который транспортируется в пресинаптическое окончание, опять становится Glu, а из Glu образуется ГАМК. Круг замкнулся.
Инактивация ГАМК происходит в основном путем обратного всасывания в пресинаптическое окончание и последующего превращения в глутаминовую кислоту. Реакцию эту осуществляет особый фермент ГАМК-трансфераза. Его блокаторами являются соли вальпроевой кислоты. Они оказывают транквилизирующее и противосудорожное действие. Вальпроаты особенно полезны при малых формах эпилепсии. Вызываемые ими побочные депрессантные изменения, как правило, минимальны.