Зависимость цвета вещества от поглощаемой части спектра
|
Поглощаемая часть спектра, нм |
Цвет поглощенной части светового потока |
Дополнительный (кажущийся) цвет вещества |
|
380 – 450 |
Фиолетовый |
Желто-зеленый |
|
450 – 480 |
Синий |
Желтый |
|
480 – 490 |
Зелено-синий |
Оранжевый |
|
490 – 500 |
Сине-зеленый |
Красный |
|
500 – 560 |
Зеленый |
Пурпурный |
|
560 – 575 |
Желто-зеленый |
Фиолетовый |
|
575 – 590 |
Желтый |
Синий |
|
590 – 625 |
Оранжевый |
Зелено-синий |
|
625 – 760 |
Красный |
Сине-зеленый |
При падении луча света на вещество возможны следующие случаи:
-
лучи света полностью проходят через вещество, в этом случае визуально вещество кажется бесцветным, прозрачным;
-
лучи света отражаются веществом не менее, чем на 90%, продукт воспринимается белым (например, сахар, соль);
-
лучи света полностью поглощаются веществом, продукт кажется черным (например, чай);
-
вещество поглощает часть лучей, в этом случае цвет его воспринимается глазом по отраженной части спектра (см. табл.1.1, колонка 3).
Существует от 7 до 10 млн. цветовых различий. Словарный запас содержит несколько тысяч наименований, но лишь несколько десятков из них можно выразить отдельными смысловыми словами (красный, желтый…). Несколько сотен названий представляют собой словосочетания цвета и насыщенности (светло-зеленый, ярко-синий…). Часто для обозначения цвета используются термины, ассоциируемые со знакомыми объектами (морковный, золотистый…), либо называют путем комбинирования специальных терминов (сине-зеленый, желто-коричневый…).
Цвет, его оттенки, насыщенность и яркость зависят также от поверхности объекта, которая может быть блестящей, гладкой, ровной или пористой, тусклой, матовой, шероховатой, что связано с равномерным или неравномерным отражением световых лучей поверхностью продукта.
Цвет является одним из главнейших элементов эстетического оформления пищевых продуктов и способствует привлечению внимания потребителя, вызывает определенные ассоциации и является показателем доброкачественности товара. Так, румяная блестящая корочка хлеба свидетельствует о его вкусовых и потребительских достоинствах; красный, розовый, зеленый цвет томатов – о степени их зрелости и т.д.
3. Ощущение запаха возникает в органе обоняния, находящемся в носовой полости и возбуждаемом определенными летучими пахучими веществами. Обоняние – чувство чрезвычайно тонкое. Обычный человек без труда различает до 1000 запахов – опытный специалист способен различить от 10 до 17 тысяч запахов. Наряду с понятием запаха используют термины «аромат» для обозначения приятного запаха и «букет» для характеристики сложного аромата, развивающегося в результате ферментативных и химических процессов (при выдержке коньяка и вин, созревании сычужных сыров, рыбных консервов типа шпрот и сардин, обжаривании зерен кофе, ферментации чая).
Запах продукта может быть обусловлен композицией 2-х, нескольких или многих низкомолекулярных компонентов (аромат шоколада, чая, кофе, копчения) либо присутствием ключевого вещества. Многие продукты имеют композиционный аромат, который развивается при созревании плодов, ягод, овощей либо при технологической обработке (обжаривание бобов какао и зерен кофе, выпечка хлеба, копчение мяса и рыбы, брожение пива и др. ферментативные процессы). Ароматообразующие композиции в данных случаях содержат несколько десятков или сотен веществ.
Пороговые концентрации различных веществ колеблются в широких пределах. Например, запах этилового спирта ощущается при концентрации 1 мг/м3 воздуха, масляной кислоты – 0,001 мг/м3, ванилина – 2·10–7 мг/м3. В зависимости от пороговой концентрации и массовой доли вещества человек может воспринимать запах одного и того же соединения по-разному. Например, при большой концентрации индол имеет отвратительный запах, а при незначительной – приятный цветочный аромат.
Химические соединения, обладающие запахом, ощущаются сенсорно достаточно сильно, поэтому обычно они используются в качестве ароматизаторов с массовой долей 1–10 частей на 1 млн. 1 кг пищи с ароматообразующими веществами в количестве 1 часть на 1 млн. содержит только 1 мг этих веществ.
Летучие вещества служат источником информации о качестве продуктов. Раздражая обонятельные рецепторы, они дают человеку сведения о свежести продукта, вызывая аппетит, либо, наоборот, слабым или дефектным запахом сообщают о недоброкачественности пищи. Продукты с высоким содержанием питательных веществ теряют свою ценность, если имеют неприятный запах (как и вкус). Отрицательная оценка запаха используется человеком как сигнал и часто спасает от пищевых отравлений.
Существует несколько систем классификации запахов. Наиболее распространенная из них выделяет 7 основных запахов:
-
камфарный (запах гексахлорэтана);
-
муксусный (запах муксуса, ксилола);
-
цветочный (запах α-амилпиридина);
-
мятный (запах ментола);
-
эфирный (запах эфира);
-
острый (запах муравьиной кислоты);
-
гнилостный (запах сероводорода).
4. Оценка вкуса занимает основное место в органолептике. Вкус продукта определяется в ротовой полости путем возбуждения органов вкуса определенными растворимыми веществами. Поскольку носовая полость сообщается с ротовой полостью, первоначальное обонятельное ощущение часто сливается с вкусовым или дополняется новыми оттенками при определении вкуса. Поэтому для многих продуктов запах и вкус оценивают как один общий показатель качества. Для характеристики комплексного ощущения запаха и вкуса применяют термины «вкусность» или «флевор» (от лат. flavour – аромат). Понятие «флевор» (“флейвор”) может включать и ощущение консистенции продукта, воспринимаемое в ротовой полости. Для описания вкуса и запаха употребляют термины «характерный» или «посторонний». Второе понятие включает не свойственные оцениваемому продукту запах или вкус. Вкусовые и ароматические вещества пищевых продуктов выполняют роль раздражителей и являются столь же необходимыми компонентами питания, как белки, жиры, углеводы и другие вещества пищи.
Физиологический анализ вкусовых ощущений позволил выделить из огромного разнообразия ощущений 4 основных вкуса:
-
сладкий (вкус сахара, сахарина, некоторых аминокислот);
-
кислый (вкус винной, молочной, лимонной, яблочной и др. кислот);
-
соленый (вкус поваренной соли);
-
горький (вкус кофеина, хинина, солей кальция, магния, калия).
Однако сложные вкусовые ощущения не основываются на сочетании этих четырех элементов вкуса. Продукт, попадая в полость рта человека, воздействует на различные рецепторы, вызывая при этом смешанные ощущения вкуса, запаха, боли, температуры, и дополненные зрительными, а иногда и слуховыми ощущениями, в целом определяет аппетит. Например, говорят, что вкус у этого продукта острый (вызывается ощущением не вкуса, а ожога слизистой оболочки), вяжущий (вызывается частичной денатурацией белка под действием дубильных веществ) и т.д.
|
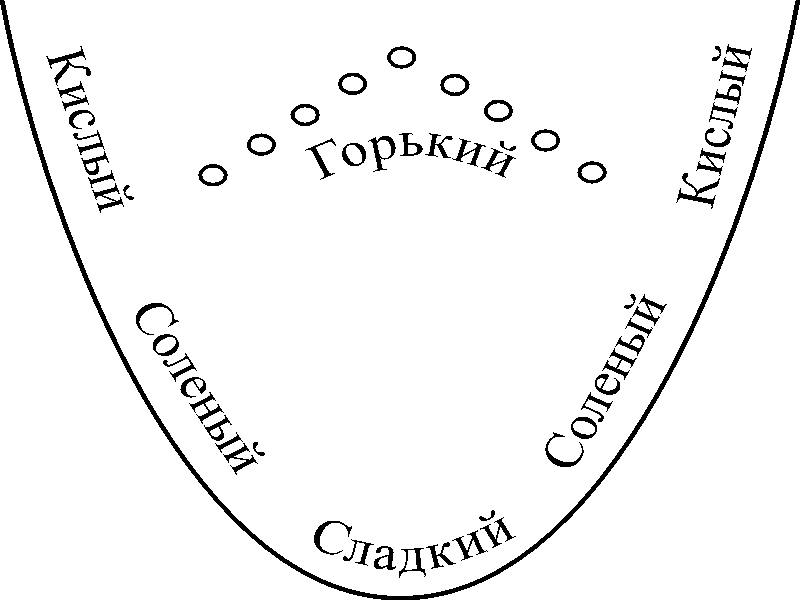
Вкусовые ощущения воспринимаются с различной скоростью. Наиболее быстро возникает ощущение соленого вкуса, затем сладкого и кислого, значительно медленнее – горького. Это объясняется неравномерным расположением вкусовых рецепторов на языке человека (Рис.1.1). При содержании в пищевых продуктах различных вкусовых веществ ощущается сложный вкус: кисло-сладкий (ягоды), кисло-соленый (квашеная капуста), сладко-горький (шоколад). Если в продукте находятся вещества, одновременно вызывающие ощущение кислого и горького вкусов или сладкого и соленого, то эти вкусы воспринимаются раздельно. |
|
|
Рис.1.1. Дифференцирование вкусовых восприятий языка |
Ощущение вкуса может меняться в зависимости от свойств растворенных веществ и их концентрации. Например, раствор NaCl ниже пороговой концентрации воспринимается сладким; сахар и другие вещества с интенсивным сладким вкусом в концентрированном растворе имеют горький вкус.
5. Осязательные или тактильные (от лат. tactilus – осязательный) ощущения позволяют определить консистенцию, структуру, температуру продукта, степень измельчения и некоторые другие физические свойства. Осязание (восприятие кожей) механических раздражителей разделяют на касание, давление (нажим) и вибрацию. В органолептике наиболее важным является ощущение касания.
Чувствительные рецепторы, реагирующие на прикосновение, глубокое осязание, температуру, обильно размещены в ротовой полости, на концах пальцев, ладонях (всего на поверхности кожи и слизистой оболочке расположено около 500 тысяч рецепторов). Способность к осязанию зависит от внешних факторов (при отрицательной температуре осязательная восприимчивость рецепторов снижается) и индивидуальных особенностей дегустатора (обычно с возрастом осязание человека сильно ослабевает).
Наиболее важное осязательное ощущение при оценке качества продукта – консистенция. Это понятие используется для характеристики суммы свойств продукта, воспринимаемых органами зрения, обоняния и осязания. Визуально определяют жидкую, твердую, гранулированную, порошко-, мазе- и сиропообразную консистенцию. С помощью нажима оценивают плотность, эластичность. Органами осязания, находящимися в ротовой полости, ощущают волокнистость, крошливость, нежность и другие признаки консистенции.
Согласно стандарту СЭВ термин «консистенция» означает характерный признак продукта, воспринимаемый ощущениями, возникающими при возбуждении механических и осязательных рецепторов, особенно в ротовой полости, а также при сопротивлении, которое оказывает продукт при попытке его деформировать. Фрагмент классификации параметров консистенции показан на рис.1.2. Консистенция продукта воспринимается потребителем как составляющая флевора. Например, резиноподобный бифштекс вызовет отвращение, даже имея превосходный аппетитный цвет, вкус и аромат.
Параметры консистенции делят на 3 группы:
-
Механические – параметры, характеризующие реакцию продукта на внешнее силовое давление (действие зубов, языка, нёба при пережевывании пищи); к ним относятся твердость, сцепление частиц, вязкость, эластичность, клейкость.
-
Геометрические – параметры, зависящие от микроструктуры продукта. Они подразделяются на 2 подгруппы: параметры, определяемые формой и размерами частиц (обозначаются терминами «однородный», «порошкообразный», «мучнистый», «спекшийся», «рассыпчатый» и др.) и параметры, определяемые формой и ориентацией составляющих текстуру продукта (обозначаются терминами «волокнистый», «слоистый», «стекловидный», «пористый», др.).
-
Прочие параметры – зависящие от присутствия воды или жиров, определяются терминами «сухой», «мокрый», «водянистый», «маслянистый», «жирный» и др.
|
|
|
Рис.1.2. Классификация параметров консистенции пищевых продуктов |
Консистенция не только взаимосвязана с вкусовыми свойствами продукта, но и влияет на усвояемость или характеризует свежесть. Например, присутствие частиц оболочки зерна пшеницы или ржи в муке ухудшает вкус и снижает усвояемость хлеба; о свежести мяса или рыбы судят обычно по запаху и эластичности мышечной ткани. Для придания продукту желаемой консистенции применяют загустители, студнеобразователи, эмульгаторы, пенообразователи, разжижители и другие вещества.
6. В зависимости от поставленной цели применяют различные методы, которые можно подразделить на следующие 3 группы:
-
методы приемлемости и предпочтения – применяют, когда необходимо знать мнение потребителей о качестве продуктов, поэтому к дегустации привлекают большое число потребителей;
-
различительные методы – применяют, когда требуется выяснить, существует ли разница между оцениваемыми образцами;
-
описательные методы (наиболее важные в органолептике) суммируют параметры, определяющие свойства продукта, а в некоторых случаях и порядок проявления отдельных составляющих свойств продукта, т.е. позволяют построить профили свойств (например, запаха, вкуса, консистенции продукта).
В зависимости от степени подготовленности и квалификации дегустаторов органолептические методы можно подразделить на:
-
потребительские методы, в основе которых лежит шкала желательности:
-
аналитические методы, основанные на шкалах интенсивности того или иного импульса.
Среди аналитических методов выделяют:
-
методы качественных различий (методы парного и треугольного сравнения, «дуо-трио», «два из пяти», «А не А», ранговый), позволяющие ответить на вопрос: «имеется ли разница между образцами, оцениваемыми по одному из показателей качества (вкусу, запаху, консистенции, внешнему виду) или общему впечатлению о качестве?», но не отвечают на вопрос: «какова разница между образцами?»;
-
методы количественных различий (методы индекса разбавления, профильный и балльный), позволяющие количественно оценить интенсивность определенного свойства или уровень качества продукта в целом.
Лекция 2. ОПТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
План
-
Спектрофотометрия. Закон Бугера–Ламберта–Бера.
-
Абсорбционная спектроскопия.
-
Рефрактометрия.
-
Поляриметрия.
1. Пусть поток монохроматического излучения с интенсивностью I0 проходит через слой раствора с концентрацией поглощающих частиц С и толщиной l. При этом одна часть потока рассеивается, другая отражается, третья – поглощается. В результате выходящий поток с интенсивностью I1 будет ослаблен, т.е. I1 < I0. Отношение I1/I0 называют пропусканием Т. Оно показывает, какая доля падающего на раствор света поглощается, при этом доля рассеянного и отраженного света обычно мала, и ею пренебрегают. Пропускание часто выражают в процентах. Для абсолютно прозрачных растворов Т = 100 %, для абсолютно непрозрачных растворов Т = 0.
|
lg (I0/I1) = a·C·l |
(2.1) |
Величину lg (I0/I1) называют оптической плотностью и обозначают буквами А или D (далее по тексту только D).
Для абсолютно прозрачного раствора D = 0. Для абсолютно непрозрачного раствора D ® 0.
Оптическая плотность и пропускание связаны между собой выражением
|
D = lg (1/Т). |
(2.2) |
Если Т выражают в процентах, то D = 2 – lg Т.
Коэффициент поглощения а в выражении (2.1) равен оптической плотности раствора при единичных концентрации и толщине слоя и, в зависимости от способа выражения последних, может иметь разные единицы измерения.
Уравнение (2.1) является математическим выражением основного закона светопоглощения или закона Бугера-Ламберта-Бера: количество электромагнитного излучения, поглощенного раствором, пропорционально концентрации поглощающих частиц и толщине слоя раствора. Его можно представить в экспоненциальной формуле:
|
I1 = I0 ·10a·C·l. |
(2.3) |
2. Метод абсорбционной спектроскопии относится к оптическим методам анализа и основан на взаимодействии вещества с излучениями ультрафиолетовой, видимой и инфракрасной областей электромагнитного излучения однородными нерассеивающими системами. Широкое развитие данного метода началось в 1955г., после того, как успехи квантовой теории излучения позволили установить связь различных излучательных и поглощательных процессов, имеющих место в атомных системах. Благодаря теоретическому обоснованию процессов абсорбции удалось получить количественные данные о солнечной и звездной средах: их химическом составе, температурах.
Применение атомной абсорбции в аналитической химии сначала касалось исключительно определения паров ртути в воздухе, и в одном из первых абсорбционных спектрометров использовалось свойство именно паров ртути, т.е. способность находиться в атомном состоянии при комнатной температуре. Позднее появилась работа, посвященная применению атомной абсорбции для анализа газов. Этими единичными работами ограничивалось конкретное аналитическое использование атомно-абсорбционной спектрометрии. В Австралии был предложен рациональный способ регистрации атомной абсорбции и рекомендована схема установки для проведения анализов. В качестве источника света применяли лампу с полым катодом и пламя для получения атомов определяемого элемента из образца раствора, распыляемого в виде тонкодисперсного тумана.
Метод является достаточно простым и имеет несложное аппаратурное оформление, что привлекает внимание аналитиков и сейчас он является одним из наиболее широко используемых. Распространение получили и непламенные методы абсорбции, в которых в качестве атомизатора используют графитовую печь. В настоящее время методы атомной абсорбции с электротермической атомизацией получили более широкое развитие по сравнению с пламенными.
Атомно-абсорбционный метод анализа разработан для определения элементного состава жидких проб, поэтому аналитический процесс метода проводят по установленной схеме.
-
Отбирают определенную массу анализируемого вещества для химической обработки этой навески с целью разрушения структуры вещества.
-
Создают поглощающий слой атомного пара. С этой целью рабочий раствор пробы вводят в атомизатор.
-
Через слой атомного пара пропускают свет от источника, излучающего линейчатый спектр определяемого элемента.
-
Из светового потока выделяют участок спектра соответствующей резонансной линии поглощения.
-
Оценивают сначала величину поглощенной энергии и затем – аналитического сигнала.
-
Строят градуированный график по результатам замера аналитического сигнала для стандартных растворов и определяют расчетный коэффициент для интервала концентраций.
-
Вычисляют концентрацию определяемого элемента.
-
Оценивают правильность результатов анализа партии проб путем сравнения результатов анализа стандартных образцов с данными их аттестации.
3. Если монохроматический луч А проходит через поверхность раздела 2-х сред, то одна часть света А' отражается от поверхности раздела, а другая часть В проходит через 2-ю среду, изменяя при этом направление. Эту часть монохроматического света называют преломленным светом. Преломление луча света описывается законом Снелля:
|
|
(2.5) |
где α – угол падения, β – угол преломления, n1, n2 – показатель преломления 1-й и 2-й сред.
Метод рефрактометрии основан на определении показателя преломления (рефракции). n зависит от температуры, концентрации раствора и длины волны проходящего света. В смеси каждое вещество сохраняет преломляющую способность, и показатель преломления смеси соответствует сумме показателей преломления всех входящих в смесь компонентов.
При прохождении луча света из одной среды в другую, он направлен по прямой, когда падает перпендикулярно на поверхность раздела 2-х сред. Если луч падает под некоторым углом, он преломляется, и отношение синуса угла падения к синусу угла преломления является постоянной величиной и выражается как собственно показатель преломления:
|
|
(2.6) |
|
|
Если луч света А направлен под углом α из среды с меньшим n в среду с большим n, то, изменив направление, он приближается к перпендикуляру РР1 и угол преломления β будет меньше угла падения α (Рис.2.4). Если луч В переходит из среды более плотной в среду менее плотную, то, преломляясь, он удаляется от перпендикуляра, и занимает положение луча А. |
|
|
|
Рис.2.4. Схема преломления луча света |
||
Если при переходе из менее плотной среды в более плотную падающий луч С образует с перпендикуляром луч α', приближающийся к 90о, то соответствующий ему луч преломления D будет давать с перпендикуляром угол β', лежащий в меньшей угловой области. Т.к. угол падения не может быть больше 90о, то соответствующий ему преломленный луч D является пограничным лучом распространения света в этой среде. Луч света Е, падающий под углом, больше предельного, не преломляется, а полностью отражается; он претерпевает «полное внутреннее отражение» от границы раздела, приобретая направление ОЕ1. С правой стороны от луча D будет темнота, а с левой – свет. При переходе к полному отражению резко возрастает яркость света и это дает возможность установить направление предельного луча.
4. Поляриметрией называют метод, основанный на определении оптического вращения. Оптическое вращение – это вращение плоскости поляризации света раствором оптически активного вещества. Оптическому вращению подвергается поляризованный свет. Поляризованный свет отличается тем, что колебания световых волн в нем происходят только в одной плоскости, а в неполяризованном – во всех плоскостях. Плоскость, в которой происходят колебания волн поляризованного света, называют плоскостью поляризации.
Поляризованный свет образуется при прохождении световых лучей через кристаллы, обладающие оптической неоднородностью (исландский шпат, турмалин). Преломление световых волн в разных плоскостях таких кристаллов происходит по-разному. Наименьшему преломлению подвергаются световые волны, плоскость колебаний которых совпадает наилучшим образом с оптическими свойствами кристалла. В кристалле вследствие этого наблюдается раздвоение луча света, причем оба луча поляризованы, но плоскости поляризации у них взаимно перпендикулярны. При этом один луч подвергается большему преломлению, другой – меньшему.
Атомы молекул некоторых веществ способны поляризоваться, т.е. приобретать дипольный момент в электрическом поле. Поляризация атомов обусловлена смещением в молекуле атомов разного типа, что связано с несимметричным распределением в молекуле электронной плотности, т.е. наличием так называемых асимметрических атомов. Вещества, содержащие такие атомы, обладают оптической активностью, т.е. они способны вызывать вращение плоскости поляризации проходящего через исследуемое вещество света.
Величина такого вращения в растворах зависит от их концентрации, поэтому поляриметрию применяют для измерения оптически активных веществ, в частности, сахаров. Асимметрический углеродный атом в сахарах делает их оптически активными, способными вращать плоскость поляризации.
Характерным
показателем каждого оптически активного
вещества является его удельное
вращение
![]() –
угол вращения плоскости поляризации
при 20оС
для линии D
натриевого пламени раствором, содержащим
100 г
вещества в 100 см3,
когда луч в этом растворе проходит путь,
равный 100 мм.
Концентрация вещества (г
в 100 см3
раствора) рассчитывается по формуле:
–
угол вращения плоскости поляризации
при 20оС
для линии D
натриевого пламени раствором, содержащим
100 г
вещества в 100 см3,
когда луч в этом растворе проходит путь,
равный 100 мм.
Концентрация вещества (г
в 100 см3
раствора) рассчитывается по формуле:
|
|
(2.8) |
где
α – угол вращения,
![]() – удельное вращение анализируемого
вещества при 20оС,
l
– длина поляризационной трубки, мм.
– удельное вращение анализируемого
вещества при 20оС,
l
– длина поляризационной трубки, мм.