
- •Кинетика гидролиза сахарозы
- •Общие сведения
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Определение порядка и константы скорости реакции
- •Зависимость скорости реакции от температуры
- •Зависимость скорости реакции от присутствия катализатора
- •Поляриметрический метод
- •Полутеневой поляриметр
- •Реакция гидролиза сахарозы
- •Методика выполнения работы Порядок проведения эксперимента
- •Обработка результатов эксперимента
- •Вопросы к лабораторной работе №1
- •Перегонка
- •Общие сведения
- •Давление пара над бинарными жидкими смесями
- •Температуры кипения бинарных жидких смесей
- •Рефрактометрический метод
- •Рефрактометр Аббе
- •Методика измерения показателей преломления
- •Методика проведения работы Порядок проведения эксперимента
- •Обработка результатов эксперимента
- •Вопросы к лабораторной работе №2
- •Коэффициент распределения
- •Общие сведения
- •Распределение растворённого вещества между двумя несмешивающимися растворителями
- •Экстракция
- •Титриметрический метод
- •Методика проведения работы Порядок проведения эксперимента
- •Обработка результатов эксперимента
- •Вопросы к семинарскому занятию №3
Лабораторная работа № 1
Кинетика гидролиза сахарозы
Цель работы: Исследование кинетики гомогенной реакции гидролиза сахарозы поляриметрическим методом. Определение порядка реакции. Расчёт константы скорости реакции. Определение энергии активации реакции.
Общие сведения
Гомогенной реакцией называется реакция в которой все реагирующие вещества находятся в одной фазе (в данной лабораторной работе речь будет идти только о скоростях гомогенных реакций).
Скоростью гомогенной реакции называется изменение концентрации реагирующих веществ за единицу времени:
![]()
Скорость гомогенной реакции зависит от:
– природы реагирующих веществ;
– концентрации реагирующих веществ;
– температуры;
– присутствия катализатора.
Зависимость скорости реакции от концентрации реагирующих веществ
Кинетическим уравнением реакции называется уравнение, описывающее зависимость скорости данной реакции от концентрации реагирующих веществ.
Порядком реакции называется степень, в которую возводится концентрация в кинетическом уравнении реакции. Большинство реакций относится к реакциям I-го или II-го порядка.
Реакциями I-го порядка называются реакции, скорость которых прямо пропорциональна концентрации реагирующего вещества. Кинетическое уравнение реакции I-го порядка в дифференциальном виде выглядит следующим образом:
![]()
После разделения
переменных:
![]() и интегрирования в пределах от c0
до c
и, соответственно от t0
= 0 до t:
и интегрирования в пределах от c0
до c
и, соответственно от t0
= 0 до t:
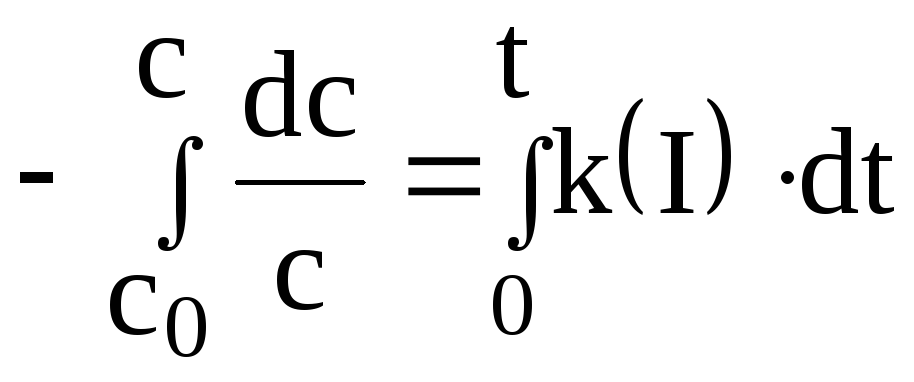 получим кинетическое уравнение реакции
I-го порядка в интегральном виде:
получим кинетическое уравнение реакции
I-го порядка в интегральном виде:
![]()
где: k – константа скорости реакции величина, которой не зависит от концентрации реагирующих веществ (зависит от температуры и наличия катализатора);
c0 – начальная концентрация реагирующего вещества (в момент времени t0 = 0);
c – концентрация реагирующего вещества в момент времени t;
2,3 – пересчётный коэффициент от натурального логарифма к десятичному (ln x = 2,3 lg x).
Реакциями II -го порядка называются реакции, скорость которых пропорциональна концентрации реагирующего вещества (веществ) в квадрате. Кинетическое уравнение реакции II -го порядка в дифференциальном виде выглядит следующим образом:
![]()
После разделения
переменных:
![]() и интегрирования в пределах от c0
до c
и, соответственно от t0
= 0 до t:
и интегрирования в пределах от c0
до c
и, соответственно от t0
= 0 до t:
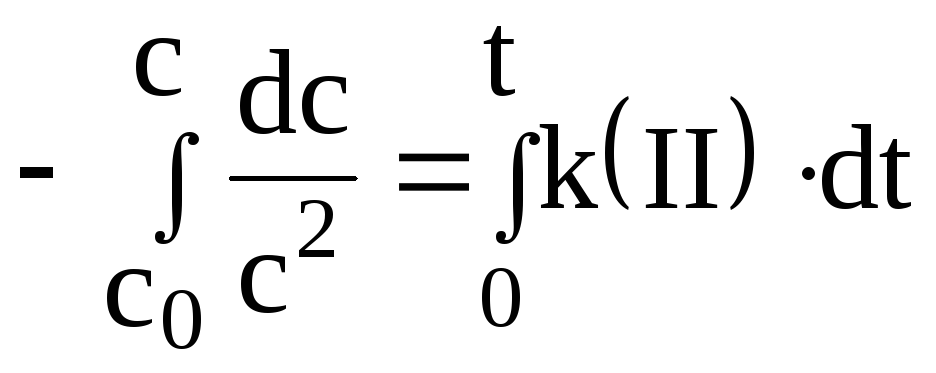 получим кинетическое уравнение реакции
II -го порядка в интегральном виде:
получим кинетическое уравнение реакции
II -го порядка в интегральном виде:
![]()
Определение порядка и константы скорости реакции
Существует несколько способов экспериментального определения порядка и константы скорости реакции по экспериментальным данным. Все эти способы основываются на анализе изменения концентрации одного из реагирующих веществ (или продуктов реакции) во времени.
Рассмотрим наиболее распространённый и удобный графический способ.
Если кинетическое уравнение реакции I-го порядка представить в виде:
![]()
то оказывается,
что для
реакции I-го порядка зависимость lg
c
= f
(t)
должна носить линейный характер.
Линейность этой зависимости, построенной
по экспериментальным данным, позволяет
сделать вывод о том, что данная реакция
является реакцией I-го порядка. Константа
скорости реакции в данном случае
определяется из соотношения:
tg
= –![]() где:
– угол наклона графика зависимости lg
c
= f
(t).
где:
– угол наклона графика зависимости lg
c
= f
(t).
Если описанная зависимость оказывается нелинейной, это свидетельствует о том, что данная реакция не является реакцией I-го порядка. В этом случае представляют кинетическое уравнение реакции II -го порядка в виде:
![]()
Из этого уравнения
следует, что
для реакции II -го порядка должна быть
линейна зависимость
![]() ,
а константа
скорости определяется из соотношения:
tg
= k
где:
– угол наклона графика зависимости
,
а константа
скорости определяется из соотношения:
tg
= k
где:
– угол наклона графика зависимости
![]() .
.
