
- •Оксидами називають бінарні сполуки елементів з Оксигеном, в яких ступінь окиснення Оксигену дорівнює –2.
- •3. Добування та властивості оснόвних солей
- •Константи дисоціації слабких електролітів, присутніх в розчинах карбонатів.
- •Залежність напряму овр від рН середовища
- •1. Взаємодія активних металів з водою
- •4. Взаємодія металів з водою в лужному середовищі
- •4. Захист металів від корозії
- •Продовження табл. 1
4. Захист металів від корозії
а) П а с и в а ц і я заліза під дією концентрованої нітратної кислоти
Два залізних цвяхи старанно обробити наждачним папером, після чого (в витяжній шафі!) один цвях занурити в концентровану нітратну кислоту (1,4г/см3, с%(HNO3 69%), на 3-4 хвилини, вийняти і промити водою. Обидва цвяхи одночасно занурити в 2%-ий розчин NaCl з кількома краплями розчину K3[Fe(CN)6]. Через 2-3 хвилини записати та пояснити спостереження.
б) Сповільнення корозії металів в присутності і н г і б і т о р і в
В дві пробірки набрати по 2-3мл розведеної сульфатної кислоти, після чого в одну з пробірок помістити канцелярську скріпку, а в другу – шматочок алюмінію. Через 2-3 хвилини, коли швидкість виділення газу стабілізується, додати в пробірки невелику кількість інгібітора (уротропіну або формаліну). Через кілька хвилин записати та пояснити спостереження.
ЛАБОРАТОРНА РОБОТА № 12
Визначення вмісту активних оксидів кальцію та магнію в вапні
Повітряними неорганічними в’яжучими речовинами (НВР) називають матеріали, здатні твердіти і зберігати міцність в повітряно-сухих умовах, але недостатньо стійкі в контакті з водою.
В
650 –750 0С
1000 –1200 0С
MgCO3 MgO + CO2 , СаСО3 СаO + CO2 .
При гасінні вапна водою за рівнянням СаО + Н2О Са(ОН)2, rH0 = –65 кДж/моль,
вапно одночасно диспергується (подрібнюється). Після завершення реакції утворюється високодисперсне “вапняне тісто”, над яким знаходиться прозорий насичений (1,56г/л) розчин Са(ОН)2 (вапняна вода). Розведенням “вапняного тіста” одержують суспензію Са(ОН)2 в воді, яка під назвою “вапняне молоко” широко застосовується в хімічній промисловості як найдешевший луг.
Гідравлічними називають НВР, які після замішування з водою і початку твердіння в повітряно-сухих умовах можуть продовжувати твердіти, набувати міцності та зберігати її тривалий час в водному средовищі.
Випалюванням мергелистих вапняків, в яких масова частка глини та піску досягає 6–17%, одержують гідравлічне вапно, яке на 70–80% складається з кальцій та магній силікатів 2СаОSiO2, алюмінатів 2CaOAl2O3 та феритів 2CaOFe2O3, решта – активні оксиди CaO та MgO. Гідравлічне вапно, на відміну від повітряного, перед вживанням не гасять, а розмелюють в порошок. При замішуванні такого порошку з водою перелічені солі повільно розчиняються, гідролізуються і гідратуються з утворенням практично нерозчинних кислих солей – кальцій та магній гідросилікатів, гідроксоалюмінатів та гідроксоферитів. Кристалізуючись по мірі утворення, ці солі скріплюють частинки піску, щебеню та інших наповнювачів в суцільний каменеподібний матеріал, здатний зберігати і нарощувати міцність в воді.
Головною характеристикою вапна є вміст активних оксидів кальцію та магнію, який виражається значенням гідравлічного або основного модуля вапна mгідр:
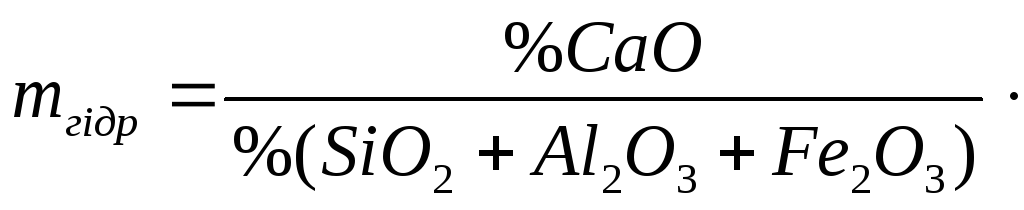 (12.1)
(12.1)
Визначення гідравлічного модуля вапна прямим титруванням наважки вапна кислотою неможливе через те, що це – гетерогенна реакція, і для повного розчинення вільних MeO (де Ме – Ca або Mg) необхідне нагрівання наважки з надлишком хлоридної кислоти nE0(HCl). При цьому відбувається реакція:
надлишок
За законом еквівалентів nE(MeO) = nE(HCl) = nE0(HCl) – nE1(HCl) (12.3).
Для визначення nE1(HCl) продукти реакції після охолодження титрують розчином лугу відомої нормальності сн(NaOH) (зворотне титрування):
nE1(HCl) + nE1(NaOH) nE1(NaCl) + nE1(H2O).
За законом еквівалентів та з визначення еквівалентної концентрації (нормальності) випливає: nE1(HCl) = nE1(NaOH) = V(л)сн(NaOH), (12.4)
де V(л) – об"єм розчину лугу, затраченого на зворотне титрування.
Із
nE0(HCl)=V0(к)сн(HCl)
та 12.3 і 12.4 маємо: nE(MeO)=V0(к)сн(HCl)–V(л)сн(л),
звідки можна розрахувати
![]() , мілімольеквівалентів/грам, ммекв/г.
, мілімольеквівалентів/грам, ммекв/г.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Наважку 0,7-0,8г добре розтертого вапна перенести в конічну колбу на 250мл, додати 10мл дистильованої води і з бюретки точно 25мл 1-нормальної хлоридної кислоти. Закрити колбу пробкою із зворотним холодильником (або скляною лійкою) і обережно нагрівати її до розчинення наважки (протягом 5-7хвилин). Після охолодження стінки колби та внутрішню поверхню зворотного холодильника (або скляну лійку) сполоснути дистильованою водою, додати кілька крапель розчину фенолфталеїну і титрувати надлишок кислоти титрованим 0,5н розчином NaOH, як це детально описано в лабораторній роботі № 5.
Результати та розрахунки
-
Наважка вапна m(вапна) = …г;
-
Об"єм кислоти, взятої для аналізу V0(к) = … мл;
-
Молярна концентрація еквівалентів (нормальність) HCl сн(HCl) = …. мольекв/л;
-
Об"єм розчину лугу, затраченого на зворотне титрування V(л) = …мл;
-
Нормальність розчину лугу сн(NaOH) = …мольекв/л;
-
Кількість речовини еквівалентів активних оксидів в наважці :
nE(MeO) = V0(к)сн(HCl) – V(л)сн(NaOH) = …мольекв;
-
Вміст активних оксидів в вапні
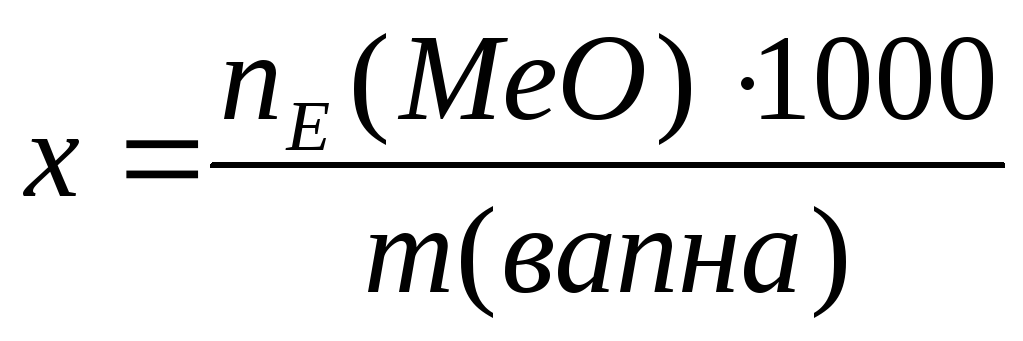 =
… ммекв/г.
=
… ммекв/г.
-
Вважаючи, що Ме = Са, розрахувати m(CaO) та mгідр вапна за рівнянням (12.1).
Таблиця 1
Позначення фізичних та хімічних величин і їх одиниць
|
№ з/п |
Фізична величина |
Одиниця |
||
|
Назва |
Позна-чення |
Назва |
Позначення |
|
|
1 |
Густина речовини |
|
грам на кубічний сантиметр |
г/см3 |
|
2 |
Густина відносна газу (1) за газом (2) |
D1/2,D2(1) |
безрозмірна величина |
– |
|
3 |
Дипольний момент (електричний) |
|
кулон-метр |
Клæм |
|
4 |
Довжина, висота, діаметр, радіус |
l, h, d, r |
метр, сантиметр, міліметр, мікрометр, нанометр |
м, см, мм, мкм, нм |
|
5 |
Довжина хвилі |
|
сантиметр, пікометр (10–12м) |
см, пм |
|
6 |
Енергія |
Е |
джоуль |
Дж |
|
7 |
Енергія внутрішня |
U |
джоуль |
Дж |
|
8 |
Енергія Гельмгольца |
F |
джоуль на моль |
Дж/моль |
|
9 |
Енергія Гіббса |
G |
джоуль на моль |
Дж/моль |
|
10 |
Енергія йонізації |
ЕІ |
джоуль на моль |
Дж/моль |
|
11 |
Енергія спорідненості до електрона |
Ее |
джоуль на моль |
Дж/моль |
|
12 |
Ентальпія |
Н |
джоуль на моль |
Дж/моль |
|
13 |
Ентропія |
S |
джоуль на моль-кельвін |
Дж·моль–1·К–1 |
|
14 |
Заряд електричний |
q |
кулон |
Кл |
|
15 |
Заряд електрона |
е |
1,6æ10–19Кл, елементарна одиниця заряду, елементарний заряд |
е.о.з., е.з. |
|
16 |
Заряд ефективний атома, йона |
|
елементарна одиниця заряду |
е.о.з., е.з. |
|
17 |
Еквівалент речовини |
Е(реч) |
– |
– |
|
18 |
Кількість речовини |
n(реч) |
моль |
моль |
|
19 |
Кількість речовини еквівалентів |
nЕ(реч) |
моль еквівалентів |
мольекв |
|
20 |
Кількість руху |
р |
кілограм-метр за секунду |
Кгæм/с |
|
21 |
Кількість теплоти |
Q |
джоуль |
Дж |
|
22 |
Коефіцієнт поляризованості |
|
сантиметр кубічний |
см3 |
|
23 |
Константа швидкості реакції |
k |
секунда в мінус 1-ій степені (1-й порядок); літр на моль-секунду (2-й пор.) |
с–1; л·моль–1·с–1 |
|
24 |
Константа хімічної рівноваги |
К |
залежить від числа учасників рівноваги |
– |
|
25 |
Константа гідролізу солі |
Кг(солі) |
залежить від числа учасників |
– |
|
26 |
Маса речовини |
т(реч) |
кілограм |
кг |
|
27 |
Масове число нукліда Х |
А(Х) |
безрозмірна величина |
– |
|
28 |
Маса відносна атомна елемента Х Маса відносна молекулярна |
Аr(Х) Мr(реч) |
атомна одиниця маси Þ Þ
|
а.о.м. |
|
29 |
Маса молярна речовини |
М(реч) |
грам на моль |
г/моль |
|
30 |
Маса молярна еквівалентів речовини |
МЕ(реч) |
грам на моль еквівалентів |
г/мольекв |
|
31 |
Молярна концентрація (молярність) речовини |
с(реч) |
моль на літр |
моль/л, М |
