
- •Оксидами називають бінарні сполуки елементів з Оксигеном, в яких ступінь окиснення Оксигену дорівнює –2.
- •3. Добування та властивості оснόвних солей
- •Константи дисоціації слабких електролітів, присутніх в розчинах карбонатів.
- •Залежність напряму овр від рН середовища
- •1. Взаємодія активних металів з водою
- •4. Взаємодія металів з водою в лужному середовищі
- •4. Захист металів від корозії
- •Продовження табл. 1
-
Залежність напряму овр від рН середовища
а) До 1-2мл розчину калій перманганату додати стільки ж розведеної сульфатної кислоти, після чого краплями додавати розчин натрій сульфіту до припинення зміни забарвлення розчину.
б) До 1-2мл розчину калій перманганату краплями додавати розчин натрій сульфіту до припинення змін, що спостерігаються.
в) До 1мл розчину калій перманганату додати 2мл концентрованого розчину калій гідроксиду, після чого краплями додати 1мл розчину натрій сульфіту.
До кожного з дослідів записати спостереження та рівняння реакцій, пам"ятаючи, що сполуки мангану (ІІ) безбарвні, сполуки мангану (ІV) – бурого кольору, а сполуки мангану (VІ) – зелені. Визначити еквіваленти окисникa Е(Ox) та відновника Е(Red) в реакціях 1а, 1б та 1в. До якого типу ОВР відноситься реакція 1г ?
2. Окиснення Fe2+ калій дихроматом
До 5-10 крапель розчину калій дихромату додати стільки ж розведеної сульфатної кислоти, після чого краплями додавати розчин ферум (ІІ) сульфату до припинення змін, що відбуваються. Записати спостереження та рівняння реакції, пам"ятаючи, що зелений колір мають сполуки хрому (ІІІ). Визначити еквіваленти окисникa Е(Ox) та відновника Е(Red).
3. Окисно-відновна двоїстість (амфотерність) речовин
а) До 5-10 крапель розчину калій йодиду додати стільки ж розведеної сульфатної кислоти, після чого краплями додавати розчин натрій нітриту до припинення зміни забарвлення розчину.
б) До До 5-10 крапель розчину калій перманганату додати стільки ж розведеної сульфатної кислоти, після чого краплями додавати розчин натрій нітриту до припинення зміни забарвлення розчину. Записати спостереження та рівняння реакцій, визначити еквіваленти окисникa Е(Ox) та відновника Е(Red) в обох реакціях. Пояснити, чому NaNO2 може бути як окисником, так і відновником, а KI та KMnO4 – тільки чимось одним?
ЛАБОРАТОРНА РОБОТА № 10
Стандартні електродні потенціали металів та хімічні джерела струму
Система Ox + z e– L Red , в якій окиснена та відновлена форми певної речовини перебувають в рівновазі, називається окисно–відновною системою або електродом (синоніми : електрохімічна система, редокс – система).
Найпростішим прикладом такої системи є металічний електрод, в якому катіони (окиснена форма) перебувають в рівновазі з металом (відновлена форма):
Меz+ + z e– L Ме0(к) .
Така рівновага встановлюється на поверхні малоактивного металу (Fe, Zn, Ni), що перебуває в контакті з електролітичним середовищем (водою або водним розчином електроліту). Під дією полярних молекул води частина поверхневих атомів металу переходить в розчин у вигляді гідратованих катіонів, залишивши свої валентні електрони в металі. Через деякий час встановлюється рівновага (10.1) :
Н2О
в розчині
в металі
Йони, які залишаються в розчині, утримуються біля поверхні негативно зарядженого металу. В результаті на поверхні розділу “металрозчин його йонів” утворюється подвійний електричний шар, який нагадує конденсатор, одною обкладкою якого є негативно заряджена поверхня металу, а другою – прилягаючий до неї шар розчину, заряджений позитивно катіонами металу. Різниця потенціалів між поверхнею металу і прилягаючим до неї шаром розчину катіонів металу називається рівноважним електродним потенціалом металу (Меz+/Me).
Якщо до розчину додати розчинної сполуки металу, це означатиме збільшення концентрації одного з учасників рівноваги (10.1) і приведе, згідно принципу Ле Шательє, до її зміщення вліво і до зменшення (Меz+/Me). У випадку дуже малоактивного металу (Cu, Ag, Pt) при достатньо високій концентрації його розчиненої солі на поверхні металу адсорбуються його катіони, заряджаючи її позитивно, а шар розчину, що прилягає до поверхні, аніонами солі заряджається негативно. Таким чином, значення і знак електродного потенціалу залежать від природи учасників електродного процесу та їх концентрації. Залежність електродного потенціалу окисно-відновної системи (ОВС) Ox + ze– L Red від різних факторів виражається рівнянням Нернста
(Ox/Red)
= 0
(Ox/Red)+![]() ln
K–1
=
0(Ox/Red)+
ln
K–1
=
0(Ox/Red)+
![]() ln
ln![]() ,
(10.2)
,
(10.2)
де: 0 – стандартний електродний потенціал, значення якого залежить від природи учасників електродного процесу; R – універсальна газова стала; Т – температура; z – число електронів, що беруть участь в даному електродному процесі; К – константа рівноваги ОВС; F – стала Фарадея, сумарний заряд 1моль електронів. F = NAе.о.з.= 6,021023моль–11,60310–19Кл = 96487 96500 Кл/моль; х та у – стехіометричні коефіцієнти в рівнянні ОВС.
З рівняння (10.2) видно, що (Ox/Red) = 0 при [Ox] = [Red] = 1M, або при [Ox]x/[Red]y = 1. Таким чином,
стандартним є електродний потенціал окисно – відновної системи, в якій концентрації (точніше активності) всіх її учасників дорівнюють 1моль/л.
Для
металічних електродів Меz+
+ z
e–
L
Ме
як гетерогенної
системи
рівняння
(10.2) набуває вигляду:
(Меz+/Me)
= 0
(Меz+/Me)
+
![]() ln
[Меz+].
(10.3) При
Т = Т0 =
298,15 К співвідношення констант R,
Т0
і F,
помножене на
коефіцієнт переходу від ln
до lg
, буде: 2,303
RT/F
= 0, 05917
0,059. Тоді рівняння (10.3) стане:
(Меz+/Me)
= 0
(Меz+/Me)
+
ln
[Меz+].
(10.3) При
Т = Т0 =
298,15 К співвідношення констант R,
Т0
і F,
помножене на
коефіцієнт переходу від ln
до lg
, буде: 2,303
RT/F
= 0, 05917
0,059. Тоді рівняння (10.3) стане:
(Меz+/Me)
= 0
(Меz+/Me)
+
![]() lg
[Меz+]
. (10.4)
lg
[Меz+]
. (10.4)
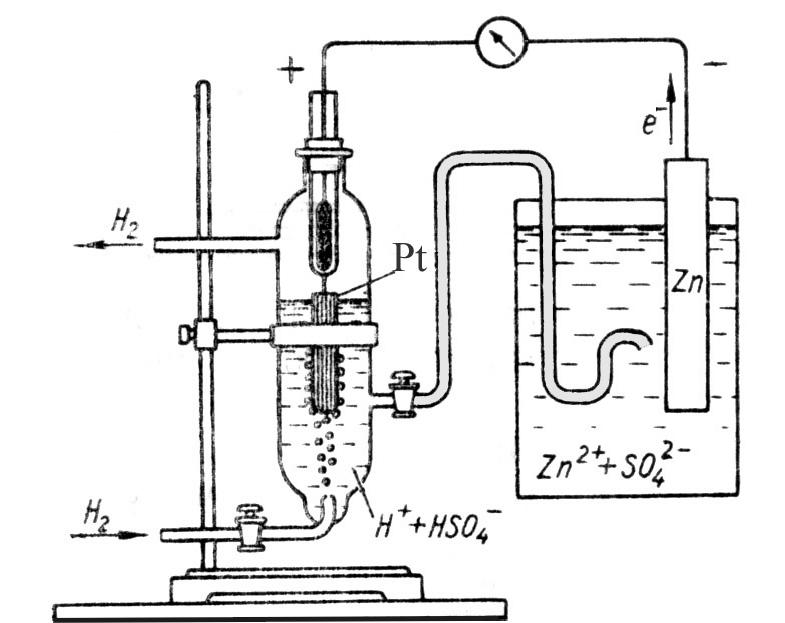
Стандартні електродні потенціали окисно–відновних систем (ОВС) визначають відносно стандартного водневого електрода, потенціал якого прийнято вважати рівним нулю. Стандартний водневий електрод представляє собою платинову пластинку, покриту пористою платиною, занурену в 1М розчин H2SO4 (аН+ = 1M), через яку за стандартних умов ( Р0(Н2) = 101325 Па, Т = Т0 = 298,15 К) пропускається водень. В платині водень розчиняється і частково атомізується за схемою Н2 L 2Н0, а на поверхні платини встановлюється рівновага Н++ е– L Н. Електродний процес в такій системі описується схемою 2Н+ + 2е– L 2Н0(Pt) L Н2, або простіше 2Н+ + 2е– L Н2, потенціал такого електрода 0(2Н+/Н2) = 0. Для визначення 0 стандартний водневий електрод провідником і електролітичним ключем сполучають з досліджуваним електродом (рис. 10.1); при цьому електрони від менш позитивного електрода будуть притягуватися до більш позитивного, в системі утвориться направлений потік електронів, тобто електричний струм. Напруга цього струму, яку вказує включений в зовнішнє коло мілівольтметр, дорівнює різниці потенціалів електродів і, оскільки 0(2Н+/Н2) = 0, абсолютному значенню 0 досліджуваного електрода. Знак 0 залежить від напрямку руху електронів. В нашому прикладі електрони від цинку рухаються до водневого електрода, тобто цинковий електрод негативніший від водневого, 0(Zn2+/Zn) < 0.
В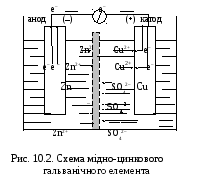 изначені
таким чином 0(Ox/Red)
різних ОВС,
розміщені в порядку зростання їх
алгебраїчних
значень,
утворюють шкалу
стандартних
електродних потенціалів, фрагментом
якої є ряд стандартних електродних
потенціалів
металів, який
іноді традиційно називають електрохімічним
рядом напруг
металів. Чим
більше алгебраїчне значення 0(Ox/Red)
речовини, тим
сильнішим окисником є її окиснена форма
і тим слабкішим відновником є її
відновлена форма.
изначені
таким чином 0(Ox/Red)
різних ОВС,
розміщені в порядку зростання їх
алгебраїчних
значень,
утворюють шкалу
стандартних
електродних потенціалів, фрагментом
якої є ряд стандартних електродних
потенціалів
металів, який
іноді традиційно називають електрохімічним
рядом напруг
металів. Чим
більше алгебраїчне значення 0(Ox/Red)
речовини, тим
сильнішим окисником є її окиснена форма
і тим слабкішим відновником є її
відновлена форма.
Рис. 10.1. Схема
приладу для
визначення
0(Zn2+/Zn)
Звідси випливає висновок про напрям перебігу ОВР: окисно-відновні реакції відбуваються в напрямі відновлення найсильнішого із присутніх в системі окисників (з найбільшим значенням (Ox/Red)) найактивнішим із відновників (з найменшим значенням (Ox/Red)). В водних розчинах найактивнішим відновником є металічний літій, а найсильнішим окисником є газ фтор. Серед окиснених форм металів найсильнішим окисником є катіони золота (І) Au+.
Система з двох електродів, сполучених провідником та електролітичним ключем, в якій хімічна енергія ОВР перетворюється в електричну, називається гальванічним елементом (ГЕ).
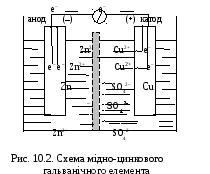
В ГЕ, зображеному на рис.10.2, електрони від активнішого металу (Zn) рухаються по провіднику до менш активного металу (Сu), на поверхні якого відновлюють адсорбовані з розчину йони Сu2+, утворюється епектричний струм. Вказані процеси описуються рівняннями :
 Zn0
– 2е–
Zn2+
– напівреакція окиснення (анод);
Zn0
– 2е–
Zn2+
– напівреакція окиснення (анод);
Cu2+ + 2е– Cu0 – напівреакція відновлення (катод); Zn0 + Cu2+ Zn2+ + Cu0 – струмоутворююча ОВР.
Хімічними символами мідно – цинковий ГЕ можна записати
( – )ZnZnSO4CuSO4Cu( + ), або скорочено ( – )ZnZn2+ Cu2+Cu( + ),
де вертикальна риска символізує поверхню розділу “метал – електроліт”, а подвійна риска – електролітичний ключ. Прилад для визначення 0(Zn2+/Zn) (див. рис.10.1) – це ГЕ, зібраний із стандартних водневого та цинкового електродів, схему якого можна записати: ( – ) Zn ZnSO4 Н2SO4 Н2 , Pt ( + ) .
Максимальна різниця електродних потенціалів ГЕ, яка відповідає термодинамічно оборотному перебігу струмоутворюючої ОВР, називається напругою гальванічного елемента Е = (катода) – (анода).
Термодинамічно
оборотний перебіг реакції відповідає
стану системи, близькому до рівноваги,
коли сила струму, що проходить через ГЕ
(відбирається
від ГЕ),
прямує до нуля (І0
при зовнішньму опорі R∞).
![]() Напруга
ГЕ при розімкнутому
зовнішньому
електричному колі чисельно дорівнює
його електрорушійній силі (е.р.с.).
При замкнутому
зовнішньому колі напруга ГЕ – це та
частина
е.р.с.,
яка дорівнює роботі переміщення одиниці
позитивного заряду по зовнішньому
колу від одного
полюса ГЕ до другого. В ході ОВР
концентрації учасників електродних
процесів змінюються, і, як наслідок,
змінюються потенціали електродів. Зміна
потенціалу електрода при проходженні
струму називається поляризацією
електрода.
Внаслідок
поляризації електродів під час роботи
ГЕ його напруга постійно падає,
і тим швидше, чим більша сила струму, що
проходить через нього.
Напруга
ГЕ при розімкнутому
зовнішньому
електричному колі чисельно дорівнює
його електрорушійній силі (е.р.с.).
При замкнутому
зовнішньому колі напруга ГЕ – це та
частина
е.р.с.,
яка дорівнює роботі переміщення одиниці
позитивного заряду по зовнішньому
колу від одного
полюса ГЕ до другого. В ході ОВР
концентрації учасників електродних
процесів змінюються, і, як наслідок,
змінюються потенціали електродів. Зміна
потенціалу електрода при проходженні
струму називається поляризацією
електрода.
Внаслідок
поляризації електродів під час роботи
ГЕ його напруга постійно падає,
і тим швидше, чим більша сила струму, що
проходить через нього.
Різниця стандартних електродних потенціалів напівелементів називається стандартною напругою Е0 гальванічного елемента. Напр., стандартна напруга мідно-цинкового ГЕ буде: Е0 = 0(Cu2+/Cu) – 0(Zn2+/Zn) = 0,34 – (– 0,76) = 1,10 (В).
Якщо ж ГЕ складається з нестандартних електродів, то для визначення його напруги необхідно спочатку розрахувати значення потенціалів цих електродів (для металічних електродів – за рівнянням 10.4).
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
