
- •Оксидами називають бінарні сполуки елементів з Оксигеном, в яких ступінь окиснення Оксигену дорівнює –2.
- •3. Добування та властивості оснόвних солей
- •Константи дисоціації слабких електролітів, присутніх в розчинах карбонатів.
- •Залежність напряму овр від рН середовища
- •1. Взаємодія активних металів з водою
- •4. Взаємодія металів з водою в лужному середовищі
- •4. Захист металів від корозії
- •Продовження табл. 1
МІНІСТЕРСТВО ОСВІТИ і НАУКИ УКРАЇНИ
Український державний університет водного господарства
та природокористування
Кафедра загальної хімії
МЕТОДИЧНІ ВКАЗІВКИ
до лабораторних робіт з дисципліни “Хімія"
для студентів спеціальностей 6.130100, 6.100400
та 6.092500.
Затверджено на засіданні
методичної комісії
спеціальності 6.130100,
протокол № 10 від 25.11.2002р.
Затверджено на засіданні
методичної комісії
спеціальності 6.100400,
протокол № 18 від 29.11.2002р.
Затверджено на засіданні
методичної комісії
спеціальності 6.092500,
протокол № 2 від 28.11.2002р.
РІВНЕ 2002
"Методичні вказівки до лабораторних робіт з дисципліни “Хімія" для студентів спеціальностей 6.130100, 6.100400 та 6.092500" / Ф. М. Боднарюк, – Рівне: УДУВГП, 2002, 40с.: іл./
Укладач Боднарюк Ф. М., канд. хім. наук, доцент.
Відповідальний за випуск завідувач кафедри хімії Яцков М. В.
ЗМІСТ
Передмова 4
-
Лабораторна робота № 1. Визначення молярної маси еквівалентів металу… 5
-
Лабораторна робота № 2. Добування та властивості оксидів, основ та
амфотерних гідроксидів……………………………. 8
-
Лабораторна робота № 3. Добування та властивості кислот та солей……… 11
-
Лабораторна робота № 4. Дослідження залежності швидкості реакції від
концентрації реагентів…………………………… 14
-
Лабораторна робота № 5. Приготування розчину хлоридної кислоти та
визначення його концентрації титруванням …….. 17
-
Лабораторна робота № 6. Реакції обміну в розчинах електролітів…….…….. 20
-
Лабораторна робота № 7. Електролітична дисоціація води та визначення рН
розчинів…………………………………………. 23
-
Лабораторна робота № 8. Дослідження гідролізу солей……………………… 25
-
Лабораторна робота № 9. Окисно-відновні реакції…………………………… 29
10. Лабораторна робота №10. Стандартні електродні потенціали металів та
хімічні джерела струму………………………….. 31
11. Лабораторна робота №11. Корозія металів та методи захисту від неї………. 35
-
Лабораторна робота №12. Визначення вмісту активних оксидів кальцію та
магнію в вапні ……………………………………. 39
Рекомендована література :
-
Боднарюк Ф.М. Хімія.Частина І (загальнохімічна): Навч. посібник. – Рівне: РДТУ, 1999.– 112с.
-
Боднарюк Ф.М. Хімія. Частина ІІ (спеціальна): Навч. посібник. – Рівне: РДТУ, 1999.– 90с.
-
Хомченко Г.П. Посібник з хімії для вступників до вузів: Пер. з рос. – К.: А.С.К., 2000. – 480с.: іл.
-
Глинка Н.Л. Задачи и упражнения по общей химии: Учеб. пособие /Под ред. В.А.Рабиновича и Х.М. Рубиной. – 24-е изд., испр. – Л.: Химия, 1986. – 272с.
-
Хомченко Г. П., Хомченко И. Г. Задачи по химии для поступающих в вузы: Учеб. пособие. – М.: 1987. – 238с.
-
Степин Б.Д. Применение Международной системы единиц физических величин в химии: Практ. пособие. – М., 1990. – 96с.
ПЕРЕДМОВА
В процесі виконання лабораторного практикуму з хімії студенти повинні закріпити теоретичні знання з найважливіших розділів програми, навчитись працювати з простими лабораторними приладами та хімічним посудом, коротко і повно описувати явища, що відбуваються при виконанні дослідів та писати рівняння відповідних реакцій, виконувати прості вимірювання та розрахунки на їх основі, узагальнювати результати дослідів у вигляді коротких висновків.
Готуючись дома до виконання лабораторної роботи, студент повинен:
-
за вказаною літературою вивчити теоретичний матеріал з даної теми, стисло наведений у вигляді теоретичного вступу до кожної роботи;
-
виконати письмове домашнє завдання (розв'язати вказані викладачем задачі) ;
-
законспектувати експериментальну частину роботи, тобто опис виконання дослідів.
Непідготовлені студенти до виконання роботи не допускаються і виконують її після належної підготовки поза основним розкладом за спеціальним графіком під керівництвом чергового викладача.
При виконанні вимірювань їх результати записувати безпосередньо в зошит (ніяких чернеток!). При виконанні дослідів, в яких немає кількісних вимірювань, безпосередньо після кожного досліду студент повинен в заданій послідовності :
-
записати в зошит (ніяких чернеток!) спостереження, наприклад, зміну кольору розчину чи осаду, утворення чи розчинення осаду, виділення газу, зміну температури реакційної суміші тощо;
-
написати рівняння всіх реакцій, наслідком перебігу яких можуть бути явища, що спостерігаються;
-
в рівняннях під формулами основних продуктів реакції записати їх назви, в тому числі технічні;
-
записати обгрунтовані висновки відповідно до мети досліду, коротко сформульованої в його назві;
-
в необхідних випадках за вказівкою викладача нарисувати принципіальну схему використаного в роботі лабораторного приладу.
Лабораторна робота вважається виконаною лише за умови, якщо в кінці заняття в зошиті студента записані всі результати вимірювань і спостереження! Рівняння реакцій, висновки, а в деяких випадках і розрахунки можуть бути закінчені дома і представлені при захисті звіту про виконання лабораторної роботи на наступному занятті.
Зошити з належним чином оформленими і захищеними звітами про виконання всіх лабораторних робіт та правильно виконаними всіма домашніми завданнями свідчать про виконання студентами навчального плану і є підставою для їх допуску до складання екзамену з хімії.
ЛАБОРАТОРНА РОБОТА № 1.
Визначення молярної маси еквівалентів металу
Еквівалентом
речовини називається частина формульної
одиниці цієї речовини, яка в даній
реакції еквівалентна (рівноцінна) одному
атомові Гідрогену або одному електронові
:
Е(реч) =![]() ФО(реч)
= f
·ФО(реч),
(1.1)
ФО(реч)
= f
·ФО(реч),
(1.1)
де z – еквівалентне число, f = 1/z – фактор еквівалентності.
Напр., із формули НСl видно, що з одним атомом Гідрогену сполучається 1атом Сl, отже, в реакції утворення НСl одному атомові Гідрогену еквівалентний атом Хлору, тобто в цій реакції Е(Сl2) = Сl. Із формули Н2О видно, що в реакції водню з киснем Е(О2) = 1/2О, тобто еквівалентом кисню є половина атома Оксигену. Таким чином, при визначенні Е простої речовини за формулою (1.1) за ФО беруть атом відповідного елемента, а z дорівнює його валентності в даній реакції.
Маса NA еквівалентів речовини, тобто маса 1 моль її еквівалентів, називається молярною масою еквівалентів речовини
МЕ(реч)
= m
(![]() ФО)·NA=
M
(
ФО)·NA=
M
(![]() ФО)
=
ФО)
=
![]() M(реч).
(1.2)
M(реч).
(1.2)
Н
![]()
![]()
![]() апр.:
МЕ(Сl2)
= М(Сl)
= 35,5г/моль; ME(О2)
= M(1/2O)
= 1/2М(О)
= 8г/моль. Аналогічно кількості речовини
n(реч)
кількість
речовини еквівалентів або
кількість моль еквівалентів речовини
nЕ(реч)
визначають
за формулами:
апр.:
МЕ(Сl2)
= М(Сl)
= 35,5г/моль; ME(О2)
= M(1/2O)
= 1/2М(О)
= 8г/моль. Аналогічно кількості речовини
n(реч)
кількість
речовини еквівалентів або
кількість моль еквівалентів речовини
nЕ(реч)
визначають
за формулами:
(1.4);
(1.3); (1.5).
д
знаходимо
знаходимо![]() (1.6)
(1.6)
Із пропорції :
М(г) за н.у. займає об'єм VM
МЕ(г)………………..VE(г)
Напр.:
![]() ;
;
VE(O2) = VM.·ME(O2) / M(O2) = 22,4·8 / 32 = 5,6 (л/мольекв).
Кількість речовини та кількість речовини еквівалентів зв'язані співвідношенням :
nE (реч) = z·n(реч) (1.7).
Прості речовини, атоми яких в різних реакціях проявляють різну валентність, відповідно мають різні еквіваленти, як це видно на прикладі еквівалентів азоту в різних його сполуках (табл. 1.1).
Таблиця 1.1.
Е, МЕ та VЕ азоту в різних сполуках.
|
Сполука |
z (N) |
Е (N2) |
МE (N2), г/мольекв |
VE (N2), л/мольекв |
|
NH3 , N2O |
1 |
N |
14 |
11,2 |
|
NO |
2 |
1/2N |
7 |
5,6 |
|
N2O3 |
3 |
1/3N |
4,67 |
3,73 |
|
NO2 |
4 |
1/4N |
3,50 |
2,8 |
|
N2O5 |
5 |
1/5N |
2,80 |
2,24 |
Із поняття Е(реч) випливає закон еквівалентів: в хімічних реакціях речовини реагують і утворюються в еквівалентних кількостях.
Для реакції aA + bB = cC + dD закон еквівалентів виражається рівнянням: nE(A) = nE(B) = nE(C) = nE(D) (1.8).
Замінивши в рівнянні (1.8) кількість моль еквівалентів речовин їх значеннями згідно (1.4), закон еквівалентів для пари речовин напр., (А) та (В), можна виразити рівнянням (1.9), а якщо один з учасників реакції – газ, то рівнянням (1.10) :
![]()
![]()
(1.9);
(1.10);
Аналогічно за формулою (1.1) визначають еквіваленти складних речовин.
При визначенні еквівалентів оксидів металів в реакціях утворення солей z дорівнює добутку валентності металу на число його атомів в ФО оксиду :
Е(СаО) = 1/2 СаО; МЕ(СаО) = М(1/2СаО) = 1/2 М(СаО).
Е(Fe2O3) = 1/2·3 Fe2O3 = 1/6 Fe2O3; МЕ(Fe2O3) = 1/6 M(Fe2O3).
В реакціях утворення оксидів формули ЕlxOy : МЕ(ЕlxOy) = МЕ(Еl) + МЕ(O2).
При визначенні еквівалента кислоти еквівалентне число z дорівнює її основності в даній реакції. Напр., в реакції (1) ортофосфатної кислоти з надлишком лугу відбувається повна нейтралізація цієї триосновної кислоти, в даній реакції від кожної молекули кислоти відриваються три гідроген-йони, тобто одна молекула кислоти еквівалентна трьом атомам Гідрогену, і тому z1 = 3:
1. H3PO4 + 3KOH K3PO4 + 3H2O, E1(H3PO4) = 1/3 H3PO4.
Якщо реагенти взяті в співвідношеннях, вказаних в рівнянні (2), то та ж триосновна кислота реагує як двоосновна, тому в даній реакції z2 = 2:
2. H3PO4 + 2KOH K2HPO4 + 2H2O, E2(H3PO4 ) = 1/2 H3PO4.
Коли ж триосновна кислота взята з великим надлишком, то вона реагує як одноосновна, тому в реакції (3) z3(H3PO4) = 1:
3. H3PO4 + KOH KH2PO4 + H2O, E3(H3PO4) = H3PO4.
При визначенні еквівалента основи z дорівнює її кислотності в даній реакції. Напр., в реакції ферум (ІІІ) гідроксиду з надлишком кислоти відбувається повна нейтралізація цієї трикислотної основи :
1. Fe(OH)3 + 3HCl FeCl3 + 3H2O, E1(Fe(OH)3) = 1/3 Fe(OH)3.
У випадку недостатньої кількості кислоти можлива часткова нейтралізація основи, тоді в реакції (2) z = 2, а в реакції (3) z = 1:
2. Fe(OH)3 + 2HCl FeOHCl2 + 2H2O, E2(Fe(OH)3 = 1/2 Fe(OH)3.
3. Fe(OH)3 + HCl Fe(OH)2Cl + H2O, E3(Fe(OH)3 = Fe(OH)3.
При визначенні еквівалентів солей в реакціях обміну максимальне значення еквівалентного числа z в загальному випадку дорівнює добутку заряду катіонів (основних залишків) на їх число в одній формульній одиниці солі. Напр., для ферум (III) сульфату при його взаємодії з надлишком лугу за рівнянням (1)
1. Fe2(SO4)3 + 6NaOH 2Fe(OH)3 +3Na2S z1 = 3 2 = 6 , а Е1 = 1/6 Fe2(SO4).
У випадку недостатньої кількості лугу відбувається реакція (2)
2. Fe2(SO4)3 + 2NaOH 2FeOHSO4 + Na2SO4,
з рівняння якої видно, що з одною ФО солі в даній реакції реагують лише 2Е (NaOH), тобто z2(Fe2(SO4)3 ) = 2, а E2(Fe2(SO4)3 ) = 1/2 Fe2(SO4)3.
При визначенні еквівалентів йонів в реакціях обміну еквівалентне число z дорівнює величині заряду йона: Е(ОН–) = ОН– ; Е(SО42–) = 1/2 SO42– ; Е(Ca2+) = 1/2Ca2+.
Із закону еквівалентів також випливає, що в реакціях обміну:
МЕ(солі) = МЕ(катіона) + МЕ(аніона); МЕ(основи)=МЕ(катіона) + МЕ(ОН–).
В загальному випадку при визначенні еквівалентів речовин в конкретних реакціях слід керуватися законом еквівалентів.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Мета роботи – шляхом вимірювання об'єму водню, який виділяється при розчиненні певної маси металу в розведеній сульфатній кислоті, визначити МЕ(Ме) та, з'ясувавши у викладача його валентність, встановити, який це метал.
Прилад для виконання роботи (рис. 1.1) – закріплені в штативі дві бюретки на100мл, сполучені гумовою трубкою і наполовину заповнені водою. До одної з бюреток в
х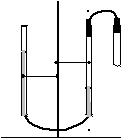 оді
роботи щільно приєднують пробірку з
кислотою, в якій розчиняють приготовану
заздалегідь наважку металу. На одному
приладі роботу виконують двоє студентів.
оді
роботи щільно приєднують пробірку з
кислотою, в якій розчиняють приготовану
заздалегідь наважку металу. На одному
приладі роботу виконують двоє студентів.
Б1
Рис. 1.1. Прилад для визначення
молярної маси еквівалентів
металу.
Порядок виконання роботи
-
Записати масу наважки металу, m = ………. г.
-
За допомогою барометра-анероїда і термометра визначити та записати атмосферний тиск Р = …… і температуру t = …..0C в лабораторії.
-
За табл. 1.2 визначити і записати тиск насиченої водяної пари Рн2о = …… .
Таблиця 1.2
Залежність тиску насиченої водяної пари від температури
|
t, 0 C |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
|
|
Рн2о |
мм рт.ст. |
12,8 |
13,6 |
14,5 |
15,6 |
16,5 |
17,5 |
18,6 |
19,4 |
21,0 |
|
кПа |
1,71 |
1,82 |
1,94 |
2,08 |
2,20 |
2,34 |
2,48 |
2,59 |
2,80 |
|
-
Перевірити прилад на герметичність. Для цього до однієї з бюреток щільно приєднати порожню пробірку, після чого одну з бюреток (разом з лапкою!) підняти на 15-20см і закріпити. Прилад вважається герметичним, якщо після цього рівень рідини в бюретках залишається на різній висоті без змін протягом 2-3 хвилин.
-
Зняти пробірку і закріпити бюретку на попередній висоті, після чого записати, на якій поділці знаходиться рівень рідини в бюретці Б1, до якої приєднується пробірка (V1 =…..мл). При цьому око спостерігача, поділка на бюретці і нижній край меніска рідини повинні бути на одній горизонтальній лінії.
-
Через маленьку лійку налити в пробірку 5мл розведеної H2SO4 (не більше 1/4 пробірки) так, щоб не змочити верхню частину пробірки. Якщо верхня частина пробірки виявилась мокрою, її треба протерти фільтрувальним папером.
-
На внутрішню поверхню верхньої частини пробірки, яку в нахиленому стані тримає один студент, другий обережно переносить із паперового пакетика наважку металу, після чого нахилену пробірку щільно треба приєднати до бюретки і обережно відпустити. При цьому метал падає в кислоту і швидко розчиняється.
-
Через кілька хвилин після розчинення металу (припинення виділення водню), не від'єднуючи пробірку, переміщувати одну бюретку відносно другої по висоті доти, поки рідина в обох бюретках не встановиться на однаковому рівні, і закріпити її.
-
Записати, на якій поділці знаходиться рівень рідини в бюретці Б1, V2 = …. мл.
Розрахунки
-
Знайти об'єм водню, що виділився V(H2) = V2 – V1 =…….мл.
-
Звести V(H2) до об'єму водню за нормальних умов Vн(H2) за рівнянням стану
г
(1.11) звідки![]()
![]()
де : Pн, Тн – нормальні тиск і температура; Т = t + Тн – абсолютна температура під час досліду; P(H2) = Р - Рн2о – тиск водню в бюретці.
-
За законом еквівалентів nE(Me)= nE(H2) або
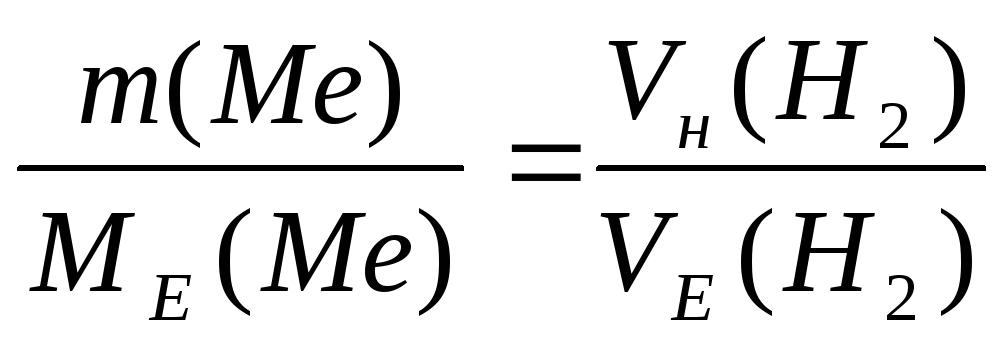 ,
звідки
,
звідки
![]()
4. З
рівняння МЕ(Ме)
=![]() M(Ме)
знаходимо
M(Ме)
= zМЕ(Ме).
M(Ме)
знаходимо
M(Ме)
= zМЕ(Ме).
5. Порівнюючи знайдене числове значення М(Ме) з відносними атомними масами двовалентних металів, встановити, з яким металом проводився дослід.
6. Розрахувати відносну похибку визначення МЕ(Ме) за формулою
% похибки

 МЕ(Ме)
теор.
МЕ(Ме)
теор.
де МЕ(Ме)теор. – це значення МЕ(Ме), розраховане для даного металу за його атомною масою, взятою із довідника.
ЛАБОРАТОРНА РОБОТА № 2.
Добування та властивості оксидів, основ та амфотерних гідроксидів
Оксидами називають бінарні сполуки елементів з Оксигеном, в яких ступінь окиснення Оксигену дорівнює –2.
За властивостями оксиди в першу чергу діляться на солетворні та несолетворні (індиферентні). До несолетворних відносяться оксиди, які за звичайних умов не реагують з водою, кислотами, основами та іншими оксидами. З небагатьох таких оксидів найважливіші : N2O, NO, CO.
Солетворними називають оксиди, які реагують з іншими оксидами та їх гідратами (основами, кислотами, амфотерними гідроксидами) з утворенням солей. За властивостями вони діляться на основні, кислотні та амфотерні.
Оснόвними називають оксиди, які реагують з кислотними оксидами та їх гідратами (кислотами) з утворенням солей. Продуктами приєднання води до оснόвних оксидів (тобто їх гідратації) є основи. Оснόвні властивості мають оксиди активних металів (ІА та ІІА підгруп), а також оксиди більшості перехідних металів (d- та f-елементів) в нижчих (переважно +1, +2) ступенях окиснення :
Na2O + CO2 Na2CO3; CrO + 2HCl CrCl2 + H2O;
3CaO + P2O5 Ca3(PO4)2 ; 3CaO + 2H3PO4 Ca3(PO4)2 + 3H2O.
Кислотними оксидами або ангідридами називають оксиди, які реагують з оснόвними оксидами та їх гідратами (основами) з утворенням солей. Продукти їх гідратації – кислоти. Кислотні властивості мають оксиди неметалів, а також оксиди перехідних металів в найвищих ступенях окиснення.
СО2 + 2КОН К2СО3 + Н2О; СrO3 + 2KOH K2CrO4 + H2O.
SiO2 + 2NaOH Na2SiO3 + H2O; Mn2O7 + 2KOH 2KMnO4+ H2O.
Амфотерними називають оксиди, які мають слабко виражені як оснόвні, так і кислотні властивості, тобто здатні реагувати і з кислотами, і з сильними основами. Практично нерозчинні в воді амфотерні оксиди в результаті непрямої гідратації перетворюються в амфотерні гідроксиди.
Амфотерні властивості мають оксиди та гідроксиди малоактивних металів (берилію, цинку, алюмінію), а також перехідних металів в середніх ступенях окиснення: оксиди хрому (III), титану (IV), мангану (IV) тощо.
Таким чином, хімічні властивості оксидів перехідних металів при зростанні ступеня їх окиснення змінюються від оснόвних через амфотерні до кислотних:
 підсилення
кислотності
оксидів
підсилення
кислотності
оксидів

 CrO
Cr2O3
CrO3
CrO
Cr2O3
CrO3
оснόвний амфотерний кислотний
З кислотними оксидами та кислотами амфотерні оксиди реагують як оснόвні, з них формуються оснόвні залишки (катіони) солей, що при цьому утворюються.
Al2O3 + 3H2SO4 Al2(SO4)3 + 3H2O
Як правило, кислотні властивості амфотерних оксидів виражені ще слабкіше, ніж оснόвні, тому з помітною швидкістю вони реагують тільки з сильно оснόвними оксидами та їх гідратами при високих температурах. В цих реакціях з амфотерних оксидів формуються кислотні залишки солей.
При сплавленні безводних реагентів (t >>100 0C) відбуваються реакції:
Al2O3+ Na2O 2NaAlO2 – натрій мета-алюмінат ;
Al2O3 + 2NaOH 2NaAlO2 + H2O;
Al2O3 + 6NaOH 3H2O + 2Na3AlO3 - натрій орто-алюмінат.
За звичайних умов такі солі приєднують воду з утворенням комплексних солей : NaAlO2 + 2 H2O Na[Al(OH)4] - натрій тетра-гідроксоалюмінат;
Na3AlO3 + 3H2O Na3[Al(OH)6] - натрій гекса-гідроксоалюмінат.
Такі ж комплексні солі є продуктами безпосередньої взаємодії амфотерних оксидів з концентрованими водними розчинами лугів :
Al2O3 + 2NaOH+3H2O 2 Na[Al(OH)4]; Al2O3 + 6NaOH+3H2O 2 Na3[Al(OH)6].
Крім назв за номенклатурою IUPAC ряд оксидів мають також історичні або технічні назви.
Напр.: СаО – негашене (палене) вапно; MgO – палена магнезія; Al2O3 – глинозем; SiO2 – пісок, кварц, кремнезем; CO – чадний газ; CO2 –– вуглекислий газ.
Основами називають сполуки, які дисоціюють на гідроксид-аніони ОН-- та катіони оснόвних залишків.
Загальна хімічна властивість основ – здатність реагувати з кислотами та їх ангідридами з утворенням солей. Основи є продуктами гідратації (гідратами) оснόвних оксидів. Розчинні в воді основи (луги) утворюються в результаті прямої гідратації розчинних в воді оснόвних оксидів :
К2О + Н2О 2КОН; СаО + Н2О Са(ОН)2 («гасіння вапна») .
Водний розчин аміаку, в якому має місце сильно зміщена вліво рівновага
NH3 + H2O L NH3·H2O L NH4+ + OH--,
в реакціях поводиться як слабка основа NH4OH – амоній гідроксид.
Число ОН–-йонів, які можуть утворитися з одної ФО основи, визначає кислотність основи : LiOH Li+ + OH-- – однокислотна основа.
Багатокислотні основи дисоціюють ступінчасто :
1) Са(ОН)2 L ОН– + СаОН+ ; 2) СаОН+ L ОН– + Са2+.
гідроксокальцій-катіон; кальцій-катіон
Нерозчинні в воді основи одержують в дві стадії непрямою гідратацією оксидів:
1) СuO + H2SO4 CuSO4 + H2O ; 2) CuSO4 + 2NaOH Cu(OH)2 + Na2SO4. Ряд широко вживаних основ крім звичайних мають і технічні (історичні) назви :
КОН – їдке калі; NaOH – їдкий натр, каустична сода, каустик ;
Са(ОН)2 – гашене вапно; NH4OH - нашатирний спирт.
Амфотерні гідроксиди – це практично нерозчинні в воді продукти непрямої гідратації нерозчинних в воді амфотерних оксидів:
1. ZnO + 2HCl ZnCl2 + H2O; 2. ZnCl2+ 2NaOH Zn(OH)2 + 2NaCl.
З кислотами амфотерні гідроксиди реагують як слабкі основи :
Zn(OH)2 + H2SO4 ZnSO4 + 2H2O.
При нагріванні з концентрованими водними розчинами лугів вони реагують як дуже слабкі кислоти з утворенням комплексних гідратованих солей :
Zn(OH)2 + 2NaOH {Na2ZnO2+2H2O} Na2[Zn(OH)4].
При сплавленні (тобто при t >> 1000C) амфотерних гідроксидів з оксидами, гідроксидами або карбонатами активних металів утворюються негідратовані солі:
Zn(OH)2 + 2KOH K2ZnO2 + 2 H2O калій цинкат;
2Al(OH)3 + CaCO3 Ca(AlO2)2 + CO2 +3H2O кальцій мета-алюмінат.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
-
Властивості оксидів
а) В з а є м о д і я о к с и д і в з в о д о ю
Встановити в штативі 4 пробірки і налити в них по 3мл дистильованої води. В 3 пробірки додати по кілька крапель розчину фенолфталеїну, після чого в першу з них внести трошки (на кінчику шпателя) кальцій оксиду, в другу – купрум (ІІ) оксиду, а в третю – цинк оксиду. В четверту пробірку додати кілька крапель лакмусу і пропускати через одержаний розчин з апарату Кіппа вуглекислий газ. Записати спостереження та рівняння реакцій, які стали причиною змін, що спостерігалися. Яка з виконаних реакцій відома під назвою "гасіння вапна"?
б) В з а є м о д і я о к с и д і в з к и с л о т а м и
Встановити в штативі 3 пробірки. В одну пробірку внести невелику кількість (на кінчику шпателя) кальцій оксиду, в другу – купрум (ІІ) оксиду, а в третю – цинк оксиду, після чого в кожну додати по 1-2мл розчину хлоридної (хлороводневої, соляної) кислоти. Записати спостереження та рівняння реакцій.
в) В з а є м о д і я о к с и д і в з л у г а м и
Встановити в штативі 4 пробірки. В одну пробірку внести невелику кількість (на кінчику шпателя) кальцій оксиду, в другу – купрум (ІІ) оксиду, в третю – цинк оксиду, після чого в кожну додати по 1-2мл концентрованого розчину натрій гідоксиду. В четверту пробірку налити 3-4мл вапняної води і пропускати через неї з апарату Кіппа вуглекислий газ. Записати спостереження та рівняння реакцій.
Результати дослідів 1а,б,в та висновки про властивості оксидів звести в табл. 2.2.
Таблиця 2.2.
-
Оксид
Продукти реакції з
Характер (тип) оксиду
водою
кислотою
лугом
СаО
СuO
ZnO
CO2
-
Добування та властивості нерозчинних в воді основ
а) Встановити в штативі 2 пробірки. В одну пробірку внести 1мл (10 крапель) розчину купрум (ІІ) сульфату, в другу – стільки ж розчину ферум (ІІІ) хлориду, після чого в обидві додати по 10 крапель розведеного розчину натрій гідроксиду. Записати спостереження та рівняння реакцій, які стали причиною змін, що спостерігалися.
б) Пробірки з продуктами реакцій, виконаних в досліді 2а, нагріти до кипіння. Записати спостереження та рівняння реакцій, зробити висновки про термічну стійкість одержаних гідроксидів.
-
Добування та властивості амфотерних гідроксидів
В пробірку налити 2-3мл розчину солі алюмінію і краплями при перемішуванні (струшуванням пробірки після кожної доданої краплі) додавати розведений розчин натрій гідроксиду до утворення осаду. Половину одержаної суміші перелити в другу пробірку і додати до неї рівний об'єм розчину хлоридної кислоти, до другої – стільки ж концентрованого розчину натрій гідроксиду. Записати спостереження та рівняння реакцій, зробити висновок про хімічний характер алюміній гідроксиду.
ЛАБОРАТОРНА РОБОТА № 3.
Добування та властивості кислот та солей
Кислотами називають речовини, які дисоціюють на гідроген-катіони та аніони кислотних залишків.
В водному середовищі гідроген-катіон Н+ (протон), відриваючись від молекули кислоти, одночасно приєднується до молекули Н2О, тому в розчинах перебувають не йони Н+, а гідратовані гідроксоній-катіони Н3О+(водн).
За складом кислоти діляться на безкисневі та кисневі (або оксокислоти). Безкисневі кислоти – це водні розчини бінарних сполук активних неметалів з Гідрогеном, а також HCN. Назви безкисневих кислот складаються із слова "кислота" та прикметника, який утворюють додаванням до кореня назви елемента-кислотоутворювача суфікса "ід" ("ид") та закінчення -на (або додаванням до назви простої речовини , атом якої зв'язаний з Гідрогеном, слова "воднева") :
HСl – хлоридна (хлороводнева)* кислота; HCN – ціанідна (синільна) кислота;
H2S – сульфідна (сірководнева)* кислота.
Кисневі кислоти є продуктами гідратації (гідратами) кислотних оксидів (ангідридів). Назви оксокислот складаються із слова "кислота" та прикметника, який утворюють, додаючи до кореня назви елемента-кислотоутворювача суфікс "ат" або "іт" ("ит") та закінчення -на. Якщо елемент-кислотоутворювач перебуває в максимальному стані окиснення, то в назві кислоти вживається суфікс "ат", якщо в нижчому – суфікс "іт" ("ит"):
H2SО3 – сульфітна (сірчиста)* кислота; H2SО4 – сульфатна (сірчана)* кислота;
HNO2 – нітритна (азотиста) кислота ; HNO3 – нітратна (азотна) кислота.
Продукти мінімальної гідратації ангідридів називають мета-кислотами, а максимальної – орто-кислотами :
P2O5 + H2O 2HPO3 - мета-фосфатна (мета-фосфорна)* кислота;
P2O5 + 3H2O 2H3PO4 - орто-фосфатна (орто-фосфорна) кислота.
*В дужках наведені застарілі назви кислот, які ще широко вживаються на практиці.
Нерозчинні в воді неорганічні кислоти можна одержати непрямою гідратацією їх нерозчинних в воді ангідридів. Спочатку сплавленням з лугом нерозчинний оксид перетворюють в розчинну сіль, підкисленням якої виділяють відповідну кислоту:
1. 2NaOH + SiO2 Na2SiO3 + H2O; 2. Na2SiO3 + 2HCl H2SiO3 + 2NaCl.
натрій метасилікат, розчинне скло метасилікатна кислота Число протонів, які в полярному середовищі можуть утворитись із одної молекули кислоти, визначає основність кислоти, а також число ступенів її дисоціації та число можливих кислотних залишків:
1) H2SO4 H+ + HSO4– ; 2) HSO4– L H+ + SO42–.
гідрогенсульфат-аніон сульфат-аніон
В молекулах оксокислот здатні йонізуватися тільки атоми Гідрогену, безпосередньо зв'язані з атомами Оксигену. Так, ацетатна (оцтова) кислота – одноосновна, оскільки атоми Гідрогену, безпосередньо зв'язані з атомом Карбону, не йонізуються : СН3СООН L СН3СОО– + Н+.
Деякі розчинні в воді кислотні оксиди, реагуючи з водою, не утворюють стійких молекул відповідних кислот. Напр., тільки незначна частка розчинених в воді молекул СО2 перебуває в гідратованому стані, в розчині встановлюється сильно зміщена вліво рівновага: Н2О + СО2 L Н+ + НСО3– L 2Н+ + СО32–.
↑↓
Н2СО3
Таким чином, водний розчин СО2 має властивості слабкої двоосновної карбонатної (вугільної) кислоти Н2СО3. Стійкі солі цієї кислоти (карбонати) дуже поширені в природі, але молекули Н2СО3 за звичайних умов нестійкі, при їх виділенні із карбонатів вони розпадаються на воду і СО2.
Солями називають складні речовини, які дисоціюють на катіони основних та аніони кислотних залишків.
В реакціях кислот з основами (реакціях нейтралізації) та в інших реакціях обміну в залежності від природи та співвідношення реагентів утворюються середні, кислі та оснόвні солі. Середні солі є продуктами повної взаємної нейтралізації кислот та основ : 2КОН + Н2S K2S + 2H2O; NH3 + HCl NH4Cl.
В складі середніх солей нема ні атомів Гідрогену, ні гідроксо-груп, здатних йонізуватись, тобто перетворюватись в йони Н+ або ОН–.
При частковій нейтралізації багатооснόвних кислот утворюються легкорозчинні в воді кислі солі: NaOH + H2S NaHS + H2O; KOH + H3PO4 KH2PO4 + H2O.
натрій гідрогенсульфід калій дигідрогенфосфат
Кислі солі дисоціюють ступінчасто, їх повний розпад на основні та кислотні залишки супроводжується частковою дисоціацією кислотних залишків:
1. КН2РО4 К+ + Н2РО4– ; 2. Н2РО4– L Н+ + НРО42– ; 3. НРО42– L Н+ + РО43–.
При додаванні лугів кислі солі перетворюються в середні (завершується нейтралізація кислотних залишків): КН2РО4 + 2КОН К3РО4 + 2Н2О.
При додаванні надлишку кислот середні солі перетворюються в легкорозчинні кислі солі : Са3(РО4)2 + Н3РО4 3СаНРО4; СаНРО4 + Н3РО4 Са(Н2РО4)2.
кальцій: фосфат гідрогенфосфат дигідрогенфосфат
При взаємодії лугу з надлишком середньої солі багатокислотної основи утворюються малорозчинні оснόвні солі:
FeCl3 + NaOH FeOHCl2+ NaCl; 2MgSO4 + 2KOH (MgOH)2SO4+ K2SO4.
ферум (III) гідроксид-хлорид магній гідроксид-сульфат
(хлорид гідроксозаліза (III) ) (сульфат гідроксомагнію)
В оснόвних залишках таких солей є гідроксо-групи, здатні йонізуватися, тому оснόвні солі дисоціюють ступінчасто:
1. FeOHCl2 L FeOH2+ + 2Cl– ; 2. FeOH2+ L Fe3+ + OH– .
При додаванні кислоти малорозчинна оснόвна сіль перетворюється в розчинну середню сіль FeOHCl2 + HCl FeCl3 + H2O,
а при додаванні лугу – в відповідну нерозчинну основу :
FeOHCl2 + 2NaOH Fe(OH)3 + 2NaCl.
При змішуванні кислих солей з оснόвними вони взаємно нейтралізуються : (MgOH)2SO4 + Mg(HSO4)2 3MgSO4 + 2H2O.
Солі, які в воді одноступінчасто дисоціюють на один кислотний і два оснόвних залишки, називаються подвійними : KAl(SO4)2 K+ + Al3+ + 2SO42–.
алюміній-калій cульфат
Солі, які в воді одноступінчасто розпадаються на два кислотних і один оснόвний залишок, називаються змішаними : Сl–Ca–OСl Cl– + Ca2+ + СlО– .
кальцій хлорид-гіпохлорит, ‘хлорне вапно’
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
1. Добування та властивості середніх солей
а) Утворення середніх солей в реакціях нейтралізації
В пробірку налити 1-2мл "вапняної води" (або розведеного розчину NaOH), додати 2-3 краплі розчину фенолфталеїну, після чого додавати краплями розчин хлоридної кислоти до знебарвлення розчину. Записати спостереження та рівняння реакції. Які реакції називаються реакціями нейтралізації?
б) Утворення середньої солі в реакції обміну
В пробірку налити 1-1,5 мл розчину натрій орто-фосфату і краплями додати стільки ж розчину кальцій хлориду. Записати спостереження та рівняння реакції. Продукти реакції зберегти для наступного досліду!
-
Добування та властивості кислих солей
а) В пробірку з продуктами реакції 1б) додавати краплями орто-фосфатну (орто-фосфорну) кислоту до розчинення осаду. Записати рівняння реакцій, які при цьому відбуваються, назвати їх продукти.
б) У встановлену в штативі пробірку налити 2-3мл "вапняної води" і пропускати через неї із апарата Кіппа вуглекислий газ до розчинення осаду, який випадає спочатку. До одержаного розчину знову додати "вапняної води". Записати спостереження та рівняння всіх реакцій, які відбулися, назвати їх продукти, нарисувати принципіальну схему апарата Кіппа та пояснити (усно) його роботу.
На підставі дослідів 1а і 1б зробити висновок про розчинність кислих солей в воді.
