
- •Оксидами називають бінарні сполуки елементів з Оксигеном, в яких ступінь окиснення Оксигену дорівнює –2.
- •3. Добування та властивості оснόвних солей
- •Константи дисоціації слабких електролітів, присутніх в розчинах карбонатів.
- •Залежність напряму овр від рН середовища
- •1. Взаємодія активних металів з водою
- •4. Взаємодія металів з водою в лужному середовищі
- •4. Захист металів від корозії
- •Продовження табл. 1
1. Взаємодія активних металів з водою
а). В фарфорову чашку, наполовину заповнену дистильованою водою, помістити маленький шматочок металічного натрію, старанно очищений фільтрувальним папером від органічного мастила, під шаром якого він зберігався. До одержаного розчину додати кілька крапель фенолфталеїну. Записати спостереження, а також молекулярне (М) та йонно-молекулярне (ЙМ) рівняння реакції. Чим пояснити необхідність зберігання натрію без доступу повітря та дуже високу швидкість його екзотермічної реакції з водою?
б). В пробірку з 1мл дистильованої води додати кілька крапель фенолфталеїну і внести шматочок магнію, записати спостереження, після чого нагріти пробірку до кипінння води. Чому магній, незважаючи на дуже низьке (майже як для натрію) значення його стандартного електродного потенціалу, не розчиняється в воді? Що змінилося після нагрівання ?
2. Взаємодія металів з розчинами солей
В три пробірки з 1мл розчину купрум (ІІ) хлориду помістити по шматочку металів: в першу – алюмінію, в другу – магнію, в третю – заліза. Через 5-10 хвилин записати спостереження, на підставі яких написати М та ЙМ рівняння реакцій, що відбуваються, розмістити метали в ряд в порядку зростання їх відновної активності.
3. Взаємодія металів з кислотами
а) В три пробірки з 1мл 10%-ної хлоридної (або сульфатної) кислоти помістити по шматочку металів: в першу – алюмінію (або магнію), в другу – заліза (або цинку), в третю – міді. Через кілька хвилин записати спостереження, на їх основі розмістити ці метали та водень в ряд в напрямку зниження їх відновної активності, написати М та ЙМ рівняння реакцій, що відбуваються.
б) Шматочок металу, який виявився нерозчинним в досліді 2а, помістити в пробірку з 1мл розведеної (20%-ної) нітратної кислоти і обережно підігріти пробірку до початку виділення газу. Записати спостереження, на їх підставі написати йонно-електронні рівняння напівреакцій окиснення та відновлення, а також М та ЙМ рівняння реакції. Чому в цій реакції не виділяється водень?
4. Взаємодія металів з водою в лужному середовищі
В дві пробірки з 1мл 20%-ного розчину натрій гідроксиду помістити по шматочку металів: в першу – алюмінію, в другу – магнію. Через кілька хвилин записати спостереження, написати М та ЙМ рівняння реакцій, що відбуваються. Чому, на відміну від алюмінію, магній, незважаючи на значно менше значення 0, не розчиняється в лужних розчинах?
ЛАБОРАТОРНА РОБОТА № 11
Корозія металів та методи захисту від неї
Хімічне руйнування (окиснення) металів під дією навколишнього середовища називається корозією. За механізмом перебігу корозія може бути хімічною або електрохімічною. Хімічна корозія – це окиснення металу компонентами навколишнього середовища без виникнення в системі електричного струму. Найчастіше це окиснення металів сухими газами – O2, Cl2, SO2, SO3, NO2 тощо, тому таку корозію ще називають газовою. Електрохімічною корозією називають окиснення металів в середовищі з йонною електропровідністю з виникненням електричного струму .
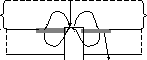
Причиною електрохімічного характеру корозії металів в середовищах з йонною провідністю є домішки в металі інших речовин, контакт з іншими металами, неоднакова концентрація окисника на різних ділянках поверхні металічної конструкції або просто неоднорідність поверхні. За таких умов на поверхні металу утворюються анодні зони, від яких електрони відтягуються до катодних зон, де відновлюється присутній в навколишньому середовищі окисник: Ox + ze– Red. Найчастіше окисниками є йони Н+ (при рН < 7, воднева деполяризація) або молекулярний кисень (при рН 7, киснева деполяризація). В результаті конденсації води на поверхні чавуну (рис.11.1) в контакті між собою і з водним розчином

 водяна
О2
плівка
водяна
О2
плівка
водяна
О2
плівка
водяна
О2
плівка
OH– OH– OH– OH–
e– Fe3C e– е– e– Fe чавун Fe Fe Сu Fe
іржа цементит іржа
(–) Fe O2,H2O Fe3C (+) ( – ) Fe O2,H2O Сu ( + )
Рис. 11.1. Схема атмосферної корозії Рис. 11.2. Схема контактної корозії
чорних металів. металів.
окисника опиняються форми заліза різного ступеня окисненості, тобто утворюється мікрогальванічна пара. Окиснена форма заліза (цементит Fe3C) відтягує електрони від Fe, які на поверхні розділу Fe3CO2,Н2О відновлюють сильніший із присутніх в системі окисників – O2:
+

2 Fe + О2 + 2Н2О Fe(ОН)2 – повне рівняння 1-ої стадії корозії Fe.
Таким чином, ділянка чистого Fe (анода), що прилягає до Fe3C, руйнується, покриваючись зеленуватосірим Fe(ОН)2, який поступово окиснюється за рівнянням :
+
О2 + 2 H2O + 4е– 4ОН– 1 4 Fe(ОН)2 + О2 + 2 H2O 4 Fe(ОН)3 .
З часом Fe(ОН)3 частково втрачає воду: Fe(ОН)3 – Н2О FeООН (або Fe2О3Н2О).
Утворена червонобура іржа – пориста маса, через яку вода з киснем легко проникають до металу, тому корозія може привести до повного окиснення заліза.
Аналогічно, але інтенсивніше (адже утворюється не мікро- а макрогальванічна пара) відбувається контактна корозія металів (рис. 11.2).
В природних умовах (в вологій атмосфері, грунті, природних водах) електродний потенціал системи О2 + 4Н+ + 4е– L 2Н2О становить
(О2+4Н+/2Н2О) = 0 - 0,059рН = +1,23 В – 0,059 7 + 0,8В.
Отже, в цих умовах повинні руйнуватися метали, у яких 0(Mez+/Ме) < +0,8В, а довговічність виробів з них визначається швидкістю їх корозії. Ряд металів (Mg, Al, Cr, Zn, Ti), незважаючи на низькі значення їх 0, відзначаються високою стійкістю до корозії в вологій атмосфері та в нейтральних розчинах. Так, металічний магній може тривалий час перебувати на повітрі або в воді без помітних змін, хоча 0(Mg2+/Mg) лише на 0,3В перевищує 0 натрію, який за цих умов окиснюється швидко і повністю. Причина такої стійкості магнію в тому, що реакції 2Mg+O22MgO та 2Mg+H2OMg(OH)2 дуже швидко припиняються. Практично нерозчинні в воді продукти цих реакцій утворюють тонку (10–5мм), але практично непроникну плівку, яка покриває метал і захищає його від подальшого окиснення. Таке глибоке гальмування корозії металу внаслідок утворення на його поверхні захисної оксидної, гідроксидної або сольової плівки називається пасивацією металу.
Вироби із сплавів заліза, продукти корозії якого не утворюють захисних плівок, можна пасивувати шляхом хімічної або електрохімічної обробки їх поверхні. Напр., обробка залізних виробів концентрованою (с%(HNO3)69%) нітратною кислотою приводить до утворення щільної оксидної плівки (хімічне оксидування), обробка розчином ферум (ІІ) дигідрогенфосфату – до утворення фосфатної плівки (фосфатування). Для збільшення товщини і щільності оксидної плівки на поверхні алюмінієвих сплавів застосовують електрохімічне оксидування (анодування).
Корозія металів різко прискорюється галогенід-йонами, особливо йонами Сl–. Адсорбуючись на поверхні металів, ці йони – активатори корозії – руйнують захисні плівки і перешкоджають їх утворенню. Активаторами корозії амфотерних металів (Zn, Al) є ОН–-йони, тому що продукти їх корозії реагують з лугами і при рН > 7 не утворюють захисних плівок.
Численні способи захисту металів від корозії можна згрупувати наступним чином:
застосування хімічно стійких сплавів, напр., неіржавіючих сталей, легованих домішками Cr, Ni, Ti тощо; ізоляція поверхні металу від агресивного середовища; зміна складу агресивного середовища; застосування інгібіторів корозії; електрохімічні методи.
Для ізоляції металів від агресивного середовища на їх поверхню наносять інертні (неметалічні) або активні (металічні) покриття. До інертних покрить відносяться: пасивація, покриття емалями, лаками, фарбами, смолами, мастилами, консервантами, бітумами, полімерними плівками (металопласти).
П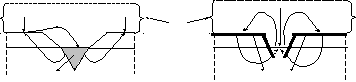 окриття
металу захисним шаром менш
активного металу,
напр., покриття залізного виробу оловом
(лудження
заліза),
називається катодним.
Олово має більше значення 0,
ніж залізо, і пасивується
продуктами власної корозії, тому надійно
захищає залізо. Але при механічному
пошкодженні такого покриття корозія
заліза різко
прискорюється
внаслідок утворення макрогальванічної
пари, анодом в якій є залізо (рис. 11,а)
.
окриття
металу захисним шаром менш
активного металу,
напр., покриття залізного виробу оловом
(лудження
заліза),
називається катодним.
Олово має більше значення 0,
ніж залізо, і пасивується
продуктами власної корозії, тому надійно
захищає залізо. Але при механічному
пошкодженні такого покриття корозія
заліза різко
прискорюється
внаслідок утворення макрогальванічної
пари, анодом в якій є залізо (рис. 11,а)
.
О2 Н2О О2 Водяна Н2О O2 Н2О
OH– плівка OH– OH–
а) Sn Sn б) Zn Zn
Fe e– e– Fe Fe e– Fe e– Fe
іржа гідроксидна плівка
(–) FeO2,H2OSn (+) катод анод (–) Zn O2, H2O Fe (+)
Рис. 11. Схема електрохімічних процесів, що відбуваються при пошкодженні:
а) катодного покриття; б) анодного покриття.
Покриття металічного виробу активнішим металом (напр., покриття заліза шаром Zn або Cr), називається анодним. дуже стійкі до корозії при звичайних умовах внаслідок їх пасивації її продуктами. Захисна дія таких покрить не припиняється навіть після їх пошкодження: в макрогальванічній парі, яка при цьому утворюється в вологому середовищі, анодом є покриття, захищене від окиснення гідроксидною плівкою (рис.11,б).
Ефективним методом захисту від корозії водопроводів та технологічних апаратів, в яких використовується вода, є видалення з води активаторів корозії та розчиненого повітря (деаерація). Деаерація води веде до зменшення концентрації кисню і його електродного потенціалу, а, отже, до сповільнення корозії.
В системах, які працюють з обмеженими об’ємами корозійних середовищ (системах охолодження, парогенераторах, апаратах для виробництва, зберігання та транспортування кислот) застосовують інгібітори (сповільнювачі) корозії, тобто речовини, невеликі добавки яких до корозійного середовища сповільнюють корозію металів. Адсорбуючись на активних зонах поверхні металів, інгібітори пасивують їх. Інгібітори корозії обов’язково додаються до мастил-консервантів, якими покривають деталі машин і механізмів при їх тривалому зберіганні.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
1. Прискорення електрохімічної корозії домішками менш активних металів
В дві пробірки з 1-2мл розведеної сульфатної кислоти помістити по шматочку цинку, після чого в одну з пробірок додати 5-8 крапель розчину купрум (ІІ) сульфату. Через кілька хвилин записати спостереження. Чим пояснити різну швидкість розчинення цинку в різних пробірках? Написати рівняння: а) реакції в відсутності СuSO4; б) реакції, в результаті якої в системі утворюється мікрогальванопара; в) напівреакцій на аноді та на катоді цієї мікрогальванопари.
2. Вплив активаторів корозії на окиснення металів
В дві пробірки з 1-2мл розчину купрум (ІІ) сульфату помістити по шматочку алюмінію, після чого в одну з пробірок додати 5-8 крапель розчину натрій хлориду. Через кілька хвилин записати спостереження. Написати рівняння реакцій, що відбуваються, пояснити різну їх швидкість в різних пробірках.
3. Контактна корозія металів
а) Я к і с н а р е а к ц і я на катіони Fe2+
В пробірку набрати 2-3мл води, додати 2-3 краплі розчину ферум (ІІ) сульфату і стільки ж розчину калій гексаціано-(ІІІ)-феррату K3[Fe(CN)6]. забарвлення суміші Про наявність йонів Fe2+ свідчить утворення інтенсивно синьої комплексної солі за рівнянням: Fe2+ + K+ + [Fe(CN)6] KFe[Fe(CN)6] .
б) Дослідження к о н т а к т н о ї к о р о з і ї металів
В три пробірки набрати по 4-5мл 2%-го розчину натрій хлориду і додати в кожну по 3 краплі 2н H2SO4 та по кілька крапель розчину K3[Fe(CN)6]. Старанно зачистити наждачним папером поверхню цинкової (або алюмінієвої), олов"яної та мідної пластинок, закріпити на кожній нову канцелярську скріпку (або обмотати залізним дротом) і занурити їх в окремі пробірки. На основі кількох хвилин спостережень заповнити таблицю 11.1. Таблиця 11.1
|
№ пробірки |
Гальванічна пара |
Спостереження (колір розчину) |
Рівняння напівреакції |
|
|
на аноді |
на катоді |
|||
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
