
- •Тема 2. Основы морфологии бактерий.
- •Тема 3. Физиология и биохимия бактерий. Строение и классификация грибов.
- •Тема 3. Физиология и биохимия бактерий.
- •Тема 5, тема 9, тема 11, тема 16, тема 19, тема 26, тема 27.
- •Тема 4. Знакомство с микробиологической лабораторией. Микроскопические методы исследования морфологии бактерий и грибов.
- •Тема 5. Бактериологические методы исследования.
- •I этап (нативный материал)
- •II этап (изолированные колонии)
- •III этап (чистая культура)
- •Тема 6. Предмет и задачи паразитологии.
- •Тема 9. Паразитологические методы исследования.
- •Тема 10. Основы вирусологии. Бактериофагия.
- •Тема 11. Вирусологические методы исследования.
- •Тема 13. Тема 14. Тема 15. Тема 16.
- •Тема 12. Генетика микроорганизмов
- •Тема 13. Основы экологической микробиологии.
- •Тема 14. Действие физических, химических и биологических факторов внешней среды на микроорганизмы.
- •Тема 15. Микробиологические основы химиотерапии и химиопрофилактики инфекционных болезней.
- •Тема 16. Методы стерилизации и дезинфекции. Определение чувствительности микроорганизмов к антибиотикам.
- •Тема 17. Учение об инфекции. Патогенность микроорганизмов.
- •Тема 17. Учение об инфекции. Патогенность микроорганизмов.
- •Тема 18. Основы эпидемиологии. Основы клинической микробиологии.
- •Тема 18. Основы эпидемиологии. Основы клинической микробиологии.
- •Тема 19. Микробиологические основы борьбы с внутрибольничными инфекциями.
- •Тема 20. Понятие об иммунологии.
- •Тема 20. Понятие об иммунологии.
- •Тема 21. Антигены.
- •Тема 22. Иммунная система организма человека. Антитела.
- •Тема 23. Формы иммунитета. Виды иммунитета.
- •Тема 24. Клиническая иммунология: аллергия, иммунодефицитные состояния.
- •Тема 25. Применение реакции антиген-антитело в медицинской практике (иммунодиагностика).
- •Тема 26. Иммуномикробиологические исследования. Реакции агглютинации и преципитации.
- •Тема 27. Реакции связывания комплемента.
- •Тема 28. Основы иммунотерапии и иммунопрофилактики.
- •Тема 29. Изучение препаратов, применяемых для иммунопрофилактики и иммунотерапии.
- •Тема 30. Основы иммунологии.
Тема 16. Методы стерилизации и дезинфекции. Определение чувствительности микроорганизмов к антибиотикам.
Содержание:
Определение чувствительности бактерий к антибиотикам.
Методы стерилизации и дезинфекции в микробиологической лаборатории.
Диагностика дисбактериоза.
Принципы санитарно-бактериологического исследования.
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ МИКРООРГАНИЗМОВ
К АНТИБИОТИКАМ.
Циркуляция антибиотикорезистентных микроорганизмов в современный период столь широка, что только точное определение чувствительности к антибиотикам каждого конкретного возбудителя инфекции может обеспечить правильный выбор препарата для химиотерапии.
Диффузный метод дисков
Исследуемую бактериальную культуру засевают газоном на питательный агар или среду АГВ в чашке Петри.
С р е д а АГВ : сухой питательный рыбный бульон , агар-агар, натрий фосфат двузамещенный. Среду готовят из сухого порошка в соответствии с инструкцией.
На засеянную поверхность пинцетом помещают на одинаковом расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37°С до следующего дня.
В зависимости от диаметра зоны задержки роста различают степень чувствительности испытуемого штамма: чувствительные, малочувствительные и устойчивые (отсутствие зоны).
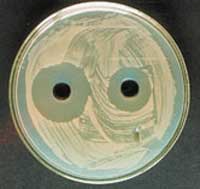
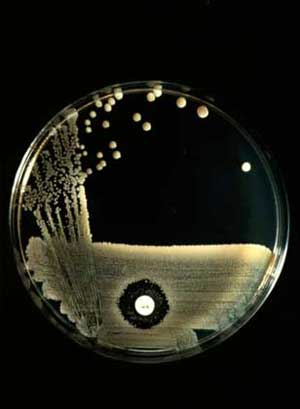
Рис. 1. Зона задержки роста культуры вокруг диска, пропитанного антибиотиком.

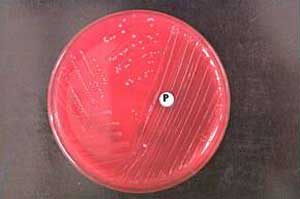
Рис 2. Культура стрептококка, чувствительная (слева) и устойчивая (справа) к антибиотику Р.
Методы стерилизации и дезинфекции в микробиологической лаборатории.
В микробиологической практике применяют различные дезинфицирующие вещества: 0,2% раствор жавель-солида, 3-5% растворы фенола, 5-10% растворы лизола, 1-5% растворы хлорамина, 3-6% растворы перекиси водорода, 1-5% растворы формалина, растворы сулемы в разведении 1:1000 (0,1%), 70% спирт и др.
Дезинфекции подвергают отработанный патологический материал (гной, кал, моча, мокрота, кровь, спиномозговая жидкость) перед сливом его в канализацию. Обеззараживание проводят сухой хлорной известью или 3-5% раствором хлорамина.
Загрязненные патологическим материалом или культурами микроорганизмов пипетки, стеклянные шпатели, предметные и покровные стекла опускают на сутки в стеклянные банки с 0,2% раствор жавель-солида, 3% раствором фенола или перекиси водорода. Препаровальные иглы, бактериальные петли после употребления немедленно прокаливают на огне.


Рис. 3. Обработка перчаток и стекол 0,2% раствором жавель-солида.
По окончании работы с заразным материалом лаборант должен обработать дезинфицирующим раствором рабочее место и руки. Поверхность рабочего стола протирают кусочком ваты, смоченным 3% раствором фенола. Руки дезинфицируют 1% раствором хлорамина.

Рис. 4. Сброс патологического материала в дезинфицирующий раствор.
Выбор дезинфицирующего вещества, его концентрация и длительность воздействия (экспозиция) зависят от биологических свойств микроба и от той среды, в которой будет происходить контакт дезинфицирующего вещества с патогенными микроорганизмами. Например, сулема, фенол, спирты непригодны для обеззараживания белковых субстратов (гной, кровь, мокрота), так как под их влиянием происходит свертывание белков, а свернувшийся белок предохраняет микроорганизмы от воздействия дезинфицирующего вещества.
При дезинфекции материала, инфицированного споровыми формами микроорганизмов, применяют 5% раствор хлорамина, 1-2, 5% растворы активированного хлорамина, 5-10% растворы формалина и другие вещества.
Дезинфекцию, которую проводят на протяжении всего дня по ходу работы, называют текущей, а по окончании - заключительной.
Стерилизацию питательных сред осуществляют различными способами в зависимости от тех ингредиентов, которые входят в их состав.
Синтетические среды и все агаровые среды, не содержащие в своем составе нативного белка и углеводов, стерилизуют 15-20 мин в автоклаве при температуре 115-120°С.
Среды с углеводами и молоком, питательный желатин стерилизуют текучим паром при температуре 100°С дробно или в автоклаве при 112°С.
Среды, в состав которых входят белковые вещества (сыворотка крови, асцитическая жидкость), обеспложиваются тиндализацией или фильтрованием.
Для стерилизации питательных сред, содержащих в своем составе нативные белки, пользуются фильтрацией через мембранные фильтры Зейтца.
Подготовленные к употреблению питательные среды проверяют на стерильность.
Подготовка к стерилизации лабораторной посуды
Перед стерилизацией лабораторную посуду тщательно моют и сушат.
Пробирки, флаконы, бутылки, матрацы, колбы закрывают ватно-марлевыми пробками. Поверх пробки на каждый сосуд (кроме пробирок) надевают бумажный колпачек.
Чашки Петри стерилизуют завернутыми в бумагу по 1-5 штук или в пеналах.
Пастеровские пипетки по 3-5-10-15 штук заворачивают в плотную оберточную бумагу. В верхнюю часть каждой пипетки вкладывают кусочек ваты. Во время работы пипетки из пакета вынимают за верхний конец.


Рис. 5. Подготовка пробирок с тампонами перед стерилизацией (слева) и хранение в закрывающемся шкафу ограниченный срок после стерилизации (справа).
Лабораторную посуду стерилизуют:
а) сухим жаром при температуре 150, 160 и 180?С соответственно 2 часа, 1 час и 30 минут.
б) в автоклаве при давлении 1 атм. В течение 20-30 минут

Рис. 6. Автоклав – аппарат для стерилизации паром под давлением.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ДИСБАКТЕРИОЗА
Дисбактериоз (дисбиоценоз) - изменение количественного соотношения и состава нормальной микрофлоры организма, главным образом его кишечника, при котором происходит уменьшение количества или исчезновение обычно составляющих ее микроорганизмов и появление в большом количестве редко встречающихся или несвойственных ей микробов.
Показания для бактериологической диагностики дисбактериоза кишечника: длительно протекающие инфекции и расстройства, при которых не удается выделить патогенные энтеробактерии; затяжной период реконвалесценции после перенесенной кишечной инфекции; дисфункции ЖКТ на фоне или после проведенной антибиотикотерапии или у лиц, постоянно контактирующих с антимикробными препаратами. Исследования также следует проводить при болезнях злокачественного роста, у страдающих диспептическими расстройствами, лиц подготавливаемых к операциям на органах брюшной полости, недоношенных или травмированных новорожденных, а также при наличии бактериемий и гнойных процессов, трудно поддающихся лечению (язвенные колиты и энтероколиты, пиелиты, холециститы и др.).
Посевы изучают на наличие патогенных микроорганизмов и на нарушение соотношения различных видов микробов. Результаты исследования следует считать объективными при анализе роста изолированных колоний в том числе, если можно изучить морфологию и подсчитать количество колоний на чашку Петри. После идентификации проводят пересчет содержания микроорганизмов каждого вида на 1 г исследуемого материала. При обнаружении патогенной микрофлоры необходимо изучить ее чувствительность к антибактериальным препаратам и бактериофагам.
Отбор и доставка материала на дисбактериоз
Материалом для исследования является кал не позже 2 часов после дефекации.
Для получения достоверного результата стул должен быть обязательно утренним, самостоятельным, не на фоне лечения. У грудных детей забирать материал не с памперсов и пеленок.
Одну столовую ложку фекалий помещают в прокипяченную стеклянную баночку.
Лабораторная диагностика дисбактериоза кишечника
Метод исследования - бактериологический: мерный посев исследуемого материала с целью определения количества микроорганизмов наиболее значимых групп.
Этапы исследования:
приготовление серийных разведений суспензии испражнений;
посев на питательные среды из разведений;
учет результатов посева и ориентировочная идентификация микроорганизмов;
оценка результатов.
ПРИНЦИПЫ САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
Для определения количества микроорганизмов используют различные методы:
прямой подсчет под микроскопом в счетных камерах (этот метод применяется крайне редко);
количественный посев на плотные среды с последующим подсчетом выросших колоний;
титрационный посев на жидкие питательные среды;
специальные методы, учитывающие особенности исследуемого материала.
Количество санитарно-показательных микроорганизмов в исследуемом материале выражают в виде титра или индекса.
Определение микробного числа воды
Водопроводную воду засевают в объеме 1см3 (1 мл). Пробу вносят в стерильную чашку Петри, заливают 10-12 мл расплавленного и остуженного до 45°С питательного агара, перемешивают с водой. Посев инкубируют при 37°С в течение 1-2 сут. Затем подсчитывают количество выросших на поверхности и в глубине среды колоний и вычисляют микробное число воды - количество микроорганизмов в 1 мл.
Титрационный метод
Для исследования водопроводной воды делают посевы трех объемов по 100 мл, трех объемов по 10 мл и трех объемов по 1 мл в глюкозопептонную среду. Посевы инкубируют в течение суток при 37°С. О брожении судят по наличию пузырьков газа в поплавке. Из забродивших или помутневших проб производят посевы на среду Эндо.
Из выросших колоний делают мазки, окрашивают по Граму и ставят оксидазный тест, позволяющий дифференцировать бактерии родов Escherichia, CitrobacterиEnterobacterот грамотрицательных бактерий семейства Pseudomonadaceae и других оксидазоположительных бактерий, обитающих в воде.
Коли-титр воды измеряется минимальным количеством воды (мл), в котором обнаруживаются БГКП, коли-индекс - количеством БГКП, содержащихся в 1 л исследуемой воды.
Определение микробного числа воздуха
Количественные микробиологические методы исследования воздуха основаны на принципах осаждения (седиментации), аспирации или фильтрации.
Седиминтационный метод. Две чашки Петри с питательным агаром оставляют открытыми в течение 60 мин, после чего посевы инкубируют в термостате при 37°С. Результаты оценивают по суммарному числу колоний, выросших на обеих чашках: при наличии менее 250 колоний воздух считается чистым; 250-500 колоний - загрязненным в средней степени, при количестве колоний более 500 - загрязненным.
Аспирационный метод - более точный количественный метод определения микробного числа воздуха. Посев воздуха осуществляется с помощью приборов (прибор Кротова и пробоотборник ПАБ-1).
Аппарат Кротова устроен таким образом, что воздух с заданной скоростью просачивается через узкую щель плексигласовой пластины, закрывающей чашку Петри с питательным агаром. При этом частицы аэрозоля с содержащимися на них микроорганизмами равномерно фиксируются на всей поверхности среды благодаря постоянному вращению чашки под входной щелью.
После инкубации посева в термостате проводят расчет микробного числа.
Основы инфектологии и эпидемиологии
