
1. Строение атома. Радиоактивность. Изотопы
В середине XIX в. большинство ученых признавали реальное существование атомов. Но понятие о них было неправильное (метафизическое).
Лишь в конце XIX в. были сделаны открытия, показавшие сложность строения атомов. Первыми обнаруженными в атоме частицами были электроны.
В 1896 г. А. Беккерель обнаружил, что соединения урана обладают способностью испускать невидимые лучи, действующие на фотографическую пластинку, завернутую в черную бумагу.
М.Склодовская-Кюри и П. Кюри, продолжая исследования Беккереля, в 1898 г. открыли в урановой руде два новых элемента — радий и полоний, обладающих очень большой активностью излучения. Они установили, что этим свойством обладают и другие элементы, находящиеся в VII периоде системы Д. И. Менделеева (торий, актиний).
Самопроизвольный распад атомов элементов, сопровождающийся испусканием излучения, называется радиоактивностью (от лат. «радиус» — луч и «актиус» — действенный).
α-Лучи отклоняются в сторону отрицательного полюса и представляют собой поток частиц, заряженных положительным электричеством. Масса α-частиц 4 у. е.
β-Лучи отклоняются в сторону положительного полюса и представляют собой поток отрицательно заряженных частиц — электронов.
γ-Лучи не отклоняются в электрическом поле. По своей природе они подобны световым лучам, но в отличие от них характеризуются очень малой длиной волны. γ-лучи обладают исключительно большой способностью проникать через различные вещества, непроницаемые для обычных световых лучей.
Исследованиями М. Склодовской-Кюри и другими учеными было установлено, что при радиоактивном распаде радия образуются гелий и неизвестный в то время элемент радон с порядковым номером 222. Таким образом, новые открытия доказали, что атом является сложной системой и состоит из более простых частиц.
Электроны выделяются из самых различных веществ. Отсюда было сделано заключение, что они являются составной частью всех элементов. Но так как электроны заряжены отрицательно, а атом в целом электронейтрален, то, очевидно, внутри атома находится положительно заряженная часть, которая своим зарядом компенсирует отрицательный заряд электронов.
Экспериментальные данные о наличии положительно заряженного ядра и его расположении в атоме были получены английским ученым Э. Резерфордом совместно с учениками при исследовании движения α-частиц в газах и других веществах.
На основе экспериментальных работ Резерфорд в 1911 г. высказал гипотезу о планетарном строении атома. Согласно этой гипотезе, атом представляет собой систему из очень малого по размерам ядра (10-12— Ю-13 см), по круговым орбитам которого движется такое число электронов, что они своим отрицательным зарядом нейтрализуют положительный заряд ядра.
Датский ученый Н. Бор в 1913 г. на основе квантовой теории излучения М. Планка развил квантовую теорию строения атома. В основу своей теории Бор положил следующие постулаты: электрон может двигаться вокруг ядра атома не по любым орбитам, а только по вполне определенным, дозволенным.
Атомы различных элементов характеризуются определенным зарядом ядра и равным ему числом электронов, которые находятся на определенных энергетических уровнях. Энергетические уровни характеризуются главным квантовым числом n, которое показывает удаленность электронного слоя от ядра и средний запас энергии электронов в этом слое: чем больше значение n, тем больше электронное облако и энергия электрона.
Энергетические уровни состоят из определенного числа подуровней: первый уровень — из одного подуровня, второй — из двух, третий — из трех и т.д. Подуровень характеризует побочное (или орбитальное) квантовое число l. Оно определяет форму электронного облака и показывает запас энергии электрона в подуровне. Подуровни имеют буквенное и числовое обозначения:
![]()
В одном подуровне может содержаться несколько электронных облаков (орбиталей) одной и той же формы, но различно расположенных в пространстве. Каждое положение в пространстве электронного облака условно обозначается ячейкой . Число ячеек определяется магнитным квантовым числом m1:
подуровень s состоит из 1s орбитали и 2 электронов (s2);
подуровень p состоит из Зр орбиталей и 6 электронов (р6);
подуровень d состоит из 5d орбиталей и 10 электронов (d10);
подуровень f состоит из 7f орбиталей и 14 электронов (f14).
Число электронов на орбитали определяется четвертым квантовым числом — спиновым (обозначается s). Оно показывает собственное вращение электрона. На орбитали (в квантовой ячейке) может находиться не более двух электронов.
Строение электронной оболочки атомов и ионов изображают электронной или электронно-графической формулой.
Электронная формула показывает распределение электронов в атомах по энергетическим уровням и подуровням, где уровни обозначают цифрами 1, 2, 3, 4, ..., подуровни — буквами s, p, d, f. Верхний правый индекс обозначает число электронов на подуровне.
Электронно-графическая формула изображает атом элемента в виде совокупности орбиталей или квантовых ячеек.
На примере марганца покажем написание электронной
![]()
и электронно-графической формул

Ядра всех атомов содержат одинаковое число протонов, но разное число нейтронов, ядро протия состоит из 1 протона, ядро дейтерия — из 1 протона и 1 нейтрона, ядро трития — из 1 протона и 2 нейтронов.
Атомы, имеющие одинаковый заряд ядра, но разные массовые числа, называют изотопами.
Атомы, имеющие одинаковые массовые числа, но разные заряды ядер, называют изобарами. Ядра изобар содержат разные числа протонов, следовательно, несут различный заряд, а поэтому занимают различные места в Периодической системе Д. И.Менделеева.
В Периодической системе элементов Д. И. Менделеева атомная масса элемента указывается как средняя величина массовых чисел всех его изотопов, взятых в процентном отношении, отвечающем их распространенности в природе.
Атомы различных изотопов одного и того же химического элемента наряду с разными ядерными свойствами имеют одинаковое строение электронной оболочки, поэтому химические и физические свойства изотопов почти одинаковы. Изотопы занимают одно и то же место в Периодической системе.
Превращения изотопов могут быть изображены в виде ядерных реакций. В уравнениях реакций у символа элемента верхний индекс соответствует массовому числу, а нижний — заряду ядра атома.
Например,
уравнение ядерной реакции превращения
![]() в уран в результате потери ct-частицы
имеет следующий вид:
в уран в результате потери ct-частицы
имеет следующий вид:
![]()
Превращения изотопов происходят в соответствии с законом смещения:
если атомное ядро изотопа элемента теряет а-частицу, то при этом образуется ядро изотопа нового элемента с массовым числом меньше на 4 единицы и с зарядом на 2 единицы меньше, т.е. элемент смещается в Периодической системе на две клетки влево.
Если атомное ядро изотопа элемента теряет (3-частицу, то смещается на одно место вправо, т.е. заряд ядра увеличивается на единицу, массовое число при этом не изменяется. Например,
![]()
В
ядерных превращениях сумма масс и сумма
зарядов в левой и правой частях уравнения
равны. Например, при бомбардировке
атомов азота α-частицами образуются
протоны и атомы изотопа кислорода ![]()
![]()
Сумма верхних индексов в левой части (14 + 4) равна сумме индексов правой части данного уравнения (1 + 17). То же относится к сумме нижних индексов: 7 + 2=1 + 8 – уравнение удовлетворяет правилу равенства сумм индексов.
Задача 1. Хлор имеет изотопы с массовыми числами 35 и 37. Укажите для каждого изотопа порядковый номер, число протонов и нейтронов, заряд ядра. Определите массовую долю в нем изотопа с массовыми числами 35 и 37, приняв атомную массу хлора 35,453.
Решение:
Изотопы хлора имеют одинаковый порядковый
номер 17, следовательно, и одинаковый
заряд ядра — 17 протонов, а так как атом
электронейтральный, то 17 электронов.
Согласно протонно-нейтронной теории,
у изотопа хлора ![]() будет 18 нейтронов (35 - 17), а у изотопа
с массовым числом 37 — 20 нейтронов
(37 - 17). Если обозначить массовую долю (в
%) изотопа
будет 18 нейтронов (35 - 17), а у изотопа
с массовым числом 37 — 20 нейтронов
(37 - 17). Если обозначить массовую долю (в
%) изотопа ![]() в природном хлоре через х,
а
изотопа
в природном хлоре через х,
а
изотопа ![]() — через (100 - х),
то
можно составить уравнение
— через (100 - х),
то
можно составить уравнение
![]() ,
,
откуда х = 77,4 %.
Следовательно,
хлор содержит 77,4 % изотопа![]() и 22,6 % изотопа
и 22,6 % изотопа ![]() .
.
Задача 2. Напишите схему распределения электронов в атоме хлора, его электронную и электронно-графическую формулы.
![]()
Решение: Хлор расположен в третьем периоде, следовательно, у его атома три энергетических уровня. Хлор находится в VII группе главной подгруппы, поэтому число электронов на последнем уровне равно семи. Число электронов на остальных уровнях определяется по формуле N= 2л2, т. е. 2 и 8. Следовательно, схема строения атома хлора:
![]()
электронная
формула хлора
электронно-графическая
формула

Задача 3. Дайте характеристику элемента хлора и его соединений (с кислородом и водородом) на основании его положения в Периодической системе элементов.
Решение: Хлор расположен в VII группе главной подгруппы. Хлор — неметалл. На последнем энергетическом уровне семь электронов, высшая степень окисления в кислородных соединениях равна семи. Высший оксид имеет формулу Сl2O7 — кислотный, его гидроксид является кислотой НСlO4. Водородное соединение отвечает формуле НС1. Исходя из электронно-графической формулы (наличия свободных d-орбиталей в третьем слое) может проявлять в возбужденном состоянии степень окисления 3, 5, 7.
Задача 4. Напишите электронные формулы атомов хрома и меди. Объясните расположение одного s-электрона на четвертом уровне.
Решение. У элементов четвертого периода хрома (Z = 24) и меди (Z= 29), атомы которых имеют четыре электронных слоя, происходит начиная с Sc заполнение третьего подуровня и поэтому следовало бы ожидать, что их формулы будут иметь вид
![]()
Однако в действительности расположение электронов на внешних уровнях атомов этих элементов выражается соответственно формулами 3d54s1 и 3d104s1, что объясняется провалом одного из электронов 4s-подуровня на 3d-подуровень.
ЗАДАЧИ
-
Укажите для атомов
 ,
,
 ,
,
 :
а) общее число нуклонов; б) число протонов
и нейтронов в ядре; в) общее число
электронов в атоме.
:
а) общее число нуклонов; б) число протонов
и нейтронов в ядре; в) общее число
электронов в атоме. -
Ядро атома элемента содержит 45 нейтронов, а электронная оболочка атома — 34 электрона. Какой это элемент и чему равен заряд ядра атома?
-
Масса атома некоторого изотопа равна 127 а.е.м. В электронной оболочке атома содержится 53 электрона. Какой это элемент, сколько протонов и нейтронов содержится в ядре атома?
-
Углерод имеет изотопы с массовыми числами 12 и 13. Укажите для каждого изотопа порядковый номер, число протонов и нейтронов, заряд ядра.
-
Атомная масса бора 10,81. Бор состоит из двух изотопов:
 и
и  .
Определите массовую долю в нем изотопа
.
Определите массовую долю в нем изотопа
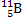 .
. -
Сколько нейтронов в ядрах следующих изотопов:
 ,
,
 ,
,
 ,
,
 ,
,
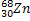 ,
,
 ,
,
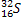 ,
,
 ,
,
 ,
,
 ?
? -
На один атом изотопа
 ,
приходится приблизительно три атома
изотопа
,
приходится приблизительно три атома
изотопа  .
Какой средней атомной массе это
соответствует?
.
Какой средней атомной массе это
соответствует? -
Определите среднюю относительную атомную массу магния, если массовые доли его изотопов,
 ,
,
 в
земной коре 78,60; 10,11; 11,29%.
в
земной коре 78,60; 10,11; 11,29%. -
Медь имеет изотопы с массовыми числами 65 и 63. Укажите для каждого изотопа порядковый номер, число протонов и нейтронов, заряд ядра. Определите массовую долю изотопа с массовым числом 65, приняв относительную атомную массу меди равной 63,54. Какова массовая доля изотопа меди 65 в гидроксиде меди(II)?
-
Массовая доля изотопа серебра составляет, %:
 — 44,
— 44,  — 56. Определите среднюю относительную
атомную массу серебра.Неустойчивый
изотоп
— 56. Определите среднюю относительную
атомную массу серебра.Неустойчивый
изотоп 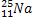 испускает (β-частицу. В ядро какого
элемента он при этом превращается?
испускает (β-частицу. В ядро какого
элемента он при этом превращается? -
Изотоп
 испускает α-частицу. В ядро какого
элемента он при этом превращается?
испускает α-частицу. В ядро какого
элемента он при этом превращается? -
Торий-232 под действием нейтронов и в результате захвата двух (β-частиц превращается в отличное ядерное горючее. Что это за горючее? Напишите уравнения ядерных превращений.
-
Сколько α- и β-частиц должен потерять изотоп свинца Рb, чтобы превратиться в атом ртути
 ?
? -
Какой элемент получится при естественном распаде ядра
 = ? +
= ? +  ?
? -
Какой элемент образуется в результате последовательного распада' полония, если при этом образовалось три α- и две β-частицы? Какова его валентность по кислороду и водороду, масса атома и заряд ядра?
-
Соблюдено ли правило сумм индексов в следующих ядерных реакциях:
![]()
-
К какой группе Периодической системы принадлежит элемент, получившийся из
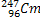 путем последовательного распада, в
процессе которого образовались три
α-частицы, три β-частицы и два нейтрона
путем последовательного распада, в
процессе которого образовались три
α-частицы, три β-частицы и два нейтрона
 ? Каков заряд полученного элемента и
какова его атомная масса?
? Каков заряд полученного элемента и
какова его атомная масса? -
На основании строения атома докажите, у какого элемента II группы: у магния или стронция, сильнее проявляются металлические свойства.
-
Что общего в строении атомов лития, натрия, калия?
-
Назовите элементы I группы, в предпоследнем слое атомов которых содержится 8 электронов, 18 электронов.
-
Напишите электронные формулы для ионов: Fe2+, Fe3+, Cl-, S2-, Cu2+, Cr3+.
-
Может ли ион двухвалентного металла иметь электронную конфигурацию 1s22s22p63s1; 1s22s22p63s23p6?
-
На основании электронной структуры установите химические свойства элементов с порядковыми номерами 7, 17, 20, 26.
-
Сколько электронных слоев у атомов с числом протонов в ядре 4, 9, 17, 19? Ответ обоснуйте.
-
Для всех ли элементов номер группы соответствует числу электронов в последнем слое атома? Ответ поясните.
-
Сколько неспаренных электронов содержится в основном состоянии в электронных оболочках атомов хлора, серы, углерода?
-
Образует ли элемент газообразное соединение с водородом, если он имеет формулу высшего оксида X2O7, а внешний квантовый слой содержит 4р5-электроны? Напишите электронную формулу этого элемента.
-
Среди приведенных ниже конфигураций укажите возможные и невозможные: а) 1р2; б) 4s2; в) 5f4; г) 3d3; д) 4р5; е) 2р4; ж) 3d8.
-
В следующих конфигурациях укажите, какие подуровни достроены, а какие не заполнены электронами до полной их емкости: a) 3s2; б) 5d8; в) 4f14; г) 6s1; д) 2р6; е) 3d10.
-
Составьте электронную формулу атома элемента, расположенного: а) в шестой группе 3-го периода; б) в четвертой группе в пятом ряду 4-го периода; в) в седьмой группе в седьмом ряду 5-го периода.
-
Назовите элементы 4-го, 5-го и 6-го периодов, у которых заканчивается заполнение d-орбиталей (3d10, 4d10, 5d10).
-
Напишите электронные формулы атомов 4-го периода седьмой группы.
-

Назовите элементы, имеющие следующие электронные формулы: -
Напишите электронную формулу атома железа. Как распределяют ся электроны на d-подуровне и какова высшая валентность железа?
-
Назовите элементы, имеющие по одному электрону на 3d- и 4d-подуровнях. Напишите электронные формулы атомов этих элементов 1 укажите их положение в Периодической системе.
-
Исходя из распределения электронов по орбиталям атома кремния в возбужденном состоянии, объясните проявление этим элементом валентности, равной четырем.
-
На примере марганца и мышьяка покажите применимость правила Хунда.
-
Главную подгруппу восьмой группы образуют так называемые благородные газы», некоторые из них — гелий, неон и аргон — являются инертными газами, остальные образуют химические соединения. На основании электронно-графических формул гелия, неона и аргона обоснуйте возможность существования соединений одного из них и невозможность иметь соединения для двух других.
-
Назовите элементы, имеющие по одному электрону на 3p1- и 4p1- подуровнях. Напишите электронные формулы атомов этих элементов и укажите их положение в Периодической системе.
-
Сколько свободных d-орбиталей имеет атом ванадия? Напишите его электронную и электронно-графическую формулы.
-
Пользуясь правилом Хунда, покажите распределение электронов по квантовым ячейкам (орбиталям) у атомов хлора, кобальта, азота.
-
Напишите электронно-графическую формулу для атома хлора. Сколько электронных пар в атоме хлора и какие орбитали они занимают? Сколько неспаренных электронов в атоме хлора?
-
Могут ли содержаться d-электроны в данном слое, если его структура заканчивается одной из следующих конфигураций: 3s1; 4p1; 5f11?
-
Напишите электронные формулы атомов элементов: цезия, лантана, тантала, свинца. К каким элементам они относятся (s, p, d или f)?
-
Определите период, ряд и группу, в которых находятся элементы с порядковыми номерами 14, 24, 52, 63, 76, 101.
-
Какими химическими свойствами должен обладать элемент с порядковым номером 34? С каким элементом в Периодической системе он должен быть наиболее сходен? Дайте обоснованный ответ.
-
Элемент побочной подгруппы имеет высший оксид ХO3. Образует ли этот элемент газообразное соединение с водородом? Дайте обоснованный ответ.
-
У какого из элементов VII группы, у хлора или иода, сильнее выражены неметаллические свойства? Почему? Какой из них образует более сильную кислоту? Исходя из максимальной валентности элемента по кислороду напишите формулы этих кислот.
-
У какого из элементов I группы, у калия или цезия, сильнее выражены металлические свойства? Почему? Какой из них образует более сильный гидроксид? Как можно получить этот гидроксид?
-
Пользуясь Периодической системой Д. И. Менделеева, укажите формулы высших кислородных соединений элементов: марганца, ванадия, германия.
