
- •Закон Кулона
- •Электростатическое поле. Напряженность электростатического поля
- •Потенциал электростатического поля
- •Принцип суперпозиции электростатических полей.
- •Проводники в электростатическом поле
- •Типы диэлектриков. Поляризация диэлектриков
- •Поляризованность. Напряженность поля в диэлектрике
- •Тема 1.2 Электроёмкость Конденсаторы. Соединения конденсаторов. Энергия
- •Электрическая емкость уединенного проводника
- •Конденсаторы
- •Тема 1.3 Электрические цепи постоянного тока
- •Сторонние силы. Электродвижущая сила и напряжение
- •. Закон Ома. Сопротивление проводников
- •Работа и мощность тока. Закон Джоуля — Ленца
- •Закон Ома для неоднородного участка цепи
- •Тема 1.4 Основы расчета электрических цепей постоянного тока
- •Раздел 2 электромагнетизм
- •Тема 2.1 Основные свойства и характеристики магнитного поля
- •Магнитное поле и его характеристики
- •Закон Био — Савара — Лапласа и его применение к расчету магнитного поля
- •Закон Ампера. Взаимодействие параллельных токов
- •Магнитная постоянная. Единицы магнитной индукции и напряженности магнитного поля
- •. Магнитное поле движущегося заряда
- •Действие магнитного поля на движущийся заряд
- •Движение заряженных частиц в магнитном поле
- •Тема 2.2 Электромагнитная индукция
- •Поток вектора магнитной индукции
- •Работа по перемещению проводника и контура с током в магнитном поле
- •Явление электромагнитной индукции (опыты Фарадея)
- •Закон Фарадея
- •Индуктивность контура. Самоиндукция
- •Намагниченность. Магнитное поле в веществе
- •§ 134. Условия на границе раздела двух магнетиков
- •Ферромагнетики и их свойства
- •Природа ферромагнетизма
- •Магнитные поля соленоида и тороида
- •Энергия магнитного поля
- •Раздел 3 однофазные электрические цепи переменного тока
- •Тема 3.1 Однофазный переменный ток. Получение переменного тока. Действующее
- •Тема 3.2 Метод векторных диаграмм Цепь переменного тока с активным
- •Тема 3.3 Расчет цепей переменного тока
- •Раздел 4 трансформаторы
- •Тема 4.1 Трансформаторы
- •Раздел 5 электроника физические основы электроники.
- •Тема 5.1 Электрофизические свойства полупроводников
- •Тема 5.2 Полупроводниковые диоды
- •Раздел 6 электронные выпрямители и стабилизаторы
- •Тема 6.1 Выпрямительные устройства
- •Тема 6.2 Сглаживающие фильтры
- •Тема 6.3 Стабилизаторы напряжения и тока
- •Раздел 7. Химические источники электроэнергии
- •Тема 7.1 Химические источники электроэнергии
- •1. Преобразование химической энергии в электрическую
- •2. Преобразование электрической энергии в химическую
- •Раздел8 Изображение несинусоидальных токов и .Напряжений с помощью
- •Тема 8.1 Изображение несинусоидальных токов и .Напряжений с помощью
- •Раздел 9
- •Тема 9.1 уравнения длинной линии
- •Основные уравиения длинной линии
- •Характеристики длинной линии
- •Холостой ход
- •Короткое замыкание
- •Стоячая волна
- •Бегущая волна
- •Волновое сопротивление. Длина волны
- •Режим с согласованной нагрузкой
- •Режим с несогласованной нагрузкой
- •Электромагнитная волна с прямоугольным фронтом
- •Раздел10. Организация электропитания средств вычислительной
- •Тема 10.1 организация электропитания средств вычислительной
Тема 6.3 Стабилизаторы напряжения и тока




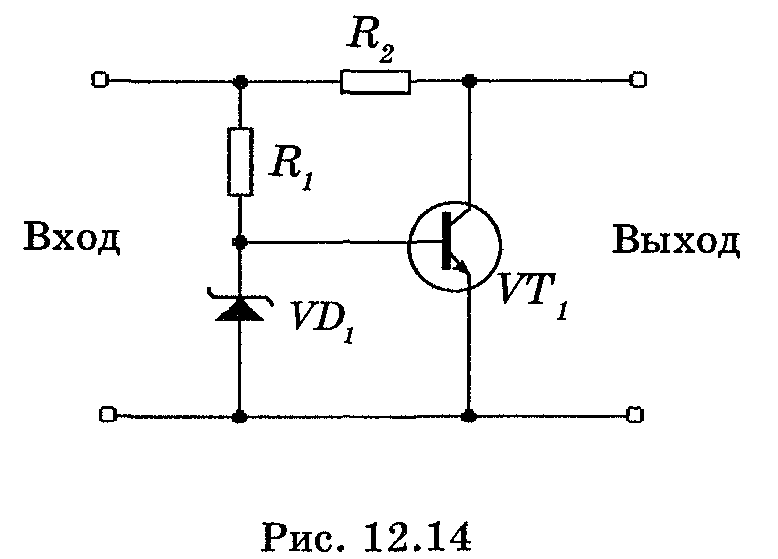

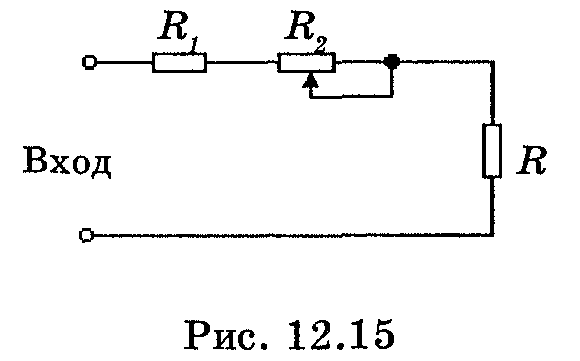
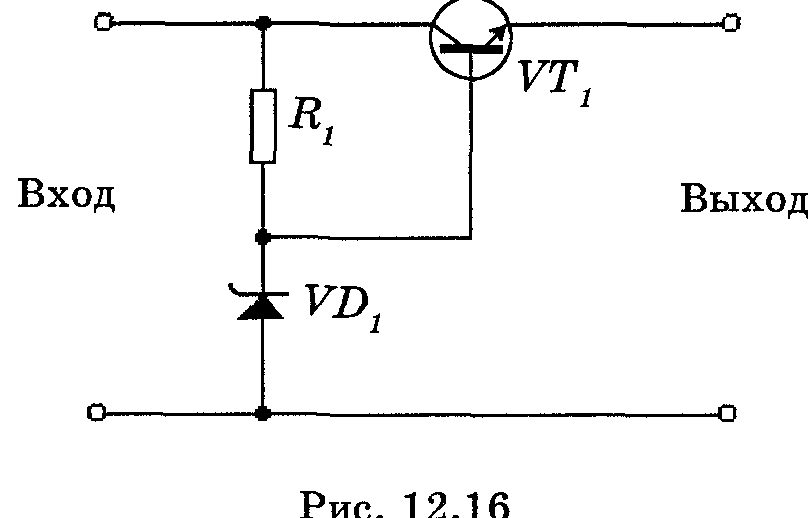





Литература:
1. Жаворонков М.А., Кузин А.В. Электротехника и электроника. Москва,
АСАДЕМ!А, 2005.
2. Касаткин А.С., Немцов М.В. Электротехника. Москва, Высшая школа, 2003
3. Петленко Б.И. Электротехника и электроника. Москва,
АСАДЕМ!А, 2004.
4. Шихин А.Я. Электротехника. Москва, Высшая школа, 2001
5. Берикашвили В.Ш., Черепанов А.К. Электронная техника. Москва,
АСАДЕМ!А, 2005.
6. Трофимова Т.И., Курс физики. Москва, Высшая школа, 2003
Раздел 7. Химические источники электроэнергии
Тема 7.1 Химические источники электроэнергии
1. Преобразование химической энергии в электрическую
Электрохимическими источниками электрической энергии являются гальванические элементы, аккумуляторы, топливные элементы.
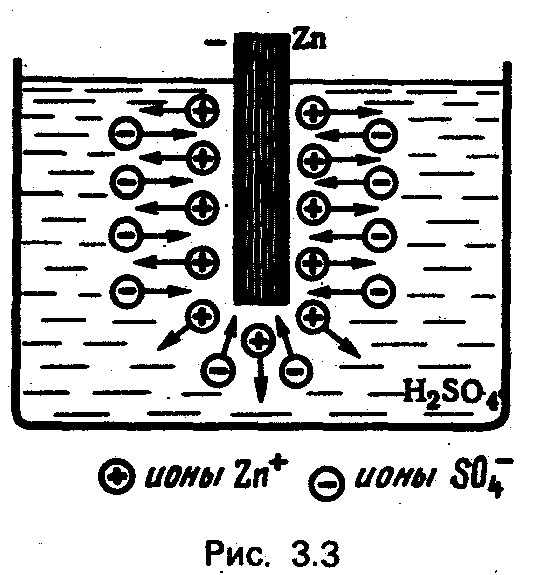
На рис. 3.3 показана цинковая пластинка, опущенная в водный раствор серной кислоты (электролит). Цинк растворяется в электролите, причем в раствор переходят положительные ионы Zn+ . Раствор заряжается положительно, а цинк — отрицательно. Растворение цинка обусловлено химическими силами.
В области контакта цинк — раствор появляется электрическое поле образовавшихся ионов, направленное от раствора к цинку.
По мере растворения цинка растет заряд, а вместе с ним и напряженность электрического поля. Электричёское поле противодействует переходу ионов в раствор, поэтому на определенной стадии растворение цинка прекращается.
Такое равновесное состояние соответствует равенству двух сил, действующих на ионы Zn+: химических, под действием которых цинк растворяется, и электрических, препятствующих растворению. Растворение цинка прекращается при наличии некоторой разности потенциалов U1 между цинком и раствором.
Если в тот же раствор поместить пластинку из другого вещества, то описанный процесс будет иметь место и в этом случае. Но полученная разность потенциалов U2 может быть другой величины — больше или меньше U1.
По такому принципу образуется ЭДС гальванического элемента и аккумулятора (рис. 3.4, а, б).
При соединении пласта I и II проводником в замкнутой цепи будет действовать ЭДС химического элемента
Еа = U1 – U2
и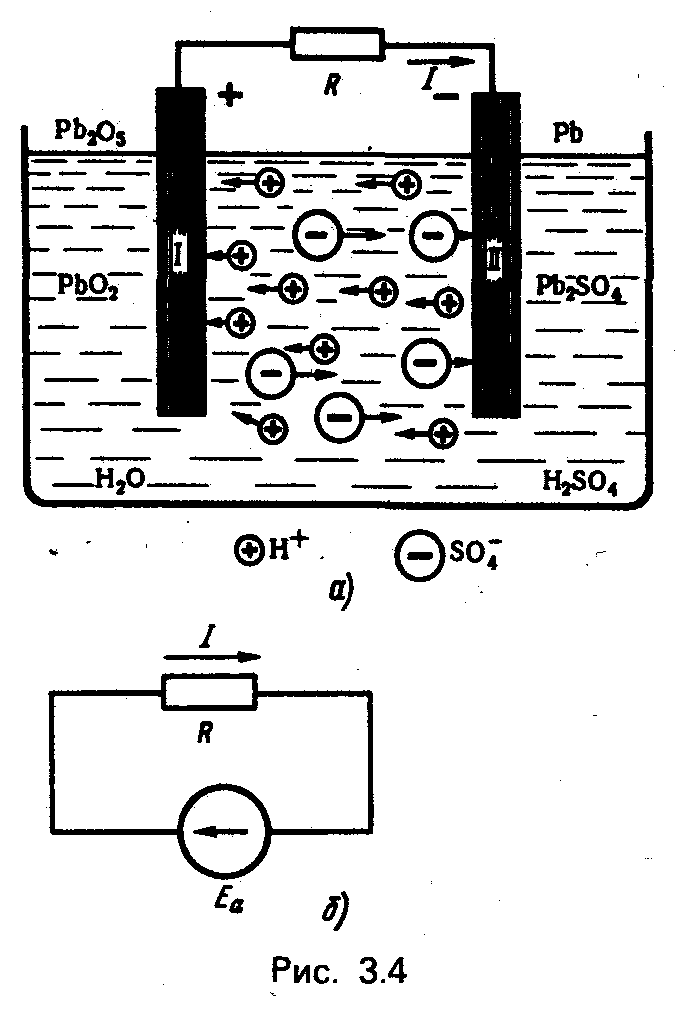 установиться электрический ток.
установиться электрический ток.
В данном случае ЭДС создается и поддерживается при работе элемента химическими силами (сторонние силы) и, следовательно, можно говорить о преобразовании химической энергии в электрическую.
Электрический ток в гальваническом элементе сопровождается необратимыми электрохимическими процессами, которые можно описать определенными химическими реакциями.
Применение гальванических элементов ограничено — в единицу времени они могут дать лишь незначительное количество электрической энергии, а срок их работы невелик и заканчивается, когда активное вещество электродов в определенной степени будет израсходовано.
Значительно большее применение имеют аккумуляторы, электрохимические процессы которых обратимы. Обратимость электрохимических процессов позволяет проводить многократную зарядку и разрядку аккумуляторов. При зарядке в них накапливается определенное количество химической энергии (за счет израсходованной электрической энергии), а при разрядке эта энергия может быть использована в электрической цепи в виде электрической энергии. Рис. 3.4 соответствует режиму разрядки свинцового аккумулятора.
