
- •Выписка из учебной программы. Введение.
- •Практическое занятие № 7 – 4 часа.
- •Карта межпредметных связей.
- •Научно-методическое обоснование темы.
- •Цели и результаты обучения по уровням усвоения учебного материала (выписка из рабочей учебной программы)
- •Приложение № 1. Поуровневая карточка № 1.
- •Поуровневая карточка № 2.
- •Поуровневая карточка № 3.
- •Приложение № 1. Поуровневая карточка № 1 (эталон).
- •Поуровневая карточка № 2 (эталон).
- •Поуровневая карточка № 3 (эталон).
- •Приложение № 2. Рассказ с элементами беседы.
- •Техника приготовления приблизительных растворов.
- •Приготовление растворов солей.
- •Приготовление растворов щелочей.
- •Приготовление растворов кислот.
- •Структура занятия.
- •Теоретическая часть:
- •Решение задач.
- •Техника приготовления приблизительных растворов.
- •Приготовление растворов солей.
- •Приготовление растворов щелочей.
- •Приготовление растворов кислот.
- •2. Указания к занятию:
- •3. Практическая часть.
- •4.1. Изучение инструкции.
- •4.2. Решение задач у доски.
- •4.3. Теоретические расчеты и приготовление растворов процентной концентрации.
- •Задача 2.
- •Задача 3.
- •Комплект задач для подгруппы «в» Задача 1.
- •Задача 2.
- •Задача 3.
- •Комплект задач для подгруппы «с». Задача 1.
- •Задача 2.
- •Задача 3.
- •Комплект задач для подгруппы «d». Задача 1.
- •Задача 2.
- •Задача 3.
- •Решение задач.
- •Решение задач.
- •100 Г раствора – 15 г кон
- •100 Г раствора – 7,5 г кон
- •Задача 3.
- •36,5 Г нс1 занимает объем 22,4 л
- •Структура занятия.
- •1. Теоретическая часть:
- •Решение задач.
- •Техника приготовления приблизительных растворов.
- •Приготовление растворов солей.
- •Приготовление растворов щелочей.
- •Приготовление растворов кислот.
- •2. Указания к занятию:
- •3. Практическая часть.
- •5. Контроль конечного уровня знаний, умений.
- •По теме «введение. Решение задач на концентрацию растворов (процентную)». Поуровневая карточка № 1.
- •Поуровневая карточка № 2.
- •Поуровневая карточка № 3.
Структура занятия.
1. Теоретическая часть:
-
Повторение понятий по теме: «Растворы».
-
Техника приготовления растворов солей, щелочей, кислот процентной концентрации.
-
Правило «Креста».
-
Решение задач.
Растворы разнообразных веществ в воде и органических жидкостях находят в лабораторной практике широкое применение, поэтому лаборанту необходимо уметь приготовить различные растворы. Под названием растворов понимают истинный раствор, в котором растворенное вещество в виде отдельных молекул распределено среди молекул растворителя.



 Растворы
гомогенная система
растворитель
+ растворенное вещество
Растворы
гомогенная система
растворитель
+ растворенное вещество
насыщенные перенасыщенные
водные неводные
Растворимость – способность одного вещества равномерно распределяться в другом, образуя однородную систему.
Концентрацией раствора называется количество растворенного вещества, содержащегося в определенных количествах раствора. В зависимости от единиц измерения количества растворов и растворенного вещества различают концентрацию по массе, если эти количества выражены в массовых единицах (г, кг) и объемную, если она выражена в единицах объема (мл, л и т.д.). По точности выражения концентрации растворы делят на приблизительные и точные.
Процентной концентрацией раствора называют определенное количество растворенного вещества, содержащегося в 100 г или 100 мл раствора. Это общее понятие процентной концентрации включает несколько разновидностей.
В зависимости от единиц (объема или массы), используемых для обозначения количества растворенного вещества и раствора, различают весовую (массовую), весо-объемную (массо-объемную), объемную, объемно-весовую (объемно-массовую) процентную концентрацию.
Массовая процентная концентрация (%) показывает сколько граммов вещества содержится в 100 г раствора.
![]()
При приготовлении растворов различных химических реагентов удобно использовать массовую концентрацию.
Массо-объемная процентная концентрация (г%) представляет собой отношение количества растворенного вещества в граммах к 100 мл раствора. Например, 10 г% раствор NаС1 содержит 10 г соли в 100 мл раствора. Для его получения навеску соли 10 г вносят в мерный цилиндр или мензурку и доливают водой до метки.
Объемная процентная концентрация (об% или 0-градус) есть отношение количества вещества в мл к 100 мл раствора. Например, 5 об% (5º) раствор этилового спирта содержит 5 мл безводного спирта и 95 мл воды.
Объемно-масовая процентная концентрация, отражающая количество мл вещества, содержащееся в 100 г раствора, редко используется в клинико-лабораторной практике.
К приблизительным растворам относятся растворы, концентрация которых выражена в процентах, а так же растворы кислот, концентрация которых обозначена выражением 1:Х.
![]()
Массовую долю растворенного вещества принято выражать на 100 г раствора. Следовательно, 5% раствор содержит 5 г вещества в 100 г раствора или 5 г вещества и 100 – 5 = 95 г растворителя.
Часто употребляют растворы кислот, концентрация которых выражена 1:Х, где Х – целое число, показывающее, сколько объемов воды надо взять на один объем концентрированной кислоты.
Например, раствор кислоты 1:5 означает, что при приготовлении раствора смешали 5 объемов воды с 1 объемом концентрированной кислоты.
При приготовлении приблизительных растворов количество растворяемого вещества рассчитывают с точностью до десятых долей, значения молекулярных масс берут округленно до целых чисел, а при расчете количества жидкости доли миллилитра не учитывают. Техника приготовления растворов различных веществ различна. Однако при приготовлении любого приблизительного раствора навеску берут на технохимических весах, а жидкости отмеривают мерным цилиндром.
Для приготовления неточных растворов используются технохимические, аптекарские весы и неточная мерная посуда.
Если возникает потребность в получении приблизительных растворов путем разбавления более концентрированных, можно воспользоваться простым и быстрым способом, правилом «креста».
Например, необходимо разбавить 20% (200 г/л) раствор сернокислого аммония до 5% (50 г/л). составляют первую запись:
2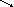 0 20
– показатель концентрации взятого
раствора
0 20
– показатель концентрации взятого
раствора
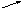 5, где,
5 – показатель требуемой концентрации
5, где,
5 – показатель требуемой концентрации
0 0 – вода.
Из 20 вычитают 5 и полученное значение записывают в правом нижнем углу. Из 5 вычитают ноль и записывают цифру в правом верхнем углу. После этого схема принимает вид:
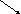
 20 5
20 5
5
 0
15
0
15
Это означает, что для получения 5% раствора нужно 5 объемов 20% раствора смешать с 15 объемами воды.
Если смешивать два исходных раствора одного и того же вещества для получения раствора промежуточной концентрации, то из схемы устраняется «0». Пусть смешиваем 35% и 15% растворы, требуется приготовить 25%. В этом случае схема примет вид:
 35
10
35
10
25
1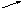
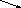 5
10
5
10
Следовательно, для приготовления 25% раствора нужно взять по 10 объемов обоих исходных растворов. Такими схемами можно пользоваться, если не требуется достижение особой точности приготовления растворов.
