
- •Оглавление:
- •Лекция № 1. Тема «введение».
- •Ультрацентрифугирование.
- •Лекция № 2. Тема «химия углеводов».
- •Химические свойства и использование их в лабораторной практике.
- •Методы определения моносахаридов.
- •Соединения моносахаридов, их биологическое значение.
- •Написать формулы.
- •Лекция № 3. Тема «химия углеводов».
- •Лекция № 4. Тема «химия липидов».
- •Функции липидов.
- •Лекция № 5. Тема «химия липидов».
- •Строение биологической мембраны.
- •Лекция № 6. Тема «химия белков».
- •Лекция № 7. Тема «химия белка».
- •Лекция № 8. Тема «химия белка».
- •Методы выделения и очистки белков.
- •Лекция № 9. Тема «химия нуклеиновых кислот».
- •Циклические мононуклеотиды.
- •Кофермент а (коэнзим а).
- •Пиридиновые и флавиновые нуклеотиды.
- •Нуклетидфосфат
- •Нуклеиновые кислоты – это полинуклеотиды.
Лекция № 6. Тема «химия белков».
-
Белки – природные полимеры, биологическое значение. Функции.
-
Аминокислоты: классификация, физико-химические свойства.
-
Электрофорез аминокислот.
-
Образование пептидной связи. Пептиды – состав, биологические функции.
-
Уровни структурной организации белковой молекулы.
БЕЛКИ – это высокомолекулярные соединения, состоящие из α-аминокислот – мономерных звеньев, соединенных между собой пептидными связями.
Белки, или протеины, количественно преобладают над всеми другими макромолекулами живой клетки. С белками мы встречаемся всюду, где имеет место проявление жизни. Белки участвуют во всех биологических процессах, выполняя разнообразные функции.
Основная функция белков в организме – это
-
пластическая, т.е. они используются для построения органов и тканей животных и человека.
Белки выполняют:
-
каталитическую функцию – свыше 2000 ферментов-биокатализаторов – выделено к настоящему времени. Практически все они являются белками. Химические реакции, лежащие в основе процессов жизнедеятельности, катализируются ферментами.
-
Сократительная функция – важным признаком живого является подвижность. В основе ее лежит сократительная функция белков. Например, мышечные сокращения, изменение формы клеток и субклеточных частиц.
-
Транспортная функция – белки обладают исключительными возможностями по специфическому связыванию различные соединений, например связь Нb с О2 и перенос по крови, комплекс альбумина с билирубином, что способствует обезвреживанию билирубина и др.
-
Защитная функция – белки-антитела предохраняют организм от чужеродных агентов, участвуют в выработке иммунитета.
-
Регуляторная функция – некоторые белки являются гормонами, участвуют в регуляции разнообразных процессов, протекающих в организме. Так, гормон инсулин регулирует содержание глюкозы в крови, ряд белков участвуют в регуляции осмотического давления, рН крови и т.д.
-
Белки могут использоваться и как энергетический материал (при полном окислении 1 г белка выделяется 16,9 кДж энергии).
Каждый белок имеет уникальную, свойственную лишь ему структуру и в такой же мере уникальную функцию, отличающую от функций других белков.
По своему элементарному составу белки характеризуются наличием С, О, Н, N, S и часто Р. Процентное содержание отдельных элементов в белковых веществах: С – 50,6-54,5%; О2 – 21,5-23,5%; Н – 6,5-7,3%; N – 15,0-17,6%; S – 0,3-2,5%. Обычно среднее содержание азота в белке принимают равным 16%. В связи с этим предложено определять количество белка по входящему в его состав азоту.
Зная, что 1 г азота содержится в 6,25 г белка, находят количество азота, умножают на коэффициент 6,25 и получают количество белка.
Например, в организм с пищей человек получил 80 г белка. Сколько азота может выделиться с продуктами распада?
1 г азота ---------------- 6,25 г белка
Х г азота ---------------- 80 г белка
![]()
Аминокислоты – главные составные части белков, мономеры белков. Физико-химические и биологические свойства белков определяются их аминокислотным составом. Аминокислоты – это аминопроизводные класса карбоновых кислот, они входят не только в состав белков, многие из них выполняют специальные функции. По биологической значимости аминокислоты разделяют на заменимые и незаменимые. Известно 20 аминокислот, которые входят в состав природных белков. Аминокислоты живых организмов кодируются генетическим кодом, их называют протеиногенные, их 20, 19 из них являются α-аминокислотами, т.е. группа -NН2- присоединена к α-углеродному атому тех карбоновых кислот, производными которых они являются. Исключение составляет пролин – аминокислота, она не соответствует общей формуле аминокислот:
 R
R
Н2N-СН-СООН

 СН2-СООН
СН3-СН-СООН
СН2-СООН
СН3-СН-СООН

NН2 NН2
глицин аланин и др.
По строению соединений, получающихся при расщеплении углеродной цепи аминокислоты в организме, различают:
а) глюкопластичные (глюкогенные) – при недостаточном поступлении углеводов или нарушении их превращения они через щавелевоуксусную или фосфоэнолпировиноградную кислоты превращаются в глюкозу или гликоген. К этой группе относятся глицин, аланин, серин, треонин, Валин, аспарагиновая и глутаминовая кислота, аргинин, гистидин и метионин;
б) кетопластичные (кетогенные) – ускоряют образование кетоновых тел – лейцин, изолейцин, тирозин и фенилаланин (три последние могут быть и глюкогенными).
По структуре аминокислоты разделяют на 2 группы:
А) ациклические – аминокислоты предельного ряда;
Б) циклические – аминокислоты ароматического ряда.
А. По количеству функциональных групп различают ациклические аминокислоты:
-
моноаминомонокарбоновые – в молекуле каждой из них имеется одна амино- и одна карбоксильная группа, в водном растворе дает нейтральную среду.
Глицин
 СН2-СООН
СН2-СООН
NН2
 Участвует
в образовании нуклеиновых кислот,
желчных
кислот, гема, необходим для
обезвреживания в печени токсических
веществ.
Участвует
в образовании нуклеиновых кислот,
желчных
кислот, гема, необходим для
обезвреживания в печени токсических
веществ.
Аланин
Н 3С-СН-СООН
3С-СН-СООН
NН2
Участвует в процессах обмена углеводов и энергии. Его изомер β-аланин является составной частью витамина пантотеновой кислоты (В5), коэнзима А (КоА), экстрактивных веществ мышц.
Серин
Н ОН2С-СН-СООН
ОН2С-СН-СООН
NН2
Входит в состав различных ферментов, основного белка молока – казеина, обнаружен в составе липопротеидов и других белков.
Цистеин
СН2-СН-СООН


SН NН2
Благодаря группе -SН- цистеин окисляется и защищает организм при лучевом поражении, отравлении фосфором.
Метионин
 СН2-S-СН3
СН2-S-СН3
 СН2
СН2
 СН-NН2
СН-NН2
СООН
Содержит группу -СН3, которая используется для синтеза важных соединений – холина, креатина, Тимина, адреналина и др.
-
моноаминодикарбоновые кислоты – имеют одну амино- и 2 карбоксильных группы, в водном растворе дают кислую среду. К ним относят
а
 спарагиновую
кислоту СООН и глутаминовую к-ту СООН
спарагиновую
кислоту СООН и глутаминовую к-ту СООН
 СН2
СН2
СН2
СН2


 СН-NН2
СН2
СН-NН2
СН2
СООН СН-NН2

СООН
Эти аминокислоты участвуют в биосинтезе белка, образовании тормозных медиаторов (переносчик нервных возбуждений) нервной системы, энергетическом обмене.
-
диаминомонокарбоновые кислоты – имеют две амино- и одну карбоксильную группу, в водном растворе дают щелочную среду. К ним относят лизин NН2-СН2-(СН2)3-СН-СООН

NН2
 и
аргинин NН2-С-NН-(СН2)3-СН-СООН
и
аргинин NН2-С-NН-(СН2)3-СН-СООН

NН2 NН2
Лизин участвует в синтезе белка, обнаружен в составе некоторых ферментов. Аргенин участвует в синтезе мочевины, креатина, который входит в состав мышц и участвует в обмене энергии.
Б. Циклические аминокислоты имеют в составе ароматическое или гетероциклическое ядро, незаменимые, должны поступать с пищей. Активно участвуют в разнообразных обменных процессах.
Фенилаланин





 -СН2-СН-СООН
-СН2-СН-СООН

NН2
Основной источник синтеза тирозина – предшественник гормонов тироксина, адреналина, некоторых пигментов.
Тирозин




 НО -СН2-СН-СООН
НО -СН2-СН-СООН


NН2
Участвует в синтезе адреналина, тироксина.
Триптофан



 N
N

 Н2С
Н2С
 N – Н
N – Н


 СН
СН
Н2N СООН
Участвует в синтезе белка, используется для синтеза витамина РР, серотонина, гормонов эпифиза, ряда пигментов.


Г истидин
истидин



 Н2С
Н2С













NН
Н2N-СН-СООН
Участвует в синтезе белка, предшественник гистамина, влияющего на кровяное давление, секрецию желудочного сока.
Химические и физико-химические свойства аминокислот обусловлены функциональными группами с противоположными свойствами. Поэтому в водном растворе аминокислоты существуют в виде равновесной смеси биполярного иона, катионной и анионной форм молекулы. Равновесие зависит от рН среды.
N

 Н3+-СН-СООН
↔NН3+-СН-СОО¯ ↔
NН2-СН-СОО¯
Н3+-СН-СООН
↔NН3+-СН-СОО¯ ↔
NН2-СН-СОО¯
R R R
катионная форма биполярный ион анионная форма
кислая среда ←← рН→→ щелочная среда
Нейтральные аминокислоты в воде не имеют заряда. Иначе ведут себя дикарбоновые кислоты, обе их карбоксильные группы диссоциируют, отдавая 2 протона, но поскольку у них только одна аминогруппа, принимающая один протон, то такие аминокислоты ведут себя как кислоты и раствор имеет кислую реакцию. Возникающий при этой диссоциации ион имеет избыток отрицательного заряда.

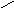 СООН СОО¯
СООН СОО¯
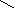
 R ↔ R +
Н+
R ↔ R +
Н+
NН2 NН2
Основные аминокислоты реагируют в водном растворе как слабые основания. Это связано с тем, что один протон, который освобождается при диссоциации карбоксильной группы таких аминокислот, связывается с одной из аминогрупп, а вторая аминогруппа связывает протон из водного окружения, увеличивая тем самым количество ОН-групп и повышая рН. Заряд иона таких аминокислот положительный.

 СООН СООН
СООН СООН

 R + Н+ → R
R + Н+ → R
NН2 NН3+
При добавлении в раствор аминокислот дополнительного количества протонов (кислоты) подавляется диссоциация карбоксильных групп и увеличивается количество NН3+-групп. Аминокислоты при этом переходят в катионную форму (приобретают положительный заряд). При добавлении щелочи улучшаются условия для диссоциации карбоксильных групп – аминокислоты переходят в анионную форму ( приобретают отрицательный заряд). Изменяя таким образом рН раствора, можно изменять заряд молекул аминокислот. В зависимости от свойств аминокислот количество добавляемой кислоты или щелочи для изменения величины заряда будет разным. При определенном для каждой аминокислоты значении рН наступает такое состояние, при котором заряд аминокислоты становится нейтральным. Такое значение рН получило название изоэлектрической точки (рJ). При значении рН, равном изоэлектрической точке, аминокислоты не перемещаются в электрическом поле. При рН ниже изоэлектрической точки катион аминокислоты движется к катоду, а при рН выше рJ анион аминокислоты движется к аноду. На этих свойствах аминокислот основана возможность их разделения в электрическом поле (электрофорез). Кислые аминокислоты имеют рJ в слабокислой среде, основные – в слабоосновной, а нейтральные – в нейтральной.
Аминокислоты, обладая одновременно свойствами слабой кислоты и слабого основания (амфотерные свойства), могут играть роль буферной системы, где могут реагировать как слабая кислота или как слабое основание.
Аминокислоты могут объединяться в длинные цепи, образуя между собой пептидные связи. Две аминокислоты при этом образуют дипептид и т.д. Пептиды содержащие до 10 аминокислот называют олигопептидами, а до 50 – полипептидами, а если больше, чем 50 аминокислот, то уже – белками.
 Н
Н





 СН2-СО ОН + N-СН2-СООН →
СН2-СО-NН-СН2-СООН + Н2О
СН2-СО ОН + N-СН2-СООН →
СН2-СО-NН-СН2-СООН + Н2О
дипептид глицина

 NН2 Н
NН2
NН2 Н
NН2

Пептидные связи образуются при взаимодействии α-аминогруппы одной аминокислоты с α-карбоксильной группой другой аминокислоты.
Пептидная связь – амидная ковалентная связь, соединяющая аминокислотные остатки в цепочку. Следовательно, пептиды – это цепочки аминокислот.
Пептидная связь довольно прочная, её можно разорвать, например, путем нагревания раствора белка в присутствии кислоты или щелочи, которые активируют гидролиз этой связи.
Гидролиз пептидной связи в клетках ускоряется при помощи специальных ферментов. Небольшие пептиды в организме присутствуют в незначительных количествах. В последние годы много внимания уделяется изучению структуры и функции пептидов, выполняющих многие важные биологические функции.
Природные пептиды разделяются на несколько групп в зависимости от выполняемых ими функций.
-
Группа пептидов, содержащих глутаминовую кислоту, образующих пептидную связь своей гамма-карбоксильной группой. Это гамма-глутамилпептиды. К этой группе относят глутатион – трипептид (глу-цис-гли), участвующий в окислительно-восстановительных реакциях и обладающий антиоксидантными свойствами (препятствие развитию цепных реакций и свободнорадикальных).
-
Пептиды – кинины – регуляторы тонуса сосудов.
-
Пептиды – регуляторы функций гипофиза.
-
Пептиды – гормоны – инсулин, глюкагон и др.
-
Пептиды – нейромедиаторы. Существуют группы нейронов, связанных между собой молекулами – посредниками пептидной природы.
-
Нейропептиды секретируются нервными клетками, могут оказывать обезболивающий эффект (энкефалины и эндорфины), модулировать поведенческие реакции.
-
Пептиды – антибиотики. Ряд пептидов, образуемых микроорганизмами, используется в медицинской и исследовательской практике в качестве регуляторов механизмов синтеза белка, проницаемости мембран.
-
Пептиды – токсины. Из грибов и растений выделено большое число пептидов, вызывающих отравления у человека и животных (пептиды бледной поганки, пептиды насекомых).
Исследование строения и функций биологически активных пептидов позволяет понять многие стороны регуляции процессов жизнедеятельности организмов.
Белки имеют сложную пространственную структуру. Исследователи выделили 4 уровня организации.
Первичная структура – понятие, обозначающее последовательность аминокислотных остатков в белке. Например,




 S S
S S
Глу-Глун-Цис-Цис-Ала-Сер-Вал-Цис-Сер-Лей
(фрагмент одной из цепей молекулы инсулина)
Пептидная связь – основной вид связи, определяющий первичную структуру, она является ковалентной связью. Возможно и присутствие дисульфидных связей между двумя остатками цистеина в одной полипетидной цепи с образованием цистина.
Последовательность аминокислот в белке уникальна и детерминируется генами. Даже небольшие изменения первичной структуры могут серьезно изменять свойства белка. Первичная структура белков обеспечивает формирование последующих уровней структурной организации и определяет видовую специфичность белка.
Расшифрована первичная структура ряда ферментов: рибонуклеазы (129 аминокислот), карбоксипептидазы (309 аминокислот), некоторых гормонов. В последние годы внимание исследователей привлекают пептиды, состоящие из небольшого числа аминокислот и обладающие высокой биологической активностью. Гормон окситоцин (9 аминокислот) стимулирует сокращение гладкой мускулатуры (матки, молочной железы, кишечника). Гормон вазопрессин (9) – антидиуретический гормон, повышает кровяное давление, увеличивает реабсорбцию воды в почках. Недостаток его приводит к развитию несахарного диабета, при котором выделяется больше 10 л мочи в сутки, сильно разбавленной. Гормон инсулин контролирует содержание глюкозы в крови.
Определенный интерес представляет группа пептидов – энкефалины, которые вырабатываются в клетках ЦНС в ответ на болевые раздражения и ослабляют чувство боли. Так же обнаружены пептиды целенаправленного действия сна, жажды и т.д.
Вторичная структура – упорядоченная и компактная упаковка полипептидной цепи в пространстве. Она бывает в виде спирали и складчатой структуры. Образование вторичной структуры обеспечивается водородной связью, нековалентной. α-спиральную конфигурацию поддерживают, в основном, водородные связи внутри полипептидной цепи, β-структура полипептидной цепи имеет зигзагообразную структуру, полипептидные цепи уложены параллельно друг другу в виде складчатого слоя. В β-конфигурации отсутствуют внутрицепочечные водородные связи, а имеются межцепочечные водородные связи между пептидными группами соседних полипептидных цепей. Вторичная структура способствует компактизации полипептидной цепи, укладывая ее в α-спираль или β-структуру, тем самым определяя такие свойства как прочность, нерастворимость.
Вторичная структура детерминирована размером, формой и полярностью боковых радикалов аминокислот полипептидных цепей. Вторичная структура характерна для альбуминов, глобулинов, кератина волос, коллагена сухожилий.
Третичная структура – расположена в пространстве всей полипетидной цепи, содержащей α-спирали, β-структуры. Большая часть белков на уровне этой структуры принимает глобулярную форму. Основу составляют ионные связи, электростатические, в некоторых белках – ковалентные дисульфидные связи, которые стабилизируют третичную структуру. Третичная структура обеспечивает выполнение белком его основных функций. Глобулярные белки – альбумины и глобулины, обнаружены в крови и многих органах, фибриллярные – основа мышечных тканей. Характер третичной организации устанавливают с помощью рентгеноструктурного анализа.
Третичную структуру принято называть «нативной конформацией», т.е. нативные свойства белков (естественное состояние) определяются третичной структурой. При разрыве связей, стабилизирующих третичную структуру, белок теряет частично или в полной мере биологические и функциональные свойства.
Четвертичная структура – возникает в результате объединения нескольких субъединиц с третичной структурой в одну большую молекулу. Связь между субъединицами нековалентная, хотя в ряде белков субъединицы соединены ковалентными дисульфидными мостиками. Четвертичная структура обеспечивает кооперативный эффект, например молекула гемоглобина состоит из 4 субъединиц (степень α-спирализации составляет 80%, т.е. наибольшую), каждая из которых способна присоединять молекулу кислорода. При этом связывание кислорода одной субъединицей изменяет конформацию других субъединиц таким образом, что присоединение кислорода к ним облегчается – это совместный (кооперативный) эффект.
Фермент ЛДГ – 4 субъединицы: 2Н и 2М. их разные комбинации позволяют создать 5 ферментов, катализирующих одинаковую реакцию в разных органах и тканях: НННН, НННМ, ННММ, НМММ, ММММ. Такие белки называются – изопротеины или изоферменты. Изоферменты имеют различную локализацию в тканях. Это имеет важное значение для диагностики различных заболеваний.
Высшие уровни структуры молекулы белка обусловлены в основном особенностями первичной структуры, но в значительной мере зависят также и от условий среды, в которой находится белок (рН, tº).
