
- •Учебно-методическое пособие для самоподготовки и самостоятельной работы студентов по курсу «техническая термодинамика и теплотехника»
- •Тема 1. Основные термодинамические параметры Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Задачи для самостоятельного решения:
- •Рекомендуемая литература:
- •Определение основных термодинамических Параметров
- •Тема 2. Основные законы идеальных газов Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Задачи для самостоятельного решения:
- •Краткие теоретические положения по теме:
- •Тема 3. Основные свойства газовых смесей Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Задачи для самостоятельного решения:
- •Рекомендуемая литература:
- •Краткие теоретические положения по теме:
- •Тема 4. Реальные газы Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Краткие теоретические положения по теме:
- •Тема 5. Первый закон термодинамики Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Задачи для самостоятельного решения:
- •Техническая термодинамика и теплотехника: учеб.Пособие для вузов/ л.Т. Бахшиева, б.П. Кондауров, а.А. Захаров, в.С. Салтыкова; под ред. А.А. Захаровой. – м.: «Академия», 2006 – с.48 – 52
- •Мазур л.С. Техническая термодинамика и теплотехника: Учебник. – м.: гэотар-мед, 2003. – с.16-18, 28-30
- •Тема 6. Теплоемкость газов
- •Рекомендуемая литература:
- •Тема 7. Основные газовые процессы Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Задачи для самостоятельного решения:
- •Рекомендуемая литература:
- •Мазур л.С. Техническая термодинамика и теплотехника: Учебник. – м.: гэотар-мед, 2003. – с.18-28
- •Изотермическое сжатие воздуха
- •Экспериментальная часть
- •Обработка результатов измерений
- •Построение уравнения состояния воздуха
- •Тема 8. Теорема карно. Эксергия. Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Задачи для самостоятельного решения:
- •Рекомендуемая литература:
- •Техническая термодинамика и теплотехника: учеб.Пособие для вузов/ л.Т. Бахшиева, б.П. Кондауров, а.А. Захаров, в.С. Салтыкова; под ред. А.А. Захаровой. – м.: «Академия», 2006 – с.145 -153
- •Мазур л.С. Техническая термодинамика и теплотехника: Учебник. – м.: гэотар-мед, 2003. – с.41-53, 63-66, 155-160 Краткие теоретические положения по теме:
- •Тема 9. Применение термодинамических таблиц и диаграмм для решения инженерных задач Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Задачи для самостоятельного решения:
- •Краткие теоретические положения по теме:
- •Средства измерения температуры
- •Общие сведения о температурных шкалах
- •Термометры стеклянные жидкостные
- •Введение поправок к показаниям термометра.
- •Термоэлектрические измерители температуры (термопары)
- •Средства измерения давления
- •Жидкостные манометры
Рекомендуемая литература:
-
Техническая термодинамика и теплотехника: учеб.пособие для вузов/ Л.Т. Бахшиева, Б.П. Кондауров, А.А. Захаров, В.С. Салтыкова; под ред. А.А. Захаровой. – М.: «Академия», 2006 – С.54 - 59
Краткие теоретические положения по теме:
При расчёте тепловой аппаратуры наиболее важным моментом является определение количества теплоты, участвующее в процессе. Точное его определение обеспечивает правильную оценку работы аппарата с экономической точки зрения.
Сообщение телу
теплоты в каком-либо процессе вызывает
изменение его состояния и в общем случае
сопровождается изменением температуры.
Отношение количества теплоты
![]() ,
полученного телом при бесконечно малом
изменении его состояния, к связанному
с этим изменению температуры тела
,
полученного телом при бесконечно малом
изменении его состояния, к связанному
с этим изменению температуры тела
![]() называется полной теплоёмкостью тела
в данном процессе:
называется полной теплоёмкостью тела
в данном процессе:
![]()
Обычно величину теплоёмкости относят к единице количества вещества и в зависимости от выбранной единицы различают:
-
Удельную массовую теплоёмкость
 - равную отношению теплоёмкости
однородного тела к его массе, в
- равную отношению теплоёмкости
однородного тела к его массе, в
 ;
; -
Удельную объёмную теплоёмкость
 - равную отношению теплоёмкости рабочего
тела к его объёму при нормальных условиях
(Р=10325 Па, t=0оС),
в
- равную отношению теплоёмкости рабочего
тела к его объёму при нормальных условиях
(Р=10325 Па, t=0оС),
в
 ;
; -
Удельную мольную теплоёмкость
 - равную произведению удельной
теплоёмкости вещества на молярную
массу этого вещества:
- равную произведению удельной
теплоёмкости вещества на молярную
массу этого вещества:
 ,
в
,
в
 ;
;
Между этими теплоёмкостями существует следующая связь:
![]() ,где
,где
![]() - удельный объём
при нормальных физических условиях;
- удельный объём
при нормальных физических условиях;
![]() - молярная масса.
- молярная масса.
Теплоёмкости зависят от характера процесса, т. е. являются функциями процесса. В термодинамике имеют большое значение:
-
Теплоёмкость при постоянном давлении:
 ,
равная отношению количества теплоты
,
равная отношению количества теплоты
 ,
сообщённой телу в процессе при постоянном
давлении, к изменению температуры тела
,
сообщённой телу в процессе при постоянном
давлении, к изменению температуры тела
 ;
; -
Теплоёмкость при постоянном объёме:
 ,
равная отношению количества теплоты
,
равная отношению количества теплоты
 ,
подведённой к телу в процессе при
постоянном объёме к изменению температуры
тела
,
подведённой к телу в процессе при
постоянном объёме к изменению температуры
тела
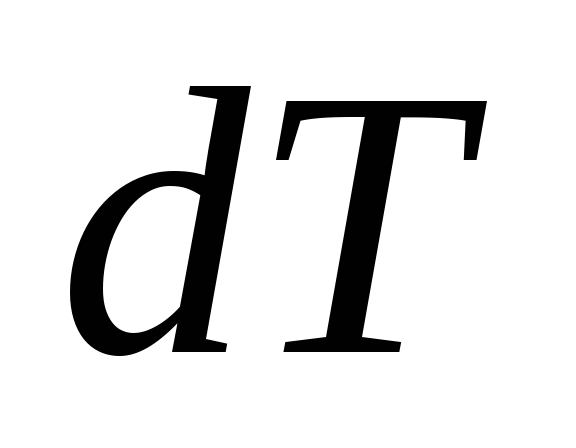 .
.
В термодинамике
часто используется отношение теплоёмкости
при постоянном давлении к теплоёмкости
при постоянном объёме, которые обозначают
буквой
![]() .
.
![]()
Согласно классической
кинетической теории газов
![]() определяется числом степеней свободы
молекул. Для одноатомного газа при
определяется числом степеней свободы
молекул. Для одноатомного газа при
![]() (удельной
массовой теплоёмкости) R=1,66;
для двухатомного – 1,4; для трёх- и
многоатомного – R=1,33.
(удельной
массовой теплоёмкости) R=1,66;
для двухатомного – 1,4; для трёх- и
многоатомного – R=1,33.
При![]() для идеальных газов:
для идеальных газов:
![]()
или из уравнения
Майера:

Истинная и средняя теплоёмкости
Теплоёмкость тела
в данном состоянии, определяемая
параметрами
![]() и Т или Р и Т называют истинной
теплоёмкостью. Это
отношение элементарного количества
теплоты, сообщаемой ТД системе в
каком-либо процессе, к бесконечно малой
разности температур.
и Т или Р и Т называют истинной
теплоёмкостью. Это
отношение элементарного количества
теплоты, сообщаемой ТД системе в
каком-либо процессе, к бесконечно малой
разности температур.
Истинную теплоёмкость
реальных газов можно выразить в виде
суммы двух слагаемых:
![]() ,
где
,
где
![]() - теплоёмкость данного газа в разряженном
состоянии при
- теплоёмкость данного газа в разряженном
состоянии при
![]() или
или
![]() ,
которая зависит от температуры (состояние
идеального газа).
,
которая зависит от температуры (состояние
идеального газа).
Температурная
зависимость
![]() может быть представлена в виде полинома
третьей степени:
может быть представлена в виде полинома
третьей степени: ![]()
Второе слагаемое
![]() определяет зависимость теплоёмкости
от давления или удельного объёма. Связано
с изменением потенциальной составляющей
внутренней энергии реального газа.
определяет зависимость теплоёмкости
от давления или удельного объёма. Связано
с изменением потенциальной составляющей
внутренней энергии реального газа.
Теплоёмкости смесей идеальных газов
При расчётах
тепловых установок обычно встречаемся
со смесями газов, а в таблицах теплоёмкости
приводятся только для отдельных идеальных
газов
![]() нужно научиться определять теплоёмкости
газовой смеси. Здесь, как и для определения
R(удельная
газовая постоянная) возможно несколько
вариантов:
нужно научиться определять теплоёмкости
газовой смеси. Здесь, как и для определения
R(удельная
газовая постоянная) возможно несколько
вариантов:
-
если газовая смесь задана массовыми долями, то удельная теплоёмкость смеси определяется как сумма произведений массовых долей на удельную теплоёмкость каждого газа:
![]()
![]() ,
,
(где
![]() ,
,
![]() ,
,
![]() -
массовые доли каждого газа, входящего
в смесь).
-
массовые доли каждого газа, входящего
в смесь).
-
если газовая смесь задана объёмными долями, то объёмная теплоёмкость смеси равна сумме произведений объёмных долей на объёмную теплоёмкость каждого газа:
![]()
![]()
3) молярная теплоёмкость смеси газов равна сумме произведений объёмных долеё на молярные теплоёмкости, составляющих смесь газов:
![]()
![]()
-
удельная теплоёмкость смеси газов может быть определена, если известны плотность и удельный объём смеси газов при нормальных физических условиях:
![]()
![]()
Энтропия
Аналитически энтропия определяется следующим образом:
![]()
Удельная энтропия есть однозначная функция состояния газа, принимающая для каждого состояния вполне определённое значение. Удельная энтропия является экстенсивным параметром (т. е. зависит от массы вещества) состояния, её изменение полностью определяется крайними состояниями тела и не зависит от пути процесса.
Удельная энтропия обладает свойствами аддитивности, т. е. изменение энтропии системы, состоящей из отдельных тел, равна алгебраической сумме изменений энтропии этих тел.
![]()
Эти равенства содержат только параметры состояния и называются ТД тождествами, относятся к обратимым процессам.
В термодинамике внутренняя энергия, энтальпия, энтропия, теплоёмкости называются калорическими свойствами вещества; а удельный объём, абсолютное давление, температура – термическими свойствами.
