
- •Учебно-методическое пособие для самоподготовки и самостоятельной работы студентов по курсу «техническая термодинамика и теплотехника»
- •Тема 1. Основные термодинамические параметры Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Задачи для самостоятельного решения:
- •Рекомендуемая литература:
- •Определение основных термодинамических Параметров
- •Тема 2. Основные законы идеальных газов Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Задачи для самостоятельного решения:
- •Краткие теоретические положения по теме:
- •Тема 3. Основные свойства газовых смесей Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Задачи для самостоятельного решения:
- •Рекомендуемая литература:
- •Краткие теоретические положения по теме:
- •Тема 4. Реальные газы Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Краткие теоретические положения по теме:
- •Тема 5. Первый закон термодинамики Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Задачи для самостоятельного решения:
- •Техническая термодинамика и теплотехника: учеб.Пособие для вузов/ л.Т. Бахшиева, б.П. Кондауров, а.А. Захаров, в.С. Салтыкова; под ред. А.А. Захаровой. – м.: «Академия», 2006 – с.48 – 52
- •Мазур л.С. Техническая термодинамика и теплотехника: Учебник. – м.: гэотар-мед, 2003. – с.16-18, 28-30
- •Тема 6. Теплоемкость газов
- •Рекомендуемая литература:
- •Тема 7. Основные газовые процессы Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Задачи для самостоятельного решения:
- •Рекомендуемая литература:
- •Мазур л.С. Техническая термодинамика и теплотехника: Учебник. – м.: гэотар-мед, 2003. – с.18-28
- •Изотермическое сжатие воздуха
- •Экспериментальная часть
- •Обработка результатов измерений
- •Построение уравнения состояния воздуха
- •Тема 8. Теорема карно. Эксергия. Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Задачи для самостоятельного решения:
- •Рекомендуемая литература:
- •Техническая термодинамика и теплотехника: учеб.Пособие для вузов/ л.Т. Бахшиева, б.П. Кондауров, а.А. Захаров, в.С. Салтыкова; под ред. А.А. Захаровой. – м.: «Академия», 2006 – с.145 -153
- •Мазур л.С. Техническая термодинамика и теплотехника: Учебник. – м.: гэотар-мед, 2003. – с.41-53, 63-66, 155-160 Краткие теоретические положения по теме:
- •Тема 9. Применение термодинамических таблиц и диаграмм для решения инженерных задач Вопросы для самостоятельного изучения:
- •Основные расчетные соотношения, законы, положения по теме:
- •Задачи для самостоятельного решения:
- •Краткие теоретические положения по теме:
- •Средства измерения температуры
- •Общие сведения о температурных шкалах
- •Термометры стеклянные жидкостные
- •Введение поправок к показаниям термометра.
- •Термоэлектрические измерители температуры (термопары)
- •Средства измерения давления
- •Жидкостные манометры
Тема 5. Первый закон термодинамики Вопросы для самостоятельного изучения:
-
Внутренняя энергия идеальных и реальных газов. От каких параметров состояния она зависит?
-
Графическое изображение работы расширения и сжатия на pv-диаграмме
-
Обратимые и необратимые процессы. Их графическое изображение
-
Энтальпия и ее физический смысл
Основные расчетные соотношения, законы, положения по теме:
-
N=
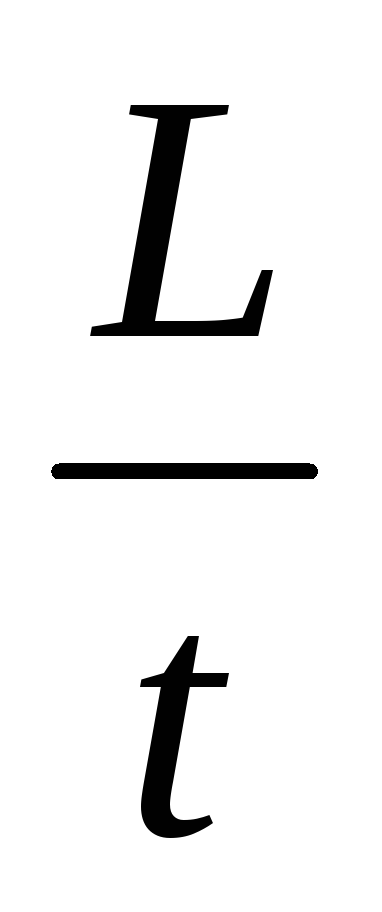 [Дж/с]
[Дж/с] -
1 киловатт-час = 3,6
 Дж
= 3,6
Дж
= 3,6 кДж
кДж -

-
q =
 U
+ pdv
U
+ pdv -
q = l
-
l = mgh
-
l = (
 )mg
)mg
Задачи для самостоятельного решения:
-
Определить внутреннюю энергию кислорода при температуре 0 0С, если его энтальпия при этих условиях равна нулю.
-
Определить изменение внутренней энергии 1 м3 кислорода, если его температура понизится с 250С до 5 0С.
-
На какую высоту можно поднять гирю массой 1 кг, если бы для этой цели удалось использовать 50% от количества теплоты, выделившейся в результате сгорания одной спички? Массу спички принять равной 1 г и теплоту сгорания дерева 16000 кДж/кг.
-
Какую скорость движения должна иметь свинцовая пуля, чтобы расплавиться при ударе об абсолютно твердое препятствие? Принять температуру пули в момент удара 57 0С, теплоемкость свинца 0,125 кДж/(кг К), теплоту плавления 21 кДж/кг, теплоту плавления 327 0С.
-
Вода в количестве 5л нагревается опущенным в нее электрокипятильником мощностью 600 Вт. За какое время вода нагреется до кипения, если ее начальная температура 30 0С? Предположить, что потери теплоты в воздух отсутствуют.
Рекомендуемая литература:
-
Техническая термодинамика и теплотехника: учеб.Пособие для вузов/ л.Т. Бахшиева, б.П. Кондауров, а.А. Захаров, в.С. Салтыкова; под ред. А.А. Захаровой. – м.: «Академия», 2006 – с.48 – 52
-
Мазур л.С. Техническая термодинамика и теплотехника: Учебник. – м.: гэотар-мед, 2003. – с.16-18, 28-30
Тема 6. Теплоемкость газов
Вопросы для самостоятельного изучения:
-
Понятия удельной теплоемкости, удельной массовой, объемной, молярной теплоемкости и их связь.
-
Понятие средней и истинной теплоемкости
-
Теплоемкость при постоянном объеме и постоянном давлении
-
Уравнение Майера и выводы из него
-
Уравнения удельной, объемной и молярной теплоемкости для газовых смесей
-
Энтропия. Приращение энтропии идеальных газов
Основные расчетные соотношения, законы, положения по теме:
Удельная теплоемкость:
![]() ;
;
Удельная массовая
теплоемкость:
![]()
Объемная теплоемкость:
![]()
Молярная теплоемкость:
![]()
Связь удельных
теплоемкостей:
![]()
Средняя теплоемкость в интервале температур от t1 до t2:
Уравнение Майера:
![]()
![]() ;
для одноатомных газов
;
для одноатомных газов
![]() =1,66;
=1,66;
для двухатомных
![]() =1,4;
для трех- и многоатомных
=1,4;
для трех- и многоатомных
![]() =1,33;
=1,33;
Задачи для самостоятельного решения:
-
Какое количество теплоты необходимо подвести к углекислому газу в закрытом сосуде объемом 0,1 м3, если начальная температура 200С, давление 100 КПа, конечная температура 3000С. Определить также массу воздуха и конечное давление.
-
Вычислить среднюю мольную теплоемкость для воздуха при постоянном давлении в интервале температур 500 – 700 0С, считая зависимость теплоемкости от температуры нелинейной.
-
Найти количество теплоты, необходимое для нагрева 5 м3 газовой смеси следующего объемного состава: кислорода – 5%, азота – 45%, углекислого газа – 50% при нагреве смеси от 20 0С до 200 0С при постоянном давлении.
-
При постоянной теплоемкости ср определить изменение энтропии 2 кг воздуха в процессе расширения, если начальные параметры t1= 250C , Р1= 1 атм.; конечные параметры: t2= 1250C, P2=1000 КПа.
