
- •І. Програма курсу
- •Тема 1. Основні поняття хімії
- •Тема 2. Будова атомів. Періодичний закон і періодична система д.І. Менделєєва
- •Тема 3. Хімічний зв’язок і будова молекул. Твердий стан речовин
- •Тема 4. Елементи хімічної термодинаміки
- •Тема 5. Хімічна кінетика та хімічна рівновага
- •Тема 6. Загальні властивості розчинів. Розчини електролітів
- •Тема 7. Окисно-відновні реакції
- •Тема 8. Електрохімічні процеси
- •Тема 9. Хімічні властивості металів
- •Іі. Контрольні задачі Загальні вказівки
- •1. Основні поняття хімії Короткі теоретичні відомості
- •2. Будова атомів. Періодичний закон та періодична система хімічних елементів д.І. Менделєєва Короткі теоретичні відомості
- •3. Хімічний зв’язок і будова молекул Короткі теоретичні відомості
- •4. Елементи хімічної термодинаміки Короткі теоретичні відомості
- •5. Хімічна кінетика та хімічна рівновага Короткі теоретичні відомості
- •6. Розчини. Способи вираження концентрацій. Фізичні властивості розведених розчинів неелектролітів Короткі теоретичні відомості
- •7. Розчини електролітів. Електролітична дисоціація сильних і слабких електролітів. Закон роЗбавляння. Водневий показник Короткі теоретичні відомості
- •8. Реакції обміну в розчинах електролітів. Іонно-молекулярні рівняння хімічних реакцій Короткі теоретичні відомості
- •9. Окисно-відновні реакції. Хімічні властивості металів Короткі теоретичні відомості
- •10. Електрохімічні процеси. Гальванічні елементи Короткі теоретичні відомості
- •11. Електрохімічна корозія металів і сплавів Короткі теоретичні відомості
- •12. Електроліз Короткі теоретичні відомості
- •Кількісні розрахунки електролізу треба виконувати згідно з законом Фарадея:
- •Ііі. Лабораторні роботи Лабораторна робота №1 Класи неорганічних сполук
- •Ознакою перебігу хімічної реакції є утворення або розчинення осаду.
- •Лабораторна робота №2 Теплові ефекти процесів
- •Порядок виконання роботи
- •Обробка результатів
- •Лабораторна робота №3 Хімічна кінетика
- •Лабораторна робота №4 Розчини електролітів
- •1. Одержання та дослідження особливостей слабких електролітів
- •2. Визначення рН контрольного розчину електроліту
- •Лабораторна робота №5 Електрохімічні процеси
- •1. Мідно-цинковий гальванічний елемент
- •2. Контактна корозія
- •3. Електроліз
- •Лабораторна робота №6 Окисно-відновні реакції
- •1. Окисні властивості сульфатної кислоти.
- •2. Окисні властивості іонів металу.
- •3. Окисно-відновна двоїстість пероксиду гідрогену
- •IV. Додатки
- •Список рекомендованої літератури
3. Хімічний зв’язок і будова молекул Короткі теоретичні відомості
З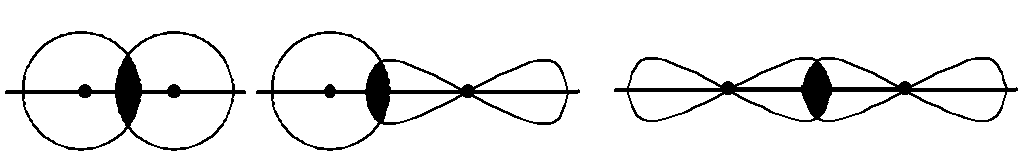 усіх типів хімічного зв’язку в молекулах
найбільш поширеним є ковалентний
зв’язок,
який утворюється внаслідок перекривання
АО з неспареними електронами взаємодіючих
атомів. У першу чергу виникає так званий
-зв’язок,
коли АО перекриваються вздовж прямої
лінії
лінії зв’язку, що з’єднує ядра
взаємодіючих атомів:
усіх типів хімічного зв’язку в молекулах
найбільш поширеним є ковалентний
зв’язок,
який утворюється внаслідок перекривання
АО з неспареними електронами взаємодіючих
атомів. У першу чергу виникає так званий
-зв’язок,
коли АО перекриваються вздовж прямої
лінії
лінії зв’язку, що з’єднує ядра
взаємодіючих атомів:
s s s p p p
Деякі молекули мають дві області перекривання атомних орбіталей, які знаходяться над і під площиною, де знаходяться ядра взаємодіючих атомів та -зв’язки, таким чином додатково виникає так званий -зв’язок:
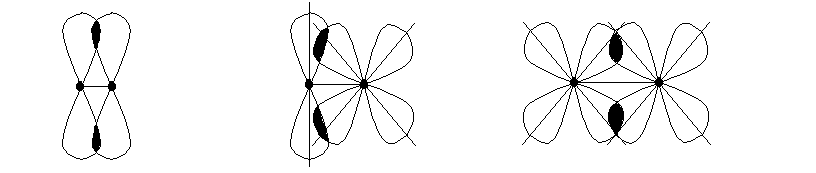
p р p – d d – d
Усі -зв’язки багатовалентного атома однакові, тобто цей атом має на АО однотипні валентні електрони. У випадку різнотипних валентних електронів відбувається гібридизація відповідних електронних орбіталей. Гібридні орбіталі мають лише таку форму:
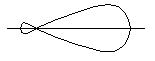
Розглянемо
основні типи гібридизації АО. Якщо атом
двохвалентного елемента має валентні
електрони ns2np![]() p
p![]() або ns2np
або ns2np![]() p
p![]() p
p![]() ,
тобто якщо два неспарені електрони
розташовані на орбіталях одного типу
(р),
гібридизація відсутня. Молекула у цьому
випадку кутова, значення валентного
кута дорівнює 90
і співпадає з розташуванням р-орбіталей
у просторі. Якщо ж атом
має
у збудженому стані ns
,
тобто якщо два неспарені електрони
розташовані на орбіталях одного типу
(р),
гібридизація відсутня. Молекула у цьому
випадку кутова, значення валентного
кута дорівнює 90
і співпадає з розташуванням р-орбіталей
у просторі. Якщо ж атом
має
у збудженому стані ns![]() np
np![]() -валентні
електрони, то вихідні АО – різних типів,
тому відбувається sp-гібридизація.
Треба знати, що гібридні АО розташовуються
у просторі під максимальними кутами
одна до іншої; у цьому випадку – під
кутом 180.
Отже, молекула лінійна.
-валентні
електрони, то вихідні АО – різних типів,
тому відбувається sp-гібридизація.
Треба знати, що гібридні АО розташовуються
у просторі під максимальними кутами
одна до іншої; у цьому випадку – під
кутом 180.
Отже, молекула лінійна.
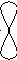
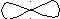
90
гібридизація відсутня sp-гібридизація
Для
атомів трьохвалентних елементів з
неспареними електронами, розташованими
на ns
![]() np
np![]() p
p![]() p
p![]() -підрівнях
(нормальний стан) або ns
-підрівнях
(нормальний стан) або ns
![]() np
np![]() p
p![]() -підрівнях (збуджений стан іншого атома),
не відбувається ніякої гібридизації у
першому випадку, тому що вихідні АО
однотипні, та відбувається sp2-гібридизація
АО у другому випадку. Отже, перша молекула
має геометричну форму тригранної
піраміди з валентним кутом 90
у вершині, тому що р-орбіталі
розташовані у просторі під цим кутом
одна до іншої. Друга молекула являє
собою рівносторонній трикутник, тому
що максимальний кут між трьома
гібридизованими орбіталями дорівнює
120:
-підрівнях (збуджений стан іншого атома),
не відбувається ніякої гібридизації у
першому випадку, тому що вихідні АО
однотипні, та відбувається sp2-гібридизація
АО у другому випадку. Отже, перша молекула
має геометричну форму тригранної
піраміди з валентним кутом 90
у вершині, тому що р-орбіталі
розташовані у просторі під цим кутом
одна до іншої. Друга молекула являє
собою рівносторонній трикутник, тому
що максимальний кут між трьома
гібридизованими орбіталями дорівнює
120:
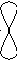

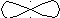
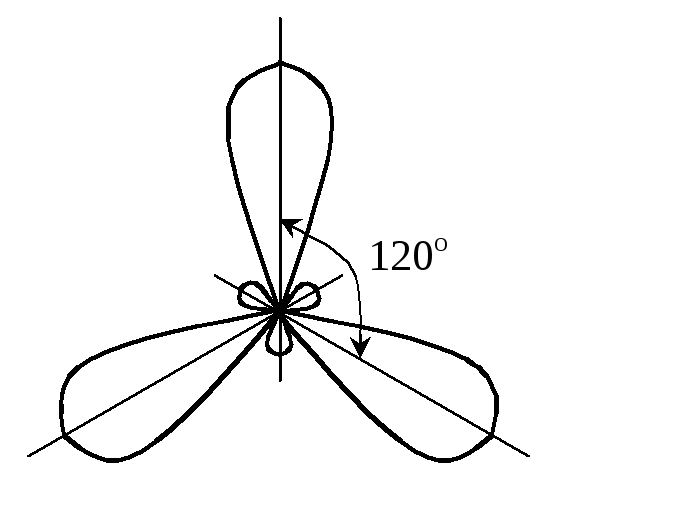
90
гібридизація відсутня sp2-гібридизація
Для
атома чотирьохвалентного елемента, в
якого валентні електрони у збудженому
стані знаходяться на ns![]() np
np![]() p
p![]() p
p![]() -підрівнях,
наявні sp3-гібридизація
ао
та тетраедрична форма молекули з
валентним кутом 10928
(
109,5):
-підрівнях,
наявні sp3-гібридизація
ао
та тетраедрична форма молекули з
валентним кутом 10928
(
109,5):
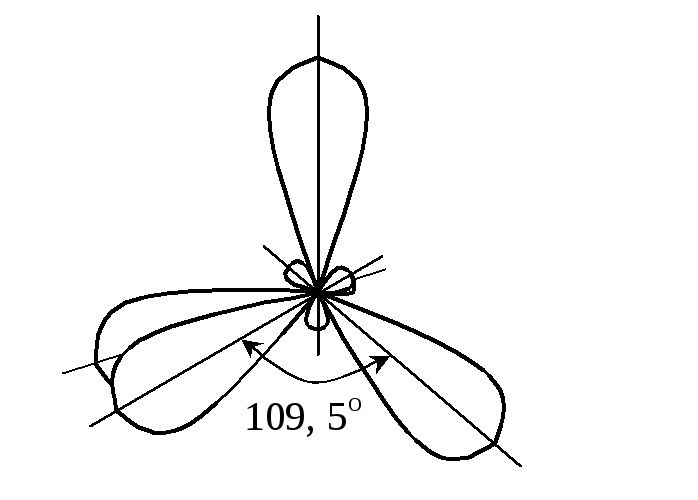
sp3-гібридизація
При розв’язанні задач цього розділу потрібно розуміти різницю між полярністю зв’язку та полярністю молекули у цілому. Полярність зв’язку пов’язана з наявністю ефективних (реальних) зарядів () на атомах після утворення ковалентного зв’язку. Найпростіше вона оцінюється за різницею електронегативностей атомів (ЕН, або , див. додаток, табл.1). Якщо ця різниця (ЕН) менша за 1,9, утворюється ковалентний полярний зв’язок, наприклад:
С![]()
Н
Н![]() , С
, С![]() –
Cl
–
Cl![]() , C0
S0
, C0
S0
ЕН 0,4 0,5 0
полярні зв’язки неполярний зв’язок
При
![]() ЕН
> 1,9 утворюється іонний
зв’язок, який можна розглядати як
граничний варіант ковалентного полярного
зв’язку.
ЕН
> 1,9 утворюється іонний
зв’язок, який можна розглядати як
граничний варіант ковалентного полярного
зв’язку.
При наявності полярних зв’язків молекула у залежності від її будови може бути як полярною, так і неполярною. Якщо центри всіх позитивних і негативних зарядів співпадають у просторі, молекула неполярна; якщо не співпадають – молекула полярна. Так, молекули типу АВ2 трикутної форми полярні, молекули типу АВ2 лінійної форми неполярні.
Задачі
-
Поясніть, чому молекула BF3 плоска, а NF3 пірамідальна. Відповідь дайте на підставі схем перекривання атомних орбіталей у молекулах цих речовин. Яка з цих молекул полярна і чому?
-
На підставі схем перекривання атомних орбіталей поясніть, чому в молекулах Н2О та NН3 валентні кути Н Е Н дорівнюють, відповідно, 104,5 і 107.
-
Який ковалентний зв’язок називають -зв’язком і який -зв’язком? Відповідь дайте на підставі схем перекривання АО у молекулах азоту й ацетилену.
-
Який хімічний зв’язок називається водневим? Між молекулами яких речовин він утворюється? Чому Н2О і НF, що мають меншу молекулярну масу, плавляться та киплять при більш високих температурах, ніж Н2S і Н2Se; HCl і HBr?
-
Що називають електричним моментом диполя? Яка з молекул HCl, HBr, НІ має найбільший момент диполя? Чому?
-
Що є кількісною мірою полярності ковалентного зв’язку? Аналізуючи схеми перекривання атомних орбіталей у молекулах Сl2, Н2О, ВеСl2, визначте, які з них є диполями.
-
Що таке електронегативність? Як змінюється характер хімічного зв’язку в оксидах у ряді: Li2O BeO B2O3 CO2 V2O5 Cl2O7? Дайте пояснення.
-
Наведіть схеми перекривання атомних орбіталей у молекулах Сl2, N2 і СН4. Чим пояснюється особлива міцність молекули азоту? Дайте визначення поняттю міцності зв’язку, або енергії зв’язку.
-
Молекули Н2О і CO2 кожна містять по два полярних зв’язки (Н О Н і О = С = О). Чому молекула CO2 неполярна, а молекула води полярна? Відповідь дайте на підставі схем перекривання АО у цих молекулах та їх аналізу.
-
Наведіть електронні формули атома Сульфуру в нормальному або збудженому станах у молекулах Н2S, SСl2, SСl4, SСl6. Вкажіть тип гібридизації АО Сульфуру у відповідних молекулах. Які дві з них мають однакові геометричні (просторові) конфігурації? Наведіть схеми перекривання АО в цих молекулах.
-
Що розуміють під гібридизацією атомних орбіталей? Встановіть тип гібридизації АО центрального атома та форму наведених частинок: NН3, NН4+, SiF4, CO2, CO32 (усі три зв’язки С О рівноцінні та розташовані під кутом 120). Врахуйте, що в гібридизації можуть брати участь d-атомні орбіталі.
-
Що розуміють під гібридизацією атомних орбіталей? Встановіть тип гібридизації АО центрального атома та форму наведених частинок: РF5, SF6, SiF4, NF3, NН4+ (усі чотири зв’язки N H рівноцінні та розташовані під кутом 10928). Врахуйте, що у гібридизації можуть брати участь d-атомні орбіталі.
-
У чому відмінність -зв’язку від -зв’язку? Як він утворюється? Чи є енергетично рівноцінними ці види зв’язку? Відповідь поясніть на прикладі схем перекривання АО в молекулах С2Н4 і С2Н2.
-
Дайте визначення поняттю електричного моменту диполя. Яка з молекул BF3, NF3 чи РF3 має нульове значення цієї величини? Відповідь дайте на підставі схем перекривання АО у молекулах та їх аналізу.
-
Дайте визначення поняттю насиченості ковалентного зв’язку. Відповідь поясніть на прикладі молекул СО і СН4. Наведіть схеми перекривання АО в цих молекулах.
-
Поясніть поняття напрямленості хімічного зв’язку в молекулах з точки зору методу валентних зв’язків. Відповідь проілюструйте на прикладах схем перекривання АО у молекулах ВеСl2 і SСl2.
-
Які типи хімічного зв’язку Ви знаєте? Як змінюється характер хімічного зв’язку в ряді: NaCl MgCl2 AlCl3 SiCl4 PCl5 SCl2 Cl2? Чому?
-
Поясніть, що таке - та -зв’язки? На підставі структурних формул вкажіть, скільки - та -зв’язків містять молекули: SF6, СCl4, SО3, PCl5, PОCl3, С2Н4, С2Н2, СОCl2, SО2Cl2. Наведіть схеми перекривання АО в молекулі СCl4. Який тип гібридизації АО Карбону в цій молекулі?
-
Який ковалентний зв’язок називають полярним, а який неполярним? Чи завжди при наявності полярних зв’язків молекула теж полярна? Відповідь поясніть на прикладах схем перекривання АО в молекулах SnСl2 і SnСl4 та їх аналізу.
-
Що називають гібридизацією атомних орбіталей? Наведіть приклади молекул з sp-, sp2- i sp3-гібридизацією АО центрального атома. Які з цих молекул полярні?
-
Який тип гібридизації АО центрального атома у молекулах: BeH2, SiH4, CS2, BBr3? Наведіть схеми перекривання АО в молекулах BeH2 і SiH4. Чому обидві молекули неполярні?
-
Складіть електронні формули атомів і наведіть схеми перекривання АО в молекулах ІnCl та InCl3. В якій з молекул відбувається гібридизація АО Індію? Вкажіть тип гібридизації та зробіть висновок про полярність молекул.
-
Яку геометричну форму можуть мати трьохатомні молекули типу АВ2? Розгляньте це на прикладі молекул BeCl2, ZnBr2, CO2, H2O. Які з них полярні і чому?
-
Чому однотипні за атомним складом молекули CO2 і SO2, BCl3 i PCl3 мають різну геометричну конфігурацію? Наведіть приклади перекривання АО в молекулах BCl3 i PCl3. Яка з них полярна і чому?
-
Наведіть схеми перекривання АО в молекулах O2 і H2O. Вкажіть типи гібридизації АО Оксигену, число - та -зв’язків, полярність зв’язків і наявність полярності для кожної молекули.
