
- •І. Програма курсу
- •Тема 1. Основні поняття хімії
- •Тема 2. Будова атомів. Періодичний закон і періодична система д.І. Менделєєва
- •Тема 3. Хімічний зв’язок і будова молекул. Твердий стан речовин
- •Тема 4. Елементи хімічної термодинаміки
- •Тема 5. Хімічна кінетика та хімічна рівновага
- •Тема 6. Загальні властивості розчинів. Розчини електролітів
- •Тема 7. Окисно-відновні реакції
- •Тема 8. Електрохімічні процеси
- •Тема 9. Хімічні властивості металів
- •Іі. Контрольні задачі Загальні вказівки
- •1. Основні поняття хімії Короткі теоретичні відомості
- •2. Будова атомів. Періодичний закон та періодична система хімічних елементів д.І. Менделєєва Короткі теоретичні відомості
- •3. Хімічний зв’язок і будова молекул Короткі теоретичні відомості
- •4. Елементи хімічної термодинаміки Короткі теоретичні відомості
- •5. Хімічна кінетика та хімічна рівновага Короткі теоретичні відомості
- •6. Розчини. Способи вираження концентрацій. Фізичні властивості розведених розчинів неелектролітів Короткі теоретичні відомості
- •7. Розчини електролітів. Електролітична дисоціація сильних і слабких електролітів. Закон роЗбавляння. Водневий показник Короткі теоретичні відомості
- •8. Реакції обміну в розчинах електролітів. Іонно-молекулярні рівняння хімічних реакцій Короткі теоретичні відомості
- •9. Окисно-відновні реакції. Хімічні властивості металів Короткі теоретичні відомості
- •10. Електрохімічні процеси. Гальванічні елементи Короткі теоретичні відомості
- •11. Електрохімічна корозія металів і сплавів Короткі теоретичні відомості
- •12. Електроліз Короткі теоретичні відомості
- •Кількісні розрахунки електролізу треба виконувати згідно з законом Фарадея:
- •Ііі. Лабораторні роботи Лабораторна робота №1 Класи неорганічних сполук
- •Ознакою перебігу хімічної реакції є утворення або розчинення осаду.
- •Лабораторна робота №2 Теплові ефекти процесів
- •Порядок виконання роботи
- •Обробка результатів
- •Лабораторна робота №3 Хімічна кінетика
- •Лабораторна робота №4 Розчини електролітів
- •1. Одержання та дослідження особливостей слабких електролітів
- •2. Визначення рН контрольного розчину електроліту
- •Лабораторна робота №5 Електрохімічні процеси
- •1. Мідно-цинковий гальванічний елемент
- •2. Контактна корозія
- •3. Електроліз
- •Лабораторна робота №6 Окисно-відновні реакції
- •1. Окисні властивості сульфатної кислоти.
- •2. Окисні властивості іонів металу.
- •3. Окисно-відновна двоїстість пероксиду гідрогену
- •IV. Додатки
- •Список рекомендованої літератури
11. Електрохімічна корозія металів і сплавів Короткі теоретичні відомості
Корозія, тобто процес руйнування поверхні металевих виробів у результаті самодовільної фізичної та хімічної взаємодії з навколишнім середовищем, дуже часто має електрохімічний характер.
Якщо два різні метали перебувають у контакті (покриття, клепка, сплав, тощо), то виконуються всі три умови для виникнення та роботи гальванічного елемента: дві різні електрохімічні системи, замкнутість зовнішнього та внутрішнього кіл. Однак утворений гальванічний елемент суттєво відрізняється від звичайного як схемою, так і електродними процесами. Замість двох спеціально підібраних електролітів (розчини солей відповідних металів) наявний лише один – електроліт корозійного середовища, тобто електроліт середовища експлуатації виробу. Це може бути вологе повітря, яке містить кислі гази СО2, SO2, H2S або не містіть їх, а також кислі чи нейтральні водні розчини, які не містять кисню.
Первинний процес на аноді у таких елементах не відрізняється від процесу в звичайному гальванічному елементі – відбувається окиснення металу з меншим значенням електродного потенціалу, тобто його корозія.
Наприклад, у випадку оцинкованого заліза при механічному порушенні цілісності покриття починає кородувати цинк (анодне покриття) як метал з меншим значенням електродного потенціалу:
А(): Zn0 2e = Zn2+.
На катоді (у нашому випадку це залізо) із електроліту корозійного середовища має відновлюватись речовина з найбільшим потенціалом. Це може бути кисень повітря, іони Гідрогену кислот або води. При цьому потрібно пам’ятати що:
![]() =
0,059рН
=
0,059рН
![]() =
1,23
0,059рН.
=
1,23
0,059рН.
Потенціали цих окисників для різних за кислотністю середовищ такі:
-
рН
0
7
14
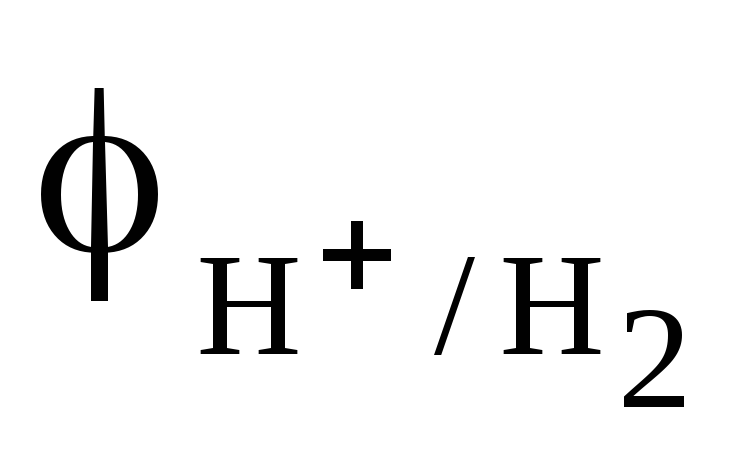 ,
В
,
В0
0,41
0,82
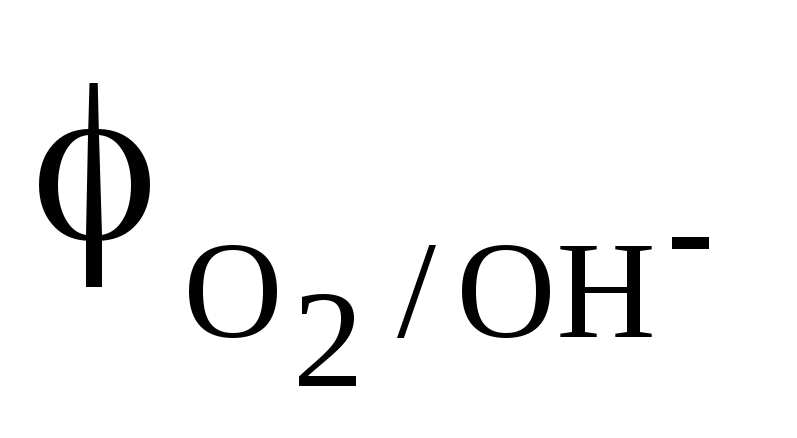 ,
В
,
В1,23
+0,82
+0,41
Для наведеного прикладу катодні процеси можуть бути:
К(+): O2 + 4e + 2H2O = 4OH у вологому середовищі,
К(+): O2 + 4e + 4Н+ = 2Н2О у кислому середовищі, яке містить повітря,
К(+): 2Н+ + 2е = H2 у кислому середовищі без кисню або без повітря,
К(+): 2H2O + 2е = H2 + 2OH у нейтральному середовищі без кисню або без повітря.
Загальна схема корозійного гальванічного елемента (т.з. корозійної пари):
Ме анод | електроліт | Ме катод.
Схема корозійної пари для оцинкованого заліза у кислому середовищі, яке містить повітря:
Zn | H2O, O2, H+ | Fe.
Задачі
В усіх наведених нижче задачах з електрохімічної корозії металів у відповідях обов’язково треба навести схеми корозійних пар і електронні рівняння анодного та катодного процесів.
-
Як відбувається атмосферна корозія лудженого (покритого оловом) і оцинкованого заліза при порушенні цілісності покриття?
-
У чому полягає сутність протекторного захисту металів від корозії? Наведіть приклад захисту нікелю в електроліті, що містить розчинений кисень.
Яке металеве покриття називається анодним і яке – катодним? Наведіть приклади металів, що можуть виступати в якості анодних і катодних покриттів для вказаного нижче металу, що знаходиться: а) у вологому повітрі; б) у сильнокислому знекисненому середовищі. Наведіть по одному прикладу повних характеристик корозійних пар різних типів.
-
Al.
-
Ni.
-
Fe.
-
Cr.
-
Со.
-
Чому хімічно чисте залізо більш стійке до корозії, ніж технічне залізо? Наведіть повні характеристики корозійних пар, які працюють при наявності корозії технічного заліза: а) у вологому ґрунті, що містить повітря; б) у вологому повітрі.
-
Чому руйнацію металу, що відбувається у природних умовах – на повітрі, у вологому ґрунті та воді, називають електрохімічною корозією? Опишіть процес електрохімічної корозії залізного виробу, покритого тонким шаром хрому при порушенні цілісності покриття, який знаходиться: а) у кислому електроліті, що не містить повітря; б) у нейтральному електроліті (рН = 7), що містить повітря.
-
Чому руйнацію металу, що відбувається у природних умовах – на повітрі, у вологому ґрунті та воді, називають електрохімічною корозією? Опишіть процес електрохімічної корозії залізного виробу, покритого тонким шаром нікелю при порушенні цілісності покриття, який знаходиться: а) в умовах морського клімату; б) у нейтральному електроліті (рН = 7), що не містить повітря.
-
Алюміній склепано з міддю. Який з металів буде руйнуватися, якщо ці метали знаходяться: а) у вологому повітрі; б) у кисневмісному електроліті з рН 7? Наведіть повні характеристики утворених корозійних пар.
-
Залізо склепано з міддю. Який з металів буде руйнуватися, якщо ці метали знаходяться: а) у вологому повітрі, яке містить кислі гази СО2, SO2, б) у кисневмісному електроліті з рН = 7? Наведіть повні характеристики утворених корозійних пар.
Сплави металів часто являють собою так звані механічні суміші, коли мікрозерна одного металу знаходяться у тісному контакті з мікрозернами іншого металу. Наведіть повні характеристики мікрогальванічних пар, утворених на поверхні наведених нижче сплавів у вказаних струмопровідних електролітах.
-
Монель-метал (70 мас. % Cu, 30 мас. % Ni), кисневмісний електроліт;
а) рН 7;
б) рН = 7.
-
Магналій (20 мас. % Mg, 80 мас. % Al);
а) вологе повітря;
б) слабокислі аеровані ґрунти.
-
Монетний сплав (Cu i 38-45 мас. % Zn);
а) кислий (рН 7) безповітряний електроліт;
б) нейтральний (рН = 7) безповітряний електроліт.
-
Дюралюміній (93-95 мас. % Al, 3,5-5,5 мас. % Cu, домішки Mn, Mg);
а) вологе повітря, що містить SO2, CO2, H2S;
б) нейтральний (рН = 7) безповітряний електроліт.
-
Бронза (90 мас. % Cu, 10 мас. % Sn);
а) вологе повітря;
б) аерований ґрунт (рН = 5).
-
Константан (60 мас. % Cu, 40 мас. % Ni);
а) H2O, HCl, O2;
б) H2O, O2.
-
Ніхром (60 мас. % Ni, 40 мас. % Cr);
а) кислий (рН 7) безповітряний електроліт;
б) вологе повітря.
-
Електрон (80 мас. % Mg, 20 мас. % Zn);
а) кисневмісний електроліт (рН = 7);
б) електроліт (рН = 7), що не містить кисню.
-
Антифрикційний сплав для заливки підшипників (99 мас. % Pb, 1 мас. % Ca);
а) вологе повітря;
б) безповітряне струмопровідне середовище.
-
Латунь (сплав міді з цинком);
а) кислі аеровані ґрунти;
б) вологе повітря.
-
Нержавіюча сталь являє собою сплав заліза з 8 мас. % нікелю та 18 мас. хрому. Опишіть процеси електрохімічної корозії, що відбуваються на поверхні виробу з нержавіючої сталі в атмосферному повітрі промислового району (вологе повітря містить SO2, CO2, H2S тощо).
-
Опишіть процес електрохімічної корозії сталевого виробу у вологому повітрі та в аерованому кислому ґрунті. При цьому треба врахувати, що на поверхні заліза є ділянки, заповнені карбідом заліза Fe3C (цементитом), які виконують роль катода у мікрокорозійних порах.
-
Дві залізні пластини, одна з яких частково покрита оловом, а інша – міддю, знаходяться у вологому повітрі. На якій пластині швидше з’явиться ржа і чому? Наведіть повні характеристики утворених корозійних пар.
