
- •3.Абсолютная и относительная истина
- •6. Понятие о структурных уровнях организации материи. Мегамир, макромир, микромир. Микро-, макро- и мегамиры.
- •Микромир.
- •Макромир.
- •Мегамир.
- •Равновесие твердого тела под действием трех сил
- •Силы, действующие на рычаг, и их моменты.
- •9. Законы сохранения количества движения ( импульса), энергии и момента количества движения.
- •11. Концептуальные представления о различиях в строении твердых, жидких и газообразных тел. Роль давления и температуры в агрегатных переходах.
- •12. Концепция атомизма от Демокрита до наших дней. Планетарная модель атома Резерфорда. Постулаты Бора.
- •Значение периодической системы
- •Сущность явления
- •[Править] Пересмотренная последовательность Хаббла
- •[Править] Сила и плотность тока
- •[Править] Мощность
- •27. Гипотезы происхождения жизни на Земле. Гипотезы о возникновении жизни
- •Теория стационарного состояния
- •Самозарождение жизни
12. Концепция атомизма от Демокрита до наших дней. Планетарная модель атома Резерфорда. Постулаты Бора.
Атомизм Демокрита лучше любой современной ему теории отвечал на вопросы своего времени. Это кульминация умственного движения, направленного на рациональное познание мира и начавшегося в Греции с деятельности ионийских натурфилософов. Атомизм основывался на результатах простых наблюдений и немногих экспериментах, его сила как теория - в максимальном соответствии этиv наблюдениям. Философия Демокрита прокладывала путь к будущей науке и философии. Самую правильную оценку античным мыслителям дал Ф. Энгельс: "Древнегреческие философы были все прирожденными стихийными диалектиками. Поэтому и теоретическое естествознание, если оно хочет проследить историю возникновения и развития своих общих положений, вынуждено обращаться к грекам". "... У античных натурфилософов, - пишет Г. Волков, - можно обнаружить зачатки почти всех основополагающих идей естествознания: мысль о единстве космоса и микрокосмоса, о человеке как космическом явлении, идеи единства пространства и времени, сохранения материи и энергии, принципа относительности, неопределенности, вероятности, генетической основы живых организмов... единства конечного и бесконечного, принцип симметрии мироздания, предположении о существовании фундаменте самого здания материи способности, схожей с ощущением. Эти идеи были потом восприняты и переработаны философией Нового времени... " Атомистическая теория строения материи легла в основу всего дальнейшего развития теоретического естествознания, о представлении неделимости атома было остановлено физикой только на пороге XX в., когда она получила в свое распоряжение новые мощные экспериментальные средства. Много раз возникали и теории происхождения жизни. В них подтвердилось мнение, высказанное Демокритом: живое возникает из неживого. В глубокой сущности живого, в молекуле ДНК кроется, как "на дне глубокого колодца", тайна жизни, которая (как у Демокрита) зависит от порядка расположения частиц - нуклеотидов. Сознание же неотделимо от материи, оно отражает мир - об этом говорил материалист Демокрит. Всеобъемлющие законы живой и неживой природы - закон сохранения материи и закон причинности - были открыты уже в античности на уровне простого наблюдения и лежали в основе философии Демокрита. В наше время они являются фундаментальными законами науки. Учение астрономии о бесконечности мирового пространства и бесконечных "мирах" во Вселенной выдвинул тоже Демокрит. Современная наука тесно сплелась в философией. Философия Демокрита - пройденная ступень в развитии знаний о мире и человеке. Однажды найденная истина развивается с глубокой древности до далекого будущего. Человечество опять исследует атомы вещества и атомы общества, перед каждой новой загадкой оно повторяет с Демокритом: "Истина - на дне глубокого колодца!"
Рассеяние отдельных α-частиц на большие углы Резерфорд объяснил тем, что положительный заряд в атоме не распределен равномерно в шаре радиусом 10-10м, как предполагали ранее, а сосредоточен в центральной части атома (атомном ядре) в области значительно меньших размеров. Расчеты Резерфорда показали, что для объяснения опытов по рассеянию α-частиц нужно принять радиус атомного ядра равным примерно 10-15м.
Р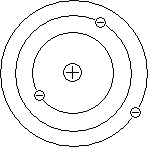 езерфорд
предположил, что атом устроен подобно
планетарной системе. Как вокруг Солнца
на больших расстояниях от него обращаются
планеты, так электроны в атоме обращаются
вокруг атомного ядра. Р
езерфорд
предположил, что атом устроен подобно
планетарной системе. Как вокруг Солнца
на больших расстояниях от него обращаются
планеты, так электроны в атоме обращаются
вокруг атомного ядра. Р адиус
круговой орбиты самого далекого от ядра
электрона и есть радиус атома. Такая
модель атома была названа планетарной
моделью.
адиус
круговой орбиты самого далекого от ядра
электрона и есть радиус атома. Такая
модель атома была названа планетарной
моделью.
Планетарная модель атома объясняет основные закономерности рассеяния заряженных частиц.
Так как большая часть пространства в атоме между атомным ядром и обращающимися вокруг него электронами пуста, быстро заряженные частицы могут почти свободно проникать через довольно значительные слои вещества, содержащие несколько тысяч слоев атомов.
При столкновениях с отдельными электронами быстрые заряженные частицы испытывают рассеяние на очень большие углы, так как масса электрона мала. Однако в тех редких случаях, когда быстрая заряженная частица пролетает на очень близком расстоянии от одного из атомных ядер, под действием силы электрического поля атомного ядра может произойти рассеяние заряженной частицы на любой угол до 180°.
Первый постулат Бора (постулат стационарных состояний):
в атоме существуют стационарные квантовые состояния, не изменяющиеся с течением времени без внешних воздействий.
В этих состояниях атом не излучает электромагнитных волн. Каждому стационарному состоянию соответствует определенная энергия атома Еп. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. При движении по стационарным орбитам электроны не излучают электромагнитных волн.
Второй постулат Бора (правило частот):
при переходе атома-из одного стационарного состояния в другое испускается или поглощается один фотон.
Атом излучает (поглощает) один квант электромагнитной энергии, когда электрон переходит с орбиты с большим (меньшим) на орбиту с меньшим (большим) главным квантовым числом. Из правила частот Бора следует обращение спектральных линий; атомы поглощают только те спектральные линии (частоты), которые они сами могут испускать. Правило частот Бора явилось дальнейшим развитием идеи о квантовом характере излучения и поглощения света;
Правило квантования орбит:
в стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные, квантованные значения момента импульса (момента количества движения); Спектр нагретого вещества в газообразном состоянии состоит из узких линий разного цвета. Такой спектр называется линейчатым спектром излучения. Для получения такого спектра используют дуговой или искровой разряд. Линейчатый спектр излучения у каждого химического элемеигга свой, не совпадающий со спектром другого химического элемента. Если белый свет проходит через вещество а газообразном состоянии, то на сплошном спектре излучения обнаруживаются темные линии. Эти лигами называются линейчатым спектром поглощения. Линии спектра поглощения расположены в тех местах спектра, в которых находятся линии спектра излучения данного химического элемента, когда вещество излучает свет. Исследование линейчатого спектра вещества позволяет определить, из каких химических элементов оно состоит и в каком количестве содержится каждый элемент в данном веществе. Количественное содержание элемента в исследуемом образце определяется путем сравнения интенсивности отдельных линий спектра этого элемента с интенсивностью линий другого химического элемента, количественное содержание которого в образце известно. Метод определения качественного и количественного состава вещества по его спектру называется спектральным анализом.
Спектральный анализ применяется при поисках полезных ископаемых для определения химического состава образцов руды. В промышленности спектральный анализ позволяет контролировать составы сплавов и примесей, вводимых в металлы для получения материалов с заданными свойствами. Достоинствами спектрального анализа являются высокая чувствительность и быстрота получения результатов.
С помощью спектрального анализа можно обнаружить в пробе присутствие золота; Определение марки стали методом спектрального анализа может быть выполнено за несколько десяткой секунд. Спектральный анализ позволяет определять химический состав небесных тел, удаленных от Земли ка расстояния в миллиарды световых лет. Химический состав атмосфер планет и звезд, холодного газа в межзвездном пространстве определяется по спектрам погло- щения.
14. Основные представления современной химии. Эволюционная химия.
15. Взаимосвязь атомно-молекулярного строения и химических свойств веществ. Периодическая таблица элементов Д.И. Менделеева.
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям.1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц. 4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов. Атомистическое учение в химии применил английский ученый Джон Дальтон. В своей основе учение Дальтона повторяет учение Ломоносова. Вместе с тем оно развивает его дальше, поскольку Дальтон впервые пытался установить атомные массы известных тогда элементов. Однако Дальтон отрицал существование молекул у простых веществ, что по сравнению с учением Ломоносова является шагом назад. По Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества — из «сложных атомов» (в современном понимании — молекул). Отрицание Дальтоном существования молекул простых веществ мешало дальнейшему развитию химии. Атомно-молекулярное учение в химии окончательно утвердилось лишь в- середине XIX в.Молекула — это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением. Атом — наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям: атом — это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов. Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру. Основные положения атомно-молекулярного учения можно сформулировать так:
-
Существуют вещества с молекулярным и немолекулярным строением.
-
Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
-
Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
-
Между молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей — в газах.
-
Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
-
Атомы одного вида отличаются от атомов другого вида массой и свойствами.
-
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.
-
У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решето находятся молекулы. Связи между молекулами, расположенными в узлах кристаллической решетки, слабые и при нагревании разрываются. Поэтому вещества с молекулярным строением, как правило, имеют низкие температуры плавления.
-
У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления.
Объяснение физических и химических явлений с точки зрения атомно-молекулярного учения. Физические и химические явления получают объяснение с позиций атомно-молекулярного учения. Так, например, процесс диффузии объясняется способность молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому, что молекулы (атомы, частицы) находятся в непрерывном движении и между ними имеются промежутки. Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен[1] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Распространённее других являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток.
Ниже приведён длинный вариант (длиннопериодная форма), утверждённый Международным союзом теоретической и прикладной химии (IUPAC) в качестве основного.
Короткая форма таблицы, содержащая восемь групп элементов[3], была официально отменена ИЮПАК в 1989 году. Несмотря на рекомендацию использовать длинную форму, короткая форма продолжает приводиться в большом числе российских справочников и пособий и после этого времени. Из современной иностранной литературы короткая форма исключена полностью, вместо неё используется длинная форма. Такую ситуацию некоторые исследователи связывают в том числе с кажущейся рациональной компактностью короткой формы таблицы, а также с инерцией, стереотипностью мышления и невосприятием современной (международной) информации[4].
В 1970 году Теодор Сиборг предложил расширенную периодическую таблицу элементов. Нильсом Бором разрабатывалась лестничная (пирамидальная) форма периодической системы. Существует и множество других, редко или вовсе не используемых, но весьма оригинальных, способов графического отображения Периодического закона[5][6]. Сегодня существуют несколько сотен вариантов таблицы, при этом учёные предлагают всё новые варианты[7].
