
- •7) Теория электролитической диссоциации
- •9) Правила написания уравнений реакций в ионном виде
- •10) По химическим свойствам оксиды подразделяют на следующие типы:
- •13) Классификация и свойства солей
- •25) Серная кислота - h2so4
- •28) Оксиды азота
- •35) Основные положения теории химического строения а.М. Бутлерова
- •47) Получение предельных одноатомных спиртов
- •50) Альдегиды
- •52) Карбоновые кислоты
- •55) Сложные эфиры
- •57) Углеводы
35) Основные положения теории химического строения а.М. Бутлерова
1. Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
2. Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы).
3. Свойства веществ зависят от их химического строения.
4. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства.
5. Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
Понятие о изомерии
Еще до создания теории строения были известны вещества одинакового элементного состава, но c разными свойствами. Такие вещества были названы изомерами, а само это явление - изомерией.
В основе изомерии, как показал А.М. Бутлеров, лежит различие в строении молекул, состоящих из одинакового набора атомов. Таким образом,
изомерия - это явление существования соединений, имеющих одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства.
Например, при содержании в молекуле 4-х атомов углерода и 10-ти атомов водорода возможно существование 2-х изомерных соединений:
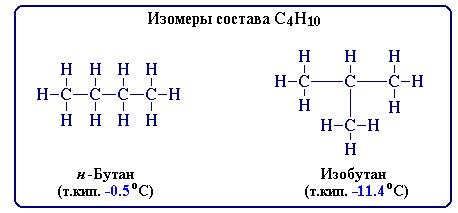
В зависимости от характера отличий в строении изомеров различают структурную и пространственную изомерию.
Структурные изомеры - соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е химическим строением.
Например, составу C5H12 соответствует 3 структурных изомера:
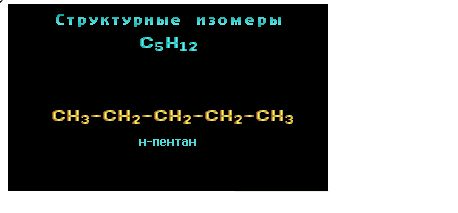
Другой пример:
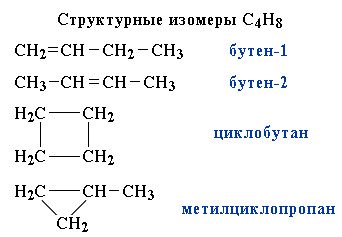
Пространственные изомеры (стереоизомеры) при одинаковом составе и одинаковом химическом строении различаются пространственным расположением атомов в молекуле.
Пространственными изомерами являются оптические и цис-транс изомеры (шарики разного цвета обозначают разные атомы или атомные группы):
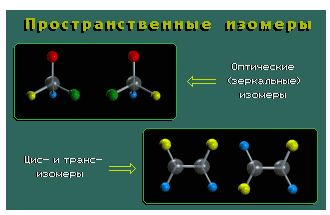
Молекулы таких изомеров несовместимы в пространстве.
Стереоизомерия играет важную роль в органической химии.
Электронные представления в органической химии
Применение электронной теории строения атома и химической связи в органической химии явилось одним из важнейших этапов развития теории строения органических соединений. Понятие о химическом строении как последовательности связей между атомами (А.М. Бутлеров) электронная теория дополнила представлениями об электронном и пространственном строении и их влиянии на свойства органических соединений. Именно эти представления дают возможность понять способы передачи взаимного влияния атомов в молекулах (электронные и пространственные эффекты) и поведение молекул в химических реакциях.
Согласно современным представлениям свойства органических соединений определяются:
· природой и электронным строением атомов;
· типом атомных орбиталей и характером их взаимодействия;
· типом химических связей;
· химическим, электронным и пространственным строением молекул.
Свойства электрона
Электрон имеет двойственную природу. В разных экспериментах он может проявлять свойства как частицы, так и волны. Движение электрона подчиняется законам квантовой механики.
Электрон может находиться в любой точке пространства, но с разной вероятностью.
Часть пространства, в котором велика вероятность нахождения электрона, называют орбиталью или электронным облаком. Например:
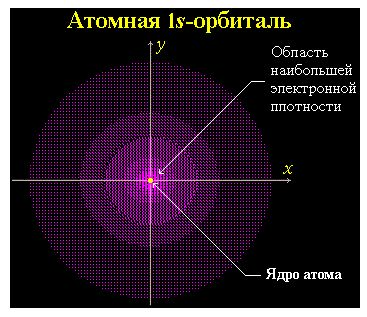
Атомная орбиталь (АО) - область наиболее вероятного пребывания электрона (электронное облако) в электрическом поле ядра атома.
Положение элемента в Периодической системе определяет тип орбиталей его атомов (s-, p-, d-, f-АО и т.д.), различающихся энергией, формой, размерами и пространственной направленностью.

Для элементов 1-го периода (Н, He) характерна одна АО - 1s.
Энергия орбитали возрастает по мере удаления электрона от ядра атома (т.е. с увеличением номера электронного уровня).
Заполнение атомных орбиталей электронами
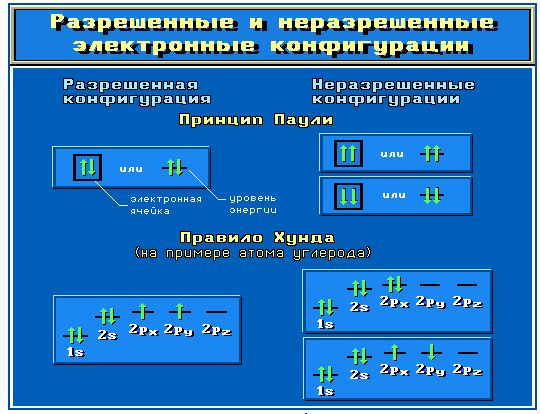
При заполнении атомных орбиталей электронами соблюдаются три основные правила.
Принцип устойчивости. АО заполняются электронами в порядке повышения их энергетических уровней:
1s < 2s < 2p < 3s < 3p < 4s < 3d ...
Принцип Паули. На одной АО могут находиться не более двух электронов с противоположными спинами.
Правило Хунда. На АО с одинаковой энергией, так называемых вырожденных орбиталях, электроны располагаются по одному с параллельными спинами.
Электронные конфигурации
В химических превращениях принимают участие электроны внешнего электронного уровня - валентные электроны.
Наиболее распространенные в органических соединениях элементы (элементы-органогены) относятся в основном ко 2-му (C, N, O) и 3-му (P, S, Cl) периодам Периодической системы. Валентными электронами этих элементов являются 2s-, 2р- и 3s-, 3р-электроны, соответственно.
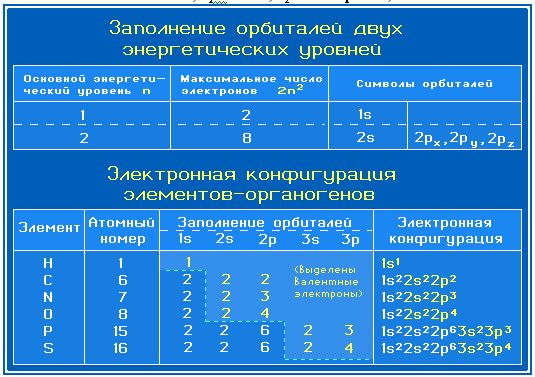
Валентные электроны элементов-органогенов
36) Алканы, имея общую формулу СnH2n+2, представляют собой ряд родственных соединений с однотипной структурой, в котором каждый последующий член отличается от предыдущего на постоянную группу атомов (-CH2-). Такая последовательность соединений называется гомологическим рядом (от греч. homolog - сходный), отдельные члены этого ряда – гомологами, а группа атомов, на которую различаются соседние гомологи, – гомологической разностью.
Гомологический ряд алканов легко составить, прибавляя каждый раз к предыдущей цепочке новый атом углерода и дополняя его оставшиеся валентности до 4-х атомами водорода. Другой вариант – добавление в цепь группы -СН2
CH4 или Н-СН2-Н – первый член гомологического ряда – метан (содержит 1 атом C);
CH3-CH3 или Н-СН2-СН2-Н – 2-й гомолог – этан (2 атома С);
CH3-CH2-CH3 или Н-СН2-СН2-СН2 -Н – 3-й гомолог – пропан (3 атома С);
CH3-CH2-CH2-CH3 или Н-СН2-СН2-СН2-СН2-Н – бутан (4 атома С).
Суффикс -ан является характерным для названия всех алканов. Начиная с пятого гомолога, название алкана образуется из греческого числительного, указывающего число атомов углерода в молекуле, и суффикса -ан: пентан С5Н12, гексан С6Н14, гептан С7Н16, октан
С8Н18, нонан С9Н20, декан С10Н22 и т.д.
Химическое строение (порядок соединения атомов в молекулах) простейших алканов – метана, этана и пропана – показывают их структурные формулы, приведенные в разделе 2. Из этих формул видно, что в алканах имеются два типа химических связей:
С–С и С–Н.
Связь С–С является ковалентной неполярной. Связь С–Н - ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности (2.5 - для углерода и 2.1 - для водорода). Образование ковалентных связей в алканах за счет общих электронных пар атомов углерода и водорода можно показать с помощью электронных формул:

Электронные и структурные формулы отражают химическое строение, но не дают представления о пространственном строении молекул, которое существенно влияет на свойства вещества.
Пространственное строение, т.е. взаимное расположение атомов молекулы в пространстве, зависит от направленности атомных орбиталей (АО) этих атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности.
Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации (часть I, раздел 4.3). Насыщенный атом углерода в алканах связан с четырьмя другими атомами. Следовательно, его состояние соответствует sp3-гибридизации (часть I, раздел 4.3.1). В этом случае каждая из четырех sp3-гибридных АО углерода участвует в осевом (σ-) перекрывании с s-АО водорода или с sp3-АО другого атома углерода, образуя σ-связи С-Н или С-С.
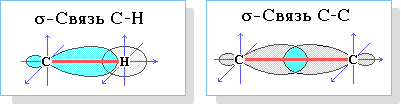
Четыре σ-связи углерода направлены в пространстве под углом 109о28', что соответствует наименьшему отталкиванию электронов. Поэтому молекула простейшего представителя алканов – метана СН4 – имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода:
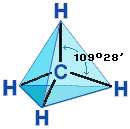
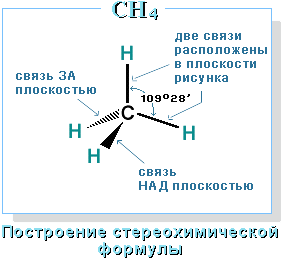
Валентный угол Н-С-Н равен 109о28'. Пространственное строение метана можно показать с помощью объемных (масштабных) и шаростержневых моделей.

Для записи удобно использовать пространственную (стереохимическую) формулу.
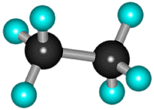
В молекуле следующего гомолога – этана С2Н6 – два тетраэдрических sp3-атома углерода образуют более сложную пространственную конструкцию:
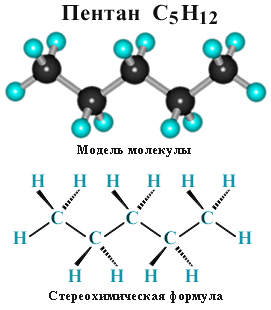
Для молекул алканов, содержащих свыше 2-х атомов углерода, характерны изогнутые формы. Это можно показать на примере н-бутана или н-пентана:
37) Мета́н (лат. Methanum) — простейший углеводород, бесцветный газ без запаха, химическая формула — CH4. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты со специфическим «запахом газа». Сам по себе метан не токсичен и не опасен для здоровья человека. Обогащение одорантами делается для того, чтобы человек вовремя заметил утечку газа.
В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и кальция) или безводного гидроксида натрия с ледяной уксусной кислотой.
2NaOH+CH3COOH→(t)Na2CO3+CH4↑+H2O
Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен.
Возможно получение метана сплавлением ацетата натрия с гидроксидом натрия:
CH3COONa + NaOH → CH4↑ + Na2CO3
Химические свойства
Горит в воздухе голубоватым пламенем, при этом выделяется энергия около 39 МДж на 1 м³. С воздухом образует взрывоопасные смеси при объёмных концентрациях от 5 до 15 процентов. Точка замерзания -184С (при нормальном давлении)
Вступает с галогенами в реакции замещения (например, CH4 + 3Cl2= CHCl3+ 3HCl), которые проходят по свободно радикальному механизму:
CH4 + ½Cl2 = CH3Cl (хлорметан)
CH3Cl + ½Cl2 = CH2Cl2 (дихлорметан)
CH2Cl2 + ½Cl2 = CHCl3 (трихлорметан)
CHCl3 + ½Cl2 = CCl4 (тетрахлорметан)
Выше 1400 °C разлагается по реакции:
2CH4 = C2H2 + 3H2
Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм по цепному радикальному механизму:
CH4 + 3[O] = HCOOH + H2O
Применение метана
1) Топливо.
2) Продукты хлорирования используются в огнетушителях, а так же как снотворное, или растворитель.
3) Производство продукта дегидрирования-ацетилена.
4) Продукт конверсии-синтез-газ. Используется для производства метанола и формальдегида, а следовательно и полимеров, медикаментов и денатурирующих и дезинфицирующих материалов. Также из синтез-газа изготавливаются аммиак и удобрения.
38) Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными.
Алкены образуют гомологический ряд с общей формулой CnH2n.
Номенклатура. Алкены простого строения часто называют, заменяя суффикс -ан в алканах на -илен: этан — этилен, пропан — пропилен и т.д.
этен (этилен) C2H4
пропен C3H6
бутен C4H8
пентен C5H10
гексен C6H12
гептен C7H14
октен C8H16
нонен C9H18
децен C10H20
По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан — пропен и т.д.). Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:
СH3
|
H3C—CH2—C—CH==CH2 H3C—C==CH—CH—CH2—CH3
| | |
CH3 CH3 CH3
3,3-диметилпентен-1 2,4-диметилгексен-2
Иногда используют и рациональные названия. В этом случае все алкеновые углеводороды рассматривают как замещенные этилена:
Н3С—СН==СН—CH2—СН3
метилэтилэтилен
Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
Н2С==СН— - винил (этенил)
Н2С==CН—СН2 - аллил (пропенил-2)
Изомерия.
Для алкенов характерны два вида структурной изомерии. Кроме изомерии, связанной со строением углеродного скелета (как у алканов), появляется изомерия, зависящая от положения двойной связи в цепи. Это приводит к увеличению числа изомеров в ряду алкенов.
Первые два члена гомологического ряда алкенов - этилен и пропиле) - изомеров не имеют и их строение можно выразить так:
H2C==CH2 H2C==CH—CH3
этилен пропилен
(этен) (пропен) CH3
Для углеводорода С4H8 возможны три изомера: |
H2C==CH—CH2—CH3 H3C—CH==CH—CH3 H2C==C— CH3
бутен-1 бутен-2 2-метилпропен-1
Первые два отличаются между собой положением двойной связи углеродной цепи, а третий — характером цепи (изостроение).
Однако в ряду этиленовых углеводородов помимо структурно изомерии возможен еще один вид изомерии — цис-, транс-изомерия (геометрическая изомерия). Такая изомерия характерна для соединений с двойной связью. Если простая s-связь допускает свободное вращение отдельных звеньев углеродной цепи вокруг своей оси, то вокруг двойной связи такого вращения не происходит. Это и является причиной появления геометрических
(цис-, транс-) изомеров.
Геометрическая изомерия — один из видов пространственной изомерии.
Изомеры, у которых одинаковые заместители (при разных углеродных атомах) расположены по одну сторону от двойной связи, называют цис-изомерами, а по разную — транс-изомерами:
H H H CH3
| | | |
C==C C==C
| | | |
H3C CH3 H3C H
цис-бутен-2 транс-бутен-2
Цис- и транс-изомеры отличаются не только пространственным строением, но и многими физическими и химическими свойствами. Транс-изомеры более устойчивы, чем цис-изомеры.
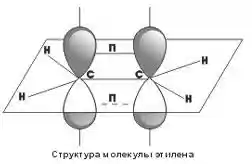
гибридизация одной s- и двух р-орбиталей (sp2-гибридизация),
как видно, у каждого атома углерода есть σ-связи, образованные sp2-гибридными облаками, кроме того, между атомами углерода образуется π-связь за счет перекрывания p-орбиталей. Таким образом, двойные углерод-углеродные связи состоят из одной σ- и одной π-связи.
39) Этилен – в природе этот газ практически не встречается: он образуется в незначительных количествах в тканях растений и животных как промежуточный продукт обмена веществ. Попутно это — самое производимое органическое соединение в мире. Газ этилен служит сырьем для получения полиэтилена.
Свойства этилена
Этилен (другое название — этен) — химическое соединение, описываемое формулой С2H4. В природе этилен практически не встречается. Это бесцветный горючий газ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0°C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах.
Этилен является простейшим алкеном (олефином). Содержит двойную связь и поэтому относится к ненасыщенным соединениям. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном.
Химические свойства
а) Реакции присоединения
Запомните! Реакции замещения свойственны алканам и высшим циклоалканам, имеющим только одинарные связи, реакции присоединения – алкенам, диенам и алкинам, имеющим двойные и тройные связи.

Качественная реакция: «мягкое окисление (в водном растворе)»
– алкены обесцвечивают раствор перманганата калия (реакция Вагнера)
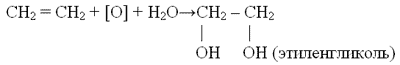
Применение алкенов
1 – получение горючего с высоким октановым числом;
2 – пластмасс;
3 – взрывчатых веществ;
4 – антифризов;
5 – растворителей;
6 – для ускорения созревания плодов;
7 – получение ацетальдегида;
8 – синтетического каучука.
40) Мономеры (от моно... и греч. méros — часть), низкомолекулярные вещества, молекулы которых способны вступать в реакцию (полимеризацию или поликонденсацию) друг с другом или с молекулами других веществ с образованием полимера. Например АМИНОКИСЛОТА это мономер белка, а пропилен это мономерная форма, из которой получают полипропилен.
Полимеры (от греч. polymeres — состоящий из многих частей, многообразный), химические соединения с высокой молекулярной массой (от нескольких тысяч до многих миллионов), молекулы которых (макромолекулы) состоят из большого числа повторяющихся группировок (мономерных звеньев). Атомы, входящие в состав макромолекул, соединены друг с другом силами главных и (или) координационных валентностей.
Классификация. По происхождению П. делятся на природные (биополимеры), например белки, нуклеиновые кислоты, смолы природные, и синтетические, например полиэтилен, полипропилен, феноло-формальдегидные смолы. Атомы или атомные группы могут располагаться в макромолекуле в виде: открытой цепи или вытянутой в линию последовательности циклов (линейные П., например каучук натуральный); цепи с разветвлением (разветвленные П., например амилопектин); трёхмерной сетки (сшитые П., например отверждённые эпоксидные смолы). П., молекулы которых состоят из одинаковых мономерных звеньев, называются гомополимерами, например поливинилхлорид, поликапроамид, целлюлоза.
Группа атомов, многократно повторяющаяся в цепной макромолекуле, называется ее структурным звеном.
...-CH2-CHCl-CH2-CHCl-CH2-CHCl-CH2-CHCl-CH2-CHCl-...
поливинилхлорид
В формуле макромолекулы это звeно обычно выделяют скобками:
(-CH2-CHCl-)n
По строению структурного звeна макромолекулы можно сказать о том, какой мономер использован в синтезе данного полимера и, наоборот, зная формулу мономера, нетрудно представить строение структурного звeна.
Строение структурного звена соответствует строению исходного мономера, поэтому его называют также мономерным звеном.
Степень полимеризации — это число, показывающее сколько молекул мономера соединилось в макромолекулу.
В формуле макромолекулы степень полимеризации обычно обозначается индексом "n" за скобками, включающими в себя структурное (мономерное) звено:
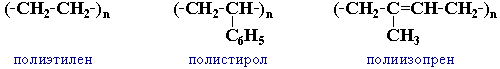
n >> 1
Для синтетических полимеров, как правило, n ≈ 102-104; а самые длинные из известных природных макромолекул – ДНК (полинуклеотидов) – имеют степень полимеризации n ≈ 109-1010.
Молекулярная масса, молекулярный вес, значение массы молекулы, выраженное в атомных единицах массы. Практически Молекулярная масса равна сумме масс всех атомов, входящих в состав молекулы. За Молекулярная масса часто принимают среднюю массу молекул данного вещества, найденную с учётом относительного содержания изотопов всех элементов, входящих в его состав.
Молекулярная масса являются важной характеристикой высокомолекулярных соединений — полимеров, определяющей их физические (и технологические) свойства. Макромолекулы полимеров образуются повторением сравнительно простых звеньев (групп атомов); число мономерных звеньев, входящих в состав различных молекул одного и того же полимерного вещества, различно, вследствие чего Молекулярная масса макромолекул таких полимеров также неодинакова. Поэтому при характеристике полимеров обычно говорят о среднем значении Молекулярная масса; эта величина даёт представление о среднем числе звеньев в молекулах полимера (о степени полимеризации).
Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера) по схеме:
![]()
Число n называется степенью полимеризации.
Реакции полимеризации алкенов идут в результате присоединения по кратным связям:

ПОЛИКОНДЕНСАЦИЯ (далее П.) - это процесс получения полимеров из би- или полифункциональных соединений (мономеров), сопровождающийся выделением побочного низкомолекулярного вещества (воды, спирта, галогеноводорода и др.). П. осуществляют тремя различными способами: в расплаве, когда смесь исходных соединений длительно нагревают при температуре, на 10-20 °С превышающей температуру плавления (размягчения) образующегося полимера; в растворе, когда мономеры находятся в одной жидкой фазе в растворённом состоянии; на границе раздела двух несмешивающихся жидкостей, в каждой из которых растворено одно из исходных соединений (межфазная П.).
Процессы П. играют важную роль в природе и технике. П. или подобные ей реакции лежат в основе биосинтеза наиболее важных биополимеров - белков, нуклеиновых кислот, целлюлозы и др. П. широко используется в промышленности для получения полиэфиров (полиэтилентерефталата, поликарбонатов, алкидных смол), полиамидов, феноло-формальдегидных смол, мочевино-формальдегидных смол, некоторых кремнийорганических полимеров и др.
41) Алкадиены, как следует из их названия, представляют собой ненасыщенные углеводороды, содержащие в своем углеродном скелете две двойные связи. Их также называют диеновыми угле-водородами. Общая формула гомологического ряда алкадиенов — СnН2n-2. Следует иметь в виду, что такая же формула соответствует и другим гомологическим рядам — например, алкинов или циклоалкенов.
По взаимному раположению двойных связей и химическим свойствам диены делятся на три группы:1. Диены с соседним расположением двойных связей называют диенами кумулированными связями. Эти соединения малоустойчивы и легко перегруппировыватся в алкины.
2. Диены, у которых двойные связи разделены более чем одной простой связью, называются диенами с изолированными связями. Их реакции ничем не отличаются от реакций с той лишь разницей, что в реакции может вступить одна или две связи.
3.Диены с 1,3-полрожением двойных связей (двойные связи разделены одной простой) несколько отличаются по свойствам от алкенов и важны с практической точки зрения. Это послужило причиной обособления их в отдельную группу. такие диены называют диенами с сопряжёнными связями. Обычно, когда речь идёт просто о диенах, подразумевается 1,3-диены.
В настоящее время основным способом получения этого вещества является дегидрирование бутана (получаемого из нефти или природного газа) над катализатором, представляющим собой смесь оксидов хрома (III) и алюминия
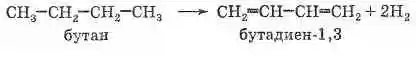
Исторически имеет огромное значение предложенный в 1932 году С. В. Лебедевым метод получения бутадиена из этилового спирта каталитической реакцией дегидрирования-дегидратации. Катализатором этой реакции является смесь на основе оксидов цинка и алюминия:
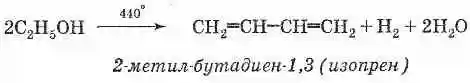
Представляет собой мономер натурального каучука и может быть получен из него термическим разложением без доступа воздуха. В промышленности получается (аналогично дивинилу) из легких фракций продуктов крекинга нефти процессом дегидрирования на оксидных катализаторах:

Химические свойства
1. Реакция электрофильного присоединения(АЕ) более характерна для алкадиенов.
Главная особенность химии сопряженных диенов в том, что на первой ступени образуется не только обычный продукт 1,2- присоединения, но и продукт 1,4-присоединения (см. выше).
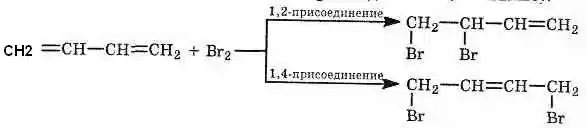
Преимущественное протекание реакции по тому или иному пути зависит от конкретных условий. При избытке брома образуется тетрабромид:
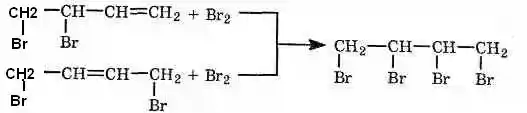
Аналогичным образом присоединяются хлор, галогеноводороды, вода (в присутствии сильных кислот) и некоторые другие вещества.
2. Полимеризация диеновых углеводородов (см. Полимеризация). Полимеризация алкадиенов может происходить по катионному, радикальному, координационному, анионному (под действием натрия) механизмам, приводя к образованию полимеров, обладающих высокой эластичностью и напоминающих природный каучук. Получение синтетического каучука — основная область применения диеновых углеводородов (главным образом бутадиена и изопрена). Натуральный каучук — полимер изопрена: n=1000-3000

Синтетический каучук в промышленном масштабе впервые был получен в 1932 г. в нашей стране по способу С. В. Лебедева:
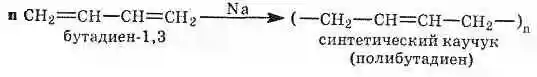
Алкадиены используются в основном для синтеза синтетических каучуков.
42) С изобретением конвейерного метода сборки автомобилей потребность в резине стала настолько велика, что возник вопрос об ограниченности производства природного сырья. Надо было искать альтернативные источники каучука. Поэтому неудивительно, что в конце 19 - первой половине 20 в. во многих странах исследовались строение каучука, его физические и химические свойства, эластичность, процесс вулканизации.

То, что при нагревании из каучука можно получить молекулы изопрена долгое время объясняли с помощью теории К. Харриеса, который считал, что каучук состоит из множества колец-звеньев изопрена, которые составляют устойчивую мицеллу, т.е. он представляет собой обычную коллоидную частицу. Оппонентом К. Харриеса выступал Г. Штаудингер, доказавший, что каучук является высокомолекулярным соединением, т.е. состоит из обычных, хотя и гигантских молекул, атомы в которых связаны ковалентными связями. На основании своих исследований каучука и резины он выдвинул теорию цепного строения макромолекул, предположил существование разветвленных макромолекул и трехмерной полимерной сетки.
Для получения натурального каучука млечный сок гевеи (латекс) добывают методом подсечки, надрезая кору дерева. Натуральный латекс, представляющий собой водную эмульсию каучука, содержит 34-37% каучука, 52-60% воды, а также белки, смолы углеводы и минеральные вещества. Из латекса каучук коагулируют органическими кислотами, промывают водой и прокатывают в листы, которые сушат и коптят дымом. Копчение предохраняет каучук от окисления и действия микроорганизмов.
В натуральном каучуке содержится 91-96% углеводорода полиизопрена (C5H8)n, а также белки и аминокислоты, жирные кислоты, каротин, небольшие количества солей меди, марганца, железа и др. примеси. Полиизопрен натурального каучука является стереорегулярным полимером.

Практически все звенья изопрена 98-100% в макромолекуле присоединены в цис-1,4-положении: Молекула натурального каучука может содержать 20-40 тыс. элементарных звеньев, его молекулярная масса составляет от 1 400 000-2 600 000, он нерастворим в воде, зато хорошо растворяется в большинстве органических растворителей. Интересно, что существует природный геометрический изомер каучука - гуттаперча, представляющая собой транс-1,4-полиизопрен: Различия в пространственном расположении заместителей у каучука и гуттаперчи приводят к тому, что и форма макромолекул этих веществ тоже различна. Молекулы каучука закручены в клубки.Если ленту из каучука растягивать, деформировать, то молекулярные клубки будут выпрямляться в направлении прилагаемой сил, и лента будет удлиняться.
При нагревании каучук из эластичного состояния переходит в вязкотекучее. Силы взаимодействия между молекулами ослабевают, полимер не сохраняет форму и напоминает очень вязкую жидкость. При охлаждении каучук из эластичного переходит в стеклообразное состояние, становится похож на твердое тело. Такой полимер легко и обратимо не растягивается при приложении нагрузки. Он сразу рвется, если нагрузка слишком велика. Полимеры в стеклообразном состоянии могут быть хрупкими, их можно сломать или даже разбить, например, морозной зимой может растрескаться сумка из кожзаменителя, т.к. при низких температурах он переходит в стеклообразное состояние).
Что же происходит с каучуком при вулканизации? Когда каучук нагревают с серой, макромолекулы каучука «сшиваются» друг с другом серными мостиками. Из отдельных макромолекул каучука образуется единая трехмерная пространственная сетка. Изделие из такого материала (резины) прочнее, чем из каучука, и сохраняет свою эластичность в более широком интервале температур. Сейчас известно много вулканизирующих агентов, однако при производстве резины по-прежнему широко используют серу. В качестве ускорителей вулканизации применяют 2-меркаптобензтиазол и некоторые его производные. Возможна и радиационная вулканизация и вулканизация с помощью органических пероксидов. Вулканизации обычно подвергают смесь каучука с различными добавками, придающими резине необходимые свойства, и наполнителями, снижающими стоимость резины (сажа, мел).
43) Алкины — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна тройная связь.
Углеводороды ряда ацетилена являются еще более непредельными соединениями, чем соответствующие им алкены (с тем же числом углеродных атомов). Это видно из сравнения числа атомов водорода в ряду:
С2Н6 C2H4 С2H2
этан этилен ацетилен
(этен) (этин)
Алкины образуют свой гомологический ряд с общей формулой, как и у диеновых углеводородов СnH2n-2
Тройная связь является комбинацией из одной σ- и двух π-связей, образуемых двумя sp-гибридизованными атомами (часть I, раздел 4.3.3).
σ-Связь возникает при осевом перекрывании sp-гибридных орбиталей соседних атомов углерода; одна из π-связей образуется при боковом перекрывании рy-орбиталей, другая – при боковом перекрывании рz-орбиталей. Образование связей на примере молекулы ацетилена H–C≡C–H можно изобразить в виде схемы:
C≡C σ-связь (перекрывание 2sp-2sp);
π-связь (2рy-2рy);
π-связь (2рz-2рz);
С–Н σ-связь (перекрывание 2sp-АО углерода и 1s-АО водорода).
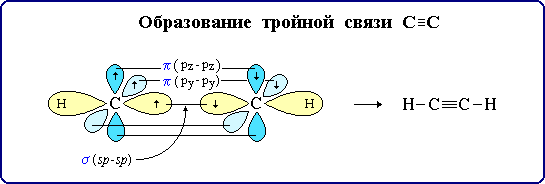
π-Cвязи располагаются во взаимно перпендикулярных плоскостях:
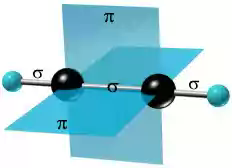
σ-Cвязи, образуемые sp–гибридными орбиталями углерода, располагаются на одной прямой (под углом 180° друг к другу). Поэтому молекула ацетилена имеет линейное строение:
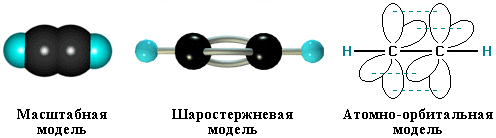
43) Ацетилен - при нормальных условиях — бесцветный газ, запах которого напоминает запах чеснока, малорастворим в воде, легче воздуха. Чистый ацетилен при охлаждении сжижается при -83,8°С, а при дальнейшем понижении температуры быстро затвердевает. Он умеренно растворим в воде (1150 мл в 1 л воды при 15°С и атмосферном давлении) и хорошо в органических растворителях, особенно в ацетоне (25 л в 1 л ацетона при тех же условиях и 300 л под давлением 12 атм). Термодинамически ацетилен неустойчив: он взрывается при нагревании до 500° С, а при обычной температуре - при повышении давления до 2 атм. Поэтому его хранят в баллонах, наполненных пористым инертным материалом, который пропитан ацетоном.
Методы получения
Основным промышленным способом получения ацетилена является электро- или термокрекинг метана, пиролиз природного газа и карбидный метод.
[править]
Карбидный метод (промышленный способ)
Прокаливанием в электрических печах смеси оксида кальция с коксом при 1800—2000°С получают карбид кальция:
![]()
При действии на полученный карбид воды образуется гидроксид кальция и ацетилен:
![]()
Пиролиз углеводородов (промышленный способ)
Суть способа заключается в пропускании над специальной огнеупорной насадкой смеси природного газа с воздухом, который сгорая поднимает температуру до 1500 °C. Затем на насадке происходит пиролиз метана
![]()
Применение
Ацетилен используют для так называемой автогенной сварки и резки металлов. Для этого нужны два баллона с газами — с кислородом и с ацетиленом. Газы из баллонов поступают в специальную горелку. При сгорании ацетилена в кислороде получается очень горячее пламя; максимальная его температура (3200° С) достигается при содержании ацетилена 45% по объему. В таком пламени очень быстро расплавляются даже толстые куски стали.
Как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (карбидка).
Ацетилен может служить исходным продуктом для синтеза многих более сложных органических соединений. Эта область применения ацетилена в настоящее время является самой обширной. Ацетилен - реакционноспособное соединение, вступающее в многочисленные реакции. Химия ацетилена богата. Из него можно получить сотни разнообразных соединений.
Он используется в производстве взрывчатых веществ (ацетилениды), для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
Химические свойства

44) Бензол С6Н6 – родоначальник ароматических углеводородов.
Каждый из шести атомов углерода в его молекуле находится в состоянии sp2-гибридизации (часть I, раздел 4.3.2) и связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы между каждой парой π-связей равны 120°. Таким образом, скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости:
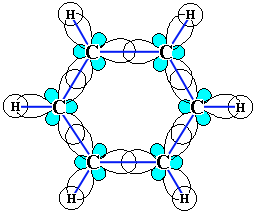
р-Электроны всех атомов углерода взаимодействуют между собой путем бокового перекрывания соседних 2р-АО, расположенных перпендикулярно плоскости σ-скелета бензольного кольца. Они образуют единое циклическое π-электронное облако, сосредоточенное над и под плоскостью кольца.
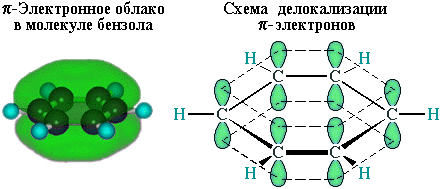
Все связи С–С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф.Кекуле), а все они выровнены (делокализованы, см. анимацию). Поэтому структурную формулу бензола изображают в виде правильного шестиугольника (σ-скелет) и кружка внутри него, обозначающего делокализованные π-связи:

Формула Кекуле также нередко используется, но при этом учитывается, что она лишь условно передает строение молекулы.
1.Горение бензола:
2С6Н6 + 15О2 → 12СО2 + 6Н2О
2. Реакция замещения:
С6Н6 + Br2 → C6H5Br + HBr
3. Нитрование:
С6Н6 + НОNО2 → С6Н5NО2 + Н2О
4. Гидрирование:
С6Н6 + 3Н2 → С6Н12
5. Хлорирование:
С6Н6 + 3 Cl2 → C6H6Cl6
-
Бензол получают из каменноугольной смолы, образующейся при коксовании угля.
-
В настоящее время бензол получают из нефти.
-
Бензол получают синтетическими методами.
-
С6Н14 à С6Н6 + Н2
-
С6Н12 à С6Н6 + 3Н2
-
3С2Н2à С6Н6
Применение
Бензол входит в десятку важнейших веществ химической промышленности. Большую часть получаемого бензола используют для синтеза других продуктов:
около 50 % бензола превращают в этилбензол (алкилирование бензола этиленом);
около 25 % бензола превращают в кумол (алкилирование бензола пропиленом);
приблизительно 10—15 % бензола гидрируют в циклогексан;
около 10 % бензола расходуется на производство нитробензола;
2—3 % бензола превращают в линейные алкилбензолы;
приблизительно 1 % бензола используется для синтеза хлорбензола.
В существенно меньших количествах бензол используется для синтеза некоторых других соединений. Изредка и в крайних случаях, ввиду высокой токсичности, бензол используется в качестве растворителя. Кроме того, бензол входит в состав бензина. Ввиду высокой токсичности его содержание новыми стандартами ограничено введением до 1 %.
45) Генетические связи между веществами следует понимать как генетическое родство веществ на основании их строения и свойств, показывающее единство и взаимосвязь всех органических соединений. Генетические связи отражают диалектику природы, показывают как шел процесс усложнения, развития веществ, их состава, строения, появления образований, способных к зарождению жизни (мировозренческий аспект, обсуждаемой проблемы).
В практическом плане генетические связи показывают, из каких веществ и какими способами можно получить нужные вещества. Каждый переход – это одновременно и выражение химических свойств вещества и возможных путей его практического использования.
CH4 → C2H2 → C6H6
-
2CH4 t→ C2H2 + 3H2
-
3C2H2 → C6H6
46) Спиртами называются соединения, содержащие одну или несколько гидроксильных групп (–ОН), связанных с углеводородным радикалом. В зависимости от числа гидроксильных групп спирты делят на одно-, двух- и трёхатомные.
В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты:
А) первичные R–CH2–OH,
Б) вторичные
R
I
CH–OH,
I
R’
В) и третичные
R
I
R’– C–OH.
I
R’’
Физические свойства
Низшие спирты (до С12) – жидкости, температуры кипения которых значительно выше, чем у соответствующих алканов из-за образования водородных связей за счёт полярной связи О–Н
…….. :O–H ….. :O–H ……
I I
R R
Метанол и этанол смешиваются с водой в любых соотношениях; с увеличением молекулярной массы растворимость спиртов в воде уменьшается. Спирты – производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильные группы -ОН.
Общая формула
предельных одноатомных спиртов
![]()
Для одноатомных спиртов характерны следующие виды изомерии :
1. структурная изомерия;
2. изомерия положения функциональной группы;
3. межклассовая изомерия
Название одноатомным спиртам по заместительной номенклатуре IUPAC даётся в общепринятом режиме: - корень названия определяется в зависимости от количества атомов углерода в родоначальной структуре;
-первый суффикс - в зависимости от предельности или непредельности связей в родоначальной структуре;
- второй суффикс - ОЛ ;
- начиная с третьего члена гомологического ряда одноатомных спиртов, необходими указывать положение функциональной группы.
1 ![]() метанол
метанол
2 ![]() этанол
этанол
3 ![]() пропанол
-1
пропанол
-1
4  пропанол
-2
пропанол
-2
ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ.
I.Реакции, идущие с участием атома водорода гидроксильной группы
1.Взаимодействие со щелочными металлами
C2H5OH+2Na→ C2H5ONa+H2
2.Взаимодействие с карбоновыми кислотами
II.Реакции, идущие с участием гидроксильной группы
1.Взаимодействие с галогеноводородами
C2H5OH+HBr→ C2H5Br+HOH
2.Отщепление воды
C2H5OH→ CH2=CH2+H20
3.Межмолекулярная дегидратация
C2H5OH+HOC2H5 → (C2H5)2O+H2O
Образуется диэтиловый эфир
III.Реакции окисления
1.Отщепление водорода (дегидрирование)
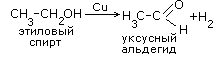
2.Окисление спиртов сильными окислителями [например KMnO4+H2SO4]
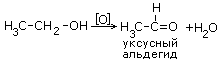
При окислении вторичных спиртов образуются кетоны
3.Реакции горения спиртов
C2H5OH+3O2=2CO2+3H2O
В органической химии метанол используется в качестве растворителя.
Применение
Метанол используется в газовой промышленности для борьбы с образованием гидратов (из-за низкой температуры замерзания и хорошей растворимости). В органическом синтезе метанол применяют для выпуска формальдегида и формалина, уксусной кислоты, ряда эфиров (например, МТБЭ и ДМЭ), изопрена и др.
Наибольшее его количество идёт на производство формальдегида, который используется для производства фенолформальдегидных смол. Значительные количества CH3OH используют в лакокрасочной промышленности для изготовления растворителей при производстве лаков. Кроме того, его применяют (ограниченно из-за гигроскопичности и отслаивания) как добавку к жидкому топливу для двигателей внутреннего сгорания. Используется в топливных элементах.
Служит сырьём для получения многих химических веществ, таких, как ацетальдегид, диэтиловый эфир, тетраэтилсвинец, уксусная кислота, хлороформ, этилацетат, этилен и др.;
Широко применяется как растворитель (в лакокрасочной промышленности, в производстве товаров бытовой химии и многих других областях);
Является компонентом антифриза и стеклоомывателей.
В бытовой химии этанол применяется в чистящих и моющих средствах, в особенности для ухода за стеклом и сантехникой. Является растворителем для репеллентов.
Медицина
В медицине этиловый спирт в первую очередь используется как растворитель, экстрагент и антисептик
по своему действию этиловый спирт можно отнести к антисептикам;
как обеззараживающее и подсушивающее средство, наружно;
подсушивающие и дубящие свойства 96%-го этилового спирта используются для обработки операционного поля или в некоторых методиках обработки рук хирурга;
растворитель для лекарственных средств, для приготовления настоек, экстрактов из растительного сырья и др.;
консервант настоек и экстрактов (минимальная концентрация 18 %);
пеногаситель при подаче кислорода, искусственной вентиляции легких;
в согревающих компрессах;
для физического охлаждения при лихорадке (для растирания)
компонент общей анестезии в ситуации дефицита медикаментозных средств
Как пеногаситель при отеке легких в виде ингаляции 33 % раствора.
Этанол является противоядием при отравлении некоторыми токсичными спиртами, такими как метанол и этиленгликоль. Его действие обусловлено тем, что фермент алкогольдегидрогеназа, при наличии нескольких субстратов (например, метанол и этанол) осуществляет лишь конкурентное окисление, благодаря чему после своевременного (почти немедленного, вслед за метанолом/этиленгликолем) приёма этанола уменьшается текущая концентрация токсичных метаболитов (для метанола — формальдегида и муравьиной кислоты, для этиленгликоля — щавелевой кислоты)
