
- •7) Теория электролитической диссоциации
- •9) Правила написания уравнений реакций в ионном виде
- •10) По химическим свойствам оксиды подразделяют на следующие типы:
- •13) Классификация и свойства солей
- •25) Серная кислота - h2so4
- •28) Оксиды азота
- •35) Основные положения теории химического строения а.М. Бутлерова
- •47) Получение предельных одноатомных спиртов
- •50) Альдегиды
- •52) Карбоновые кислоты
- •55) Сложные эфиры
- •57) Углеводы
-
Таблица Периодической системы химических элементов (далее ПСХЭ) графически отображает Периодический закон (ПЗ). Каждое число в ней характеризует какую-либо особенность в строении атомов:
а) порядковый (атомный) номер элемента указывает на заряд его атомного ядра, т.е. на число протонов, содержащихся в нем, а так как атом электронейтрален, то и на число электронов, находящихся вокруг атомного ядра. Число нейтронов определяют по формуле: N = A-Z, где А- атомная масса, Z-порядковый номер элемента.
б) номер периода соответствует числу энергетических уровней (электронных слоев) в атомах элементов данного периода.
в) номер группы соответствует числу электронов на внешнем уровне для элементов главных подгрупп и максимальному числу валентных электронов для элементов побочных подгрупп.
В периоде с увеличением зарядов атомных ядер элементов (слева направо) металлические свойства ослабевают, а неметаллические усиливаются в силу того, что:
- возрастает число электронов на внешнем уровне атома;
- число энергетических уровней в атомах в пределах периода остается постоянным;
- уменьшается радиус атомов.
В группах (главная подгруппа) с увеличением зарядов атомных ядер элементов (сверху вниз) металлические свойства усиливаются, неметаллические ослабевают, тк
- число электронов на внешнем уровне атомов остается одинаковым;
- увеличивается число энергетических уровней в атоме;
- увеличивается радиус атомов.
В начале XX века была принята планетарная модель строения атома, предложенная Резерфордом, согласно которой вокруг очень малого по размерам положительно заряженного ядра движутся электроны, как планеты вокруг Солнца.
Следовательно, в атоме есть траектории, по которым движется электрон. Однако дальнейшие исследования показали, что в атоме не существует траекторий движения электронов. Движение без траектории означает, что мы не знаем, как электрон движется в атоме, но можем установить область, где чаще всего встречается электрон. Это уже не орбита, а орбиталь. Двигаясь вокруг атома, электроны образуют в совокупности его электронную оболочку.
Давайте выясним, как движутся электроны вокруг ядра? Беспорядочно или в определенном порядке? Исследования Нильса Бора – основоположника современной атомной физики, а также ряда других ученых позволили сделать вывод: электроны в атомах располагаются определенными слоями – оболочками и в определенном порядке.
Строение электронных оболочек атомов имеют важную роль для химии, так как именно электроны обуславливают химические свойства веществ. Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны в атоме различаются определенной энергией, и, как показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше связь их с ядром, но меньше запас энергии. По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Так образуются электронные слои в электронной оболочке атома. Электроны, обладающие близкими значениями энергии образуют единый электронный слой, или энергетический уровень. Энергия электронов в атоме и энергетический уровень определяется главным квантовым числом n и принимает целочисленные значения 1, 2, 3, 4, 5, 6 и 7. Чем больше значение n, тем больше энергия электрона в атоме. Максимальное число электронов, которое может находиться на том или ином энергетическом уровне, определяется по формуле:
N = 2n2
Где N – максимальное число электронов на уровне;
n – номер энергетического уровня.
Установлено, что на первой оболочке располагается не более двух электронов, на второй – не более восьми, на третьей – не более 18, на четвертой – не более 32. Известно, что на внешнем энергетическом уровне может находиться не более восьми электронов, его называют завершенным. Электронные слои, не содержащие максимального числа электронов, называют незавершенными.
Число электронов на внешнем энергетическом уровне электронной оболочки атома равно номеру группы для химических элементов главных подгрупп.
Как ранее было сказано, электрон движется не по орбите, а по орбитали и не имеет траектории.
Пространство вокруг ядра, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона, или электронным облаком.
Орбитали, или подуровни, как их еще называют, могут иметь разную форму, и их количество соответствует номеру уровня, но не превышает четырех. Первый энергетический уровень имеет один подуровень (s), второй – два (s,p), третий – три (s,p,d) и т.д. Электроны разных подуровней одного и того же уровня имеют разную форму электронного облака: сферическую (s), гантелеобразную (p) и более сложную конфигурацию (d) и (f). Сферическую атомную орбиталь ученые договорились называть s-орбиталью. Она самая устойчивая и располагается довольно близко к ядру.
Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания, и, наконец, превращается в гантелеобразную p-орбиталь.
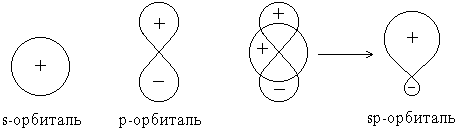
-
Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена электронами. При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа. Различают следующие виды химической связи: ковалентная (полярная и неполярная; обменная и донорно-акцепторная), ионная, водородная и металлическая.
КОВАЛЕНТНАЯ СВЯЗЬ.
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов. Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 и др.
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H2O, NF3, CO2. Ковалентная связь образуется между атомами элементов, обладающих электроотрицательным характером.
Электроотрицательность - это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
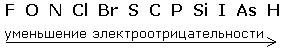
Для наглядного изображения ковалентной связи в химических формулах используются точки ( каждая точка отвечает валентному электрону, а также черта отвечает общей электронной паре ).
Пример. Связи в молекуле Cl2 можно изобразить так:
![]()
Такие записи формул равнозначны. Ковалентные связи обладают пространственной направленностью. В результате ковалентного связывания атомов образуются либо молекулы, либо атомные кристаллические решётки со строго определенным геометрическим расположением атомов. Каждому веществу соответствует своя структура.
С позиции теории Бора образование ковалентной связи объясняется тенденцией атомов преобразовывать свой внешний слой в октет (полное заполнение до 8 электронов). Оба атома представляют для образования ковалентной связи по одному неспаренному электрону, и оба электрона становятся общими.
Пример. Образование молекулы хлора.
![]()
Точками обозначены электроны. При расстановке следует соблюдать правило: электроны ставятся в определённой последовательности - слева, сверху, справа, снизу по одному, затем добавляют по одному, неспаренные электроны и принимают участие в образовании связи.
Новая электронная пара, возникшая из двух неспаренных электронов, становится общей для двух атомов хлора. Существует несколько способов образования ковалентных связей за счёт перекрывания электронных облаков.
Взаимодействие ионов
Если атом теряет один или несколько электронов, то он превращается в положительный ион - катион (в переводе с греческого - "идущий вниз). Так образуются катионы водорода Н+, лития Li+, бария Ва2+. Приобретая электроны, атомы превращаются в отрицательные ионы - анионы (от греческого "анион" - идущий вверх). Примерами анионов являются фторид ион F−, сульфид-ион S2−.
Катионы и анионы способны притягиваться друг к другу. При этом возникает химическая связь, и образуются химические соединения. Такой тип химической связи называется ионной связью
-
Ионная связь - это химическая связь, образованная за счет электростатического притяжения между катионами и анионами.
Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и фтором. Атом щелочного металла легко теряет электрон, а атом галогена - приобретает. В результате этого возникает катион натрия и фторид-ион. Они образуют соединение за счет электростатического притяжения между ними.
Взаимодействие между катионами и анионами не зависит от направления, поэтому о ионной связи говорят как о ненаправленной. Каждый катион может притягивать любое число анионов, и наоборот. Вот почему ионная связь является ненасыщенной. Число взаимодействий между ионами в твердом состоянии ограничивается лишь размерами кристалла. Поэтому "молекулой" ионного соединения следует считать весь кристалл.
Ионы - это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
![]()
![]()
(фторид натрия состоит из ионов натрия Na+ и фторид-ионов F-)
Ионные соединения представляют собой твердые неорганические диэлектрики с ионным типом химической связи. Принято выделять группу диэлектриков с быстрыми видами поляризаций — электронной и ионной, и с замедленными видами поляризаций релаксационного типа, накладывающихся на электронную и ионную поляризацию. К первой группе, в которой наблюдаются только быстрые виды поляризаций, относятся кристаллические вещества с плотной упаковкой ионов. К ним относятся каменная соль, кварц, слюда, корунд, двуокись титана (рутил) и др. Ко второй группе, в которой кристаллические диэлектрики с неплотной упаковкой частиц в решетке имеют также и ионно - релаксационную поляризацию, относятся неорганические стекла, электротехнический фарфор, ситаллы, микалекс и др.
Неполярные диэлектрики (нейтральные) — состоят из неполярных молекул, у которых центры тяжести положительного и отрицательного зарядов совпадают. Следовательно неполярные молекулы не обладают электрическим моментом и их электрический момент p = q • l = 0. Примером практически неполярных диэлектриков, применяемых в качестве электроизоляционных материалов, являются углеводороды, нефтяные электроизоляционные масла, полиэтилен, полистирол и др.
Полярные диэлектрики (дипольные) — состоят из полярных молекул, обладающих электрическим моментом. В таких молекулах из-за их асимметричного строения центры масс положительных и отрицательных зарядов не совпадают. При замещении в неполярных полимерах некоторой части водородных атомов другими атомами или не углеводородными радикалами получаются полярные вещества. При определении полярности вещества по химической формуле следует учитывать пространственное строение молекул. К полярным диэлектрикам относятся феноло-формальдегидные и эпоксидные смолы, кремнийорганические соединения, хлорированные углеводороды и др. Примеры молекул неполярных и полярных веществ показаны на рис.
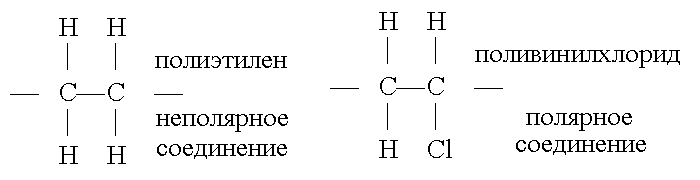
-
Степень окисления - условный заряд атома в химическом соединении, который находят, считая химические связи в соединении чисто ионными и принимая заряды атомов О, М (M-Li,...Cs) и Н, равными соответственно –2 (в пероксидных соединениях -1), –1 и +1 (если Н соединен с более электроотрицательным элементом). Суммируя степень окисления всех атомов в молекуле, кроме интересующего, и считая, что в нейтральной молекуле сумма всех степеней окисления равна 0, находят неизвестное значение степени окисления. Например, для Na2SO4 степень окисления серы + 6. В нейтральных молекулах, состоящих из одинаковых атомов, обычно считают степень окисления нулевой. Иногда степени окисления, вычисленные по приведенным правилам, оказываются дробными.
Число черточек, отходящих от символа элемента в структурных формулах, равно валентности этого элемента. Валентность элемента - это его способность образовывать определенное число химических связей. По числу черточек в уже знакомых нам формулах нескольких молекул видно, что водород и хлор одновалентны, кислород - двухвалентен, а азот - трехвалентен.
![]()
Валентность определяется как число электронных пар, которыми данный атом связан с другими атомами.
Поскольку в химической связи участвуют только электроны внешних оболочек, такие электроны называют валентными. Единичная (простая) ковалентная связь возникает, когда атомы делят между собой одну пару валентных электронов. Традиционно валентность обозначают римскими цифрами. Например,
![]() I
II I II
I
II I II
H2S Cu2O
6) а) Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора :
w(B)= m(B) / m
Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Пример
Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора?
Решение
m(Na2SO4) = w(Na2SO4) / 100 = (5 · 300) / 100 = 15 г
где w(Na2SO4)) – массовая доля в %,
m - масса раствора в г
m(H2O) = 300 г - 15 г = 285 г.
Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4) и 285 г воды.
б) Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V),
где М(B) - молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается "M". Например, 2 M NaOH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль).
Пример
Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
Решение
M(K2CrO4) = C(K2CrO4) · V · M(K2CrO4) = 0,1 моль/л · 1,2 л · 194 г/моль = 23,3 г.
Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K2CrO4 и растворить в воде, а объём довести до 1,2 литра.
в) Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора.
г) Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение числа катионов на его заряд
Пример
Вычислите значение грамм-эквивалента (г-экв.) серной кислоты, гидроксида кальция и сульфата алюминия.
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г
Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г
Э Al2(SO4)3 = М Al2(SO4)3 / (2· 3) = 342 / 2= 57 г
Величины нормальности обозначают буквой "Н". Например, децинормальный раствор серной кислоты обозначают "0,1 Н раствор H2SO4". Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4.
Пример
Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (r = 1,615 г/мл).
Решение
Для вычисления молярности и нормальности надо знать число граммов H2SO4в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём
V = 100 / 1,615 = 61,92 мл
Следовательно, в 1 л раствора содержится 70 · 1000 / 61,92 = 1130,49 г H2SO4
Отсюда молярность данного раствора равна: 1130,49 / М (H2SO4) =1130,49 / 98 =11,53 M
Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 1130,49 / 49 =23,06 H
7) Теория электролитической диссоциации
( С. Аррениус, 1887г. )
1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией).
4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N).
a = n / N 0<a<1
Механизм электролитической диссоциации ионных веществ
При растворении соединений с ионными связями (например, NaCl) процесс гидратации начинается с ориентации диполей воды вокруг всех выступов и граней кристаллов соли.
Ориентируясь вокруг ионов кристаллической решетки, молекулы воды образуют с ними либо водородные, либо донорно-акцепторные связи. При этом процессе выделяется большое количество энергии, которая называется энергией гидратации.
Энергия гидратации, величина которой сравнима с энергией кристаллической решетки, идет на разрушение кристаллической решетки. При этом гидратированные ионы слой за слоем переходят в растворитель и, перемешиваясь с его молекулами, образуют раствор.
Механизм электролитической диссоциации полярных веществ
Аналогично диссоциируют и вещества, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества (например, HCl), определенным образом ориентируются диполи воды. В результате взаимодействия с диполями воды полярная молекула еще больше поляризуется и превращается в ионную, далее уже легко образуются свободные гидратированные ионы.
Электролитическая диссоциация веществ, идущая с образованием свободных ионов объясняет электрическую проводимость растворов.
Сильные электролиты
Это вещества, которые при растворении в воде практически полностью распадаются на ионы. Как правило, к сильным электролитам относятся вещества с ионными или сильно полярными связями: все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4, H2SO4,HNO3) и сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2,Sr(OH)2,Ca(OH)2).
В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют.
Слабые электролиты
Вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Слабые электролиты не могут дать большой концентрации ионов в растворе.
К слабым электролитам относятся:
1) почти все органические кислоты (CH3COOH, C2H5COOH и др.);
2) некоторые неорганические кислоты (H2CO3, H2S и др.);
3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
4) вода.
Они плохо (или почти не проводят) электрический ток.
8) Электролитической диссоциацией называют процесс распада молекул на ионы под действием растворителя.
Вещества, молекулы которых подвергаются диссоциации, называются электролитами. К ним относятся кислоты, гидроксиды, соли.
Причиной диссоциации является взаимодействие между растворенным веществом и растворителем, в результате которого в растворе образуются гидратированные ионы.
Одним из главных отличий электролитов от неэлектролитов является способность их в водных растворах проводить электрический ток. При погружении в водный раствор электролита электродов, подключенных к источнику постоянного тока, положительно заряженные ионы (катионы) будут перемещаться к отрицательному электроду – катоду, а отрицательно заряженные ионы (анионы) к положительно заряженному электроду – аноду.
Ионы могут быть простыми, например: Na+, H+, Ca2+, Al3+, Cl¯, S2– и др., и сложными: OH¯, SO42–, PO43– и др.
Степень диссоциации α– выражается отношением числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (n+N):
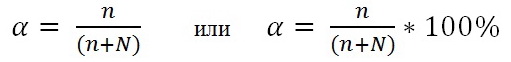
Степень электролитической диссоциации α зависит от природы растворенного вещества и растворителя, температуры, концентрации раствора (величина эта тем больше, чем более разбавлен раствор), добавления одноименных ионов (α понижается).
Многоосновные кислоты и многокислотные основания в водных растворах диссоциируют ступенчато, т.е. вначале от молекулы отщепляется один из ионов, затем другой и т.д. Каждая такая ступень характеризуется своей константой – ступенчатой константой диссоциации (для комплексных соединений – константой нестойкости).
Диссоциация кислот идет с образованием катиона водорода и анионов кислотного остатка:
НСl<=> Н+ + Сl-.
H2S04 <=>2H+ + SO2-
Кислотные остатки могут быть различными, а ион водорода образуется при диссоциации всех кислот. Следовательно, кислотами называются соединения, дающие в растворе ионы водорода и кислотного остатка. Все общие свойства кислот объясняются образованием в растворе любой кислоты гидратированных ионов водорода,
Для многоосновных кислот характерна ступенчатая диссоциация:
H2S04 <=>H+ + HSO4-
HS04-<=>H+ + HSO42-
При диссоциации оснований образуются катионы металла и общие для всех оснований анионы гидраксила ОН-:
K0H<=>K+ + OH-
Са(ОН)2 <=>Са2 ++ 2OH-.
Таким образом, основания можно определить как соединения, дающие в водном растворе ионы гидроксила. Следовательно, носителем всех общих свойств оснований является ион гидроксила.
Основания многовалентных металлов подвергаются ступенчатой диссоциации. Например:
Fe(OH)2 <=>(FeOH)+ + OH-
(FeOH)+ <=>Fe2+ +OH
Существуют гидроксиды, обладающие а м ф о т е рн ы м и свойствами, т. е. способные проявлять свойства кислоты и основания. Объясняется это тем, что диссоциация таких молекул может происходить как по типу кислоты, так и по типу основания.
Н+ + МеO- <=> МеОН <=> Ме+ + OH-
где МеОН — условное обозначение амфотерного электролита. Между всеми продуктами диссоциации устанавливается сложное равновесие.
Соли при диссоциации образуют катионы металла и анионы кислотного остатка:
NaN03 <=> Na+ + N03-
К3Р04 <=>3K+ + PO43-
СаСl2 т<=> Са2+ + 2Сl-
Ионов, которые были бы общими для водных растворов всех солей, нет, поэтому соли не обладают общими свойствами.
При растворении кислых солей в растворе образуются катионы металла и сложные ионы кислотного остатка, которые в свою очередь подвергаются диссоциации с образованием ионов Н+:
NaHS03 <=>Na+ + HSO3-
HS03-<=>H+ + SO32-
При диссоциации основных солей образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксильной группы. Эти сложные ионы также подвергаются диссоциации:
ZnOHCl<=>(ZnOH)++Сl-.
(ZnOH)+<=>Zn2+ + OH-
Вода представляет собой слабый амфотерный электролит:
Н2О → Н+ + ОН-
Константа диссоциации
воды при 25оС
равна:
![]()
![]() - ионное произведение
- ионное произведение
Диссоциация воды – процесс эндотермический, поэтому с повышением температуры в соответствии с принципом Ле-Шателье диссоциация усиливается, ионное произведение возрастает и достигает при 100оС значения 10-13.
В чистой воде при 25оС концентрации ионов водорода и гидроксила равны между собой:
[H+] = [OH-] = 10-7 моль/л
Растворы, в которых концентрации ионов водорода и гидроксила равны между собой, называются нейтральными.
На практике пользуются не концентрациями ионов водорода или гидроксила, а водородным рН или гидроксильным рОН показателями.
Водородный показатель рН равен отрицательному десятичному логарифму концентрации ионов водорода:
рН = - lg[H+]
Гидроксильный показатель рОН равен отрицательному десятичному логарифму концентрации ионов гидроксила:
рОН = - lg[OH-]
Легко показать, прологарифмировав ионное произведение воды, что
рН + рОН = 14
Если рН среды равен 7 - среда нейтральная, если меньше 7 - кислая, причем чем меньше рН, тем выше концентрация ионов водорода. pН больше 7 – среда щелочная, чем больше рН, тем выше концентрация ионов гидроксила.
