
- •7) Теория электролитической диссоциации
- •9) Правила написания уравнений реакций в ионном виде
- •10) По химическим свойствам оксиды подразделяют на следующие типы:
- •13) Классификация и свойства солей
- •25) Серная кислота - h2so4
- •28) Оксиды азота
- •35) Основные положения теории химического строения а.М. Бутлерова
- •47) Получение предельных одноатомных спиртов
- •50) Альдегиды
- •52) Карбоновые кислоты
- •55) Сложные эфиры
- •57) Углеводы
25) Серная кислота - h2so4
Физические свойства
Тяжелая маслянистая жидкость ("купоросное масло"); r = 1,84 г/см3; нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С, очень гигроскопична, обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара).
Химические свойства
H2SO4 - сильная двухосновная кислота
H2SO4 ↔ H+ + HSO4- ↔2H+ + SO42-
Первая ступень (для средних концентраций) приводит к 100%-ой диссоциации:
K2 = ([H+] • [SO42-]) / [HSO4-] = 1,2 • 10-2
1) Взаимодействие с металлами:
a) разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn0 + H2SO4(разб) → ZnSO4 + H2O
b) концентрированная H2SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или H2S-2 (без нагревания не реагируют также Fe, Al, Cr - пассивируются):
2Ag0 + 2H2SO4 →Ag2SO4 + SO2 + 2H2O
8Na0 + 5H2SO4 → 4Na2SO4 + H2S + 4H2O
2) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S+4O2):
С + 2H2SO4(конц) → CO2 + 2SO2 + 2H2O
S + 2H2SO4(конц) → 3SO2 + 2H2O
2P + 5H2SO4(конц) → 5SO2 + 2H3PO4 + 2H2O
3) с основными оксидами:
CuO + H2SO4 → CuSO4 + H2O
4) с гидроксидами:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
5) обменные реакции с солями:
BaCl2 + H2SO4 → BaSO4 + 2HCl
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов
MgCO3 + H2SO4 → MgSO4 + H2O + CO2
26) К главной подгруппе V группы периодической системы принадлежат p-элементы: азот N, фосфор P, мышьяк As, сурьма Sb и висмут Bi. Атомы этих элементов имеют на внешнем энергетическом уровне по пять электронов - ns2np3.
Наличие трех неспаренных электронов на внешнем энергетическом уровне объясняет то, что в нормальном, невозбужденном состоянии валентность элементов подгруппы азота равна трем.
Внешний уровень азота состоит только из двух подуровней - 2s и 2p. Атом азота может отдать с 2s-подуровня один электрон другому атому с большей электроотрицательностью и перейти в четырехвалентный ион N+.
У атомов остальных элементов подгруппы азота на внешних энергетических уровнях имеются вакантные ячейки d-подуровня, поэтому они могут распарить один электрон с s-подуровня и перенести его на d-подуровень. Таким образом, валентность фосфора, мышьяка, сурьмы и висмута равна 5.
Элементы группы азота образуют с водородом соединения состава RH, а с кислородом оксиды вида - R2O3 и R2O5. Оксидам соответствуют кислоты HRO2 и HRO3 (и ортокислоты H3PO4, кроме азота).
Высшая степень окисления этих элементов равна +5, а низшая -3.
В подгруппе азота с ростом порядкового номера неметаллические свойства убывают, а металические усиливаются. Азот - неметалл, висмут - металл. От азота к висмуту прочность соединений RH3 уменьшается, а прочность кислородных соединений возрастает.
АЗОТ
:NºN:
Открыт Д.Резерфордом в 1772 г. Основной компонент воздуха (78% по объему, 75,6% по массе).
В молекуле имеются одна s- и две p- связи.
Физические свойства
Газ, без цвета, запаха и вкуса; плохо растворим в воде (в 100V H2O растворяется 1,54V N2 при t°=20°С и p = 1 атм); t°кип.=-196°C; t°пл.=-210°C.
Ввиду своей значительной инертности азот при обычных условиях реагирует только с литием:
6Li + N2 → 2Li3N,
при нагревании он реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды:
3Mg + N2 → Mg3N2,
2B + N2 →2BN,
Наибольшее практическое значение имеет нитрид водорода (аммиак):
27) АММИАК - NH3
Строение
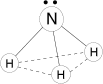
Молекула полярная, имеет форму треугольной пирамиды с атомом азота в вершине, ÐHNH = 107,3°. Атом азота находится в sp3- гибридном состоянии; из четырех гибридных орбиталей азота три участвуют в образовании одинарных связей N–H, а четвертая связь занята неподеленной электронной парой.
Физические свойства
NH3 - бесцветный газ, запах резкий, удушливый, ядовит, легче воздуха.
t° кип.= -33,4°C; t°пл.= -78°C.
Молекулы аммиака связаны слабыми водородными связями
Благодаря водородным связям, аммиак имеет сравнительно высокие t°кип. и t°пл., а также высокую теплоту испарения, он легко сжимается.
Получение
1. Промышленный способ
N2 + 3H2 → 2NH3
(p=1000 атм; t°= 500°C; kat = Fe + алюмосиликаты; принцип циркуляции).
2. Лабораторный способ. Нагревание солей аммония со щелочами.
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2Н2O
(NH4)2SO4 + 2KOH → K2SO4 + 2NH3 + 2Н2O
Аммиак можно собирать только по методу (А), т.к. он легче воздуха и очень хорошо растворим в воде.
Химические свойства
Образование ковалентной связи по донорно-акцепторному механизму.
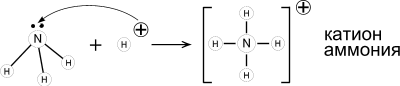
1. Аммиак - основание Льюиса. Его раствор в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус – синий; фенолфталеин – малиновый) из-за образования гидроксида аммония.
NH3 + Н2O ↔ NH4OH ↔ NH4+ + OH-
2. Аммиак реагирует с кислотами с образованием солей аммония.
NH3 + HCl → NH4Cl
2NH3 + H2SO4 → (NH4)2SO4
NH3 + H2O + CO2 → NH4 HCO3
Аммиак - восстановитель (окисляется до N2+1O или N+2O)
1. Разложение при нагревании
2NH3 → N2+ 3H2
2. Горение в кислороде
a) без катализатора
4NH3 + 3O2 → 2N2 + 6Н2O
b) каталитическое окисление ( kat = Pt )
4NH3 + 5O2 → 4NO + 6Н2O
3. Восстановление оксидов некоторых металлов
3CuO + 2NH3 → 3Cu0 + N20 + 3Н2O
СОЛИ АММОНИЯ
Соли аммония – сложные вещества, в состав которых входят катионы аммония NH4+, связанные с кислотным остатком.
Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
Получение
Аммиак (или гидроксид аммония) + кислота.
NH3 + HNO3 → NH4NO3(нитрат аммония)
2NH4OH + H2SO4 →(NH4)2SO4(cульфат аммония) + 2Н2O
Химические свойства
1. Сильные электролиты (диссоциируют в водных растворах)
NH4Cl ↔ NH4+ + Cl-
2. Разложение при нагревании.
a) если кислота летучая
NH4Cl → NH3 + HCl
NH4HCO3 → NH3 + Н2O + CO2
b) если анион проявляет окислительные свойства
NH4NO3 → N2O + 2Н2O
(NH4)2Cr2O7 → N2 + Cr2O3 + 4Н2O
3. С кислотами и солями (реакция обмена)
a) (NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2
CO32- + 2H+→ Н2O + CO2
b) (NH4)2SO4 + Ba(NO3)2 → BaSO4+ 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- → BaSO4+ 2NH4+ + 2NO3-
Ba2+ + SO42- → BaSO4
4. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O → NH4OH + HCl
NH4+ + Н2O → NH4OH + H+
5. При нагревании со щелочами выделяют аммиак (качественная реакция на NH4+)
NH4Cl + NaOH → NaCl + NH3 + Н2O
Применение
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн. тонн. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717)
В медицине 10% раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусы насекомых, обработка рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5–1 с). Внутрь (только в разведении) для индукции рвоты. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипяченой воде и моют руки.
Поскольку является слабым основанием при взаимодействии нейтрализует кислоты.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
