
- •2. Характеристика процесса репликации
- •3. Гипотетические механизмы репликации.
- •4. Ферменты и белки, принимающие участие в репликации
- •Головні білки реплікації
- •5. Стадии репликации: инициация, элонгация, терминация (на примере e.Coli).
- •6.Отличия репликации у эукариот и прокариот
- •Типы репликации
- •8. Проблема репликации линейных концов днк. Теломераза.
- •Тема 2. Геномы организмов
- •Геном прокариот
- •Уcтройство генов прокариотов
- •Обозначения к схеме и пояснения
- •Тема 3: геномы эукариот
- •Тема 4: Репарация
- •Классификация систем репарации
- •Типы рестриктаз
- •Іі. Репликационная система репарации
- •1. Репарация по ходу репликации
- •2. Репликационная репарация после метилирования дочерней цепи
- •3. Прямая репарация
- •4. Эксцизионная репарация
- •Индуцированная sos-репарация
- •III. Пострепликативная репарация (рекомбинационная)
- •Тема 5: мобильные генетические элементы (мгэ)
- •Плазмиды
- •Свойства плазмид
- •Характеристика некоторых видов плазмид
- •Транспозоны
- •Мобильные генетические элементы прокариот
- •Мобильные генетические элементы эукариот
- •Тема 6: регуляция метаболизма
- •Регуляция на уровне транскрипции
- •Регуляция экспрессии генов на уровне трансляции
- •Тема 7. Конструирование рекомбинантных днк (основы генной инженерии)
- •I этап. Получение генов или фрагментов днк для последующего встраивания в хромосому реципиента
- •Синтез гена химическим путем
- •Использование обратной транскриптазы
- •Метод дробовика (дробового ружья)
- •Іі этап. Конструирование рекомбинантных молекул с помощью векторов. Векторы и принципы их конструирования
- •III этап. Введение рекомбинантного вектора в клетку реципиента
- •IV этап. Клонирование рек-днк и идентификация рекомбинантных клеток
4. Эксцизионная репарация
Эксцизионная репарация включает более сложные механизмы репарации, при которых “неправильные” участки ДНК вырезаются с помощью специальных ферментов. Рассмотрим некоторые типы эксцизионной репарации.
Удаление неправильного азотистого основания с образованием АР-сайта осуществляется фрагментом ДНК-N-гликозилазой, которая разрушает гликозидную связь между азотистым основанием и дезоксирибозой, в результате чего вырезается только азотистое основание с сохранением сахарофосфатного остова – образуетсяАР-сайт(от слова апуринизация). Для дальнейшей репарации включаются дополнительные механизмы:
У эукариот обнаружен ферментинсертаза, который напрямую застраивает АР-сайт недостающим азотистым основанием, комплементарным соседней цепи.
У всех организмовможет включаться сложный механизм эксцизии с помощьюАР-эндонуклеаз, которые с 3\или 5\-конца АР-сайта гидролизуют цепь ДНК. ДНК-полимеразаІс помощью 3\- или 5\ -экзонуклеазной активности убирает несколько нуклеотидов, включая АР-сайт, а с помощью полимеризующей активности застраивает образовавшуюся брешь. Лигаза сшивает концы фрагментов. Таким образом в ексцизионной репарации участвуют в основном ферменты репликации.
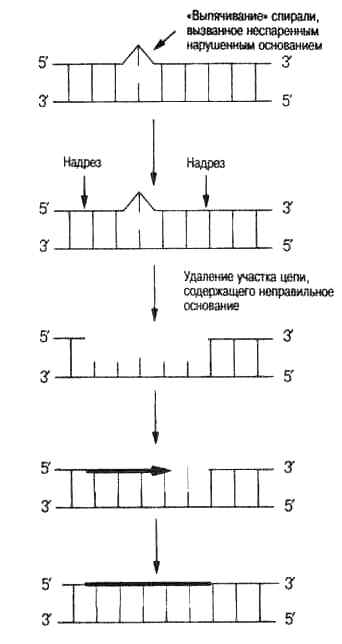
Рис.4.3. Механизм эксцизионной репарации
(аналогично происходит и темновая репарация)
Темновая репарация является частным случаем эксцизионной репарации; однако она осуществляется специальными ферментами, которые кодируются генамиuvr А, В, С, D. Эта репарация включается в темноте, когда не работает фотолиаза, или же когда в ДНК очень много УФЛ-повреждений. Эндонуклеазаuvr АВСразрывает фосфодиэфирные связи с 5\и 3\концов от поврежденного участка (иногда на значительном удалении), хеликазаІІ при этом разводит цепи молекулы ДНК, а ферментuvrDвыщепляет поврежденный фрагмент. ДНК-полимеразаІзастраивает образованную брешь, используя в качестве матрицы неповрежденную цепь, а лигаза сшивает фрагменты.
Индуцированная sos-репарация
Индуцированная SOS-репарация – один из наиболее сложных механизмов репарации. Обнаружена у вирусов, прокариот и эукариот. Ее суть сводится к индуцированному включению отдельных генов (у эукариот) или группы генов в опероне (у прокариот). В качестве индуктора выступает поврежденная ДНК (тиминовые димеры, одноцепочные ДНК, короткие фрагменты ДНК).SOS-система включается, когда в клетке много повреждений, а другие системы репарации не справляются.
Рассмотрим механизм SOS-репарации, обнаруженный уE.coli. ФерментыSOS-репарации кодируются 17 генами, собранными в один большой оперон, который работает по типу индуцибельного оперона с аутогенным контролем.
Этот оперон включается не сразу, а постепенно, как реостат, по мере нарастания количества поврежденной ДНК (индуктора). При отсутствии мутаций, транскрипция этого оперона блокируется белком-регулятором LexA, сидящим на операторе. Появляющиеся в результате повреждений фрагменты ДНК (индукторы) связываются с другим белком-регуляторомRecA и этот комплекс (RecA + Индуктор) воздействует наLexA, вызывая его протеолиз.LexAотпадает от оператора и начинается транскрипция геновuvr АВСДс включением темновой репарации. Если для исправления мутаций этого оказывается достаточно, то экспрессированный далееLexAблокирует оператор. Если же поврежденная ДНК (индуктор) продолжает прибывать, то экспрессированный следомRecAактивируется индуктором и снова убираетLexAс оператора. В результате этого транскрипция продолжается в области других генов и в том числеumuС и umuД, продукты которых ингибируют экзонуклеазную активность Е-субъединицы ДНК-полимеразыІІІ. А именно эта субъединица ответственна за коррекцию синтеза. Таким образом, во избежание полной деградации ДНКSOS-система допускает даже неправильное встраивание нуклеотидов.
SOS-оперон у E.coli
|
|
O |
uvrA |
uvrB |
UvrC |
uvrD |
LexA |
RecA |
Другие гены |
umuC |
umuD |
Терми- натор |

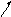
Рис. 4.4. Регуляторные участки и наиболее значимые гены в SOS-опероне у E.coli
Подтверждением существования SOS-репарации являетсяреактивация Уэйгла, обнаруженная у бактериофагов. Уэйглом было установлено, что УФ-облученный фаг может размножаться только в облученных клетках бактерий, у которых уже включиласьSOS-система репарации. Собственных репаративных ферментов фаг не имеет, поэтому без индукции репаративных ферментов у клетки-хозяина он не в состоянии «исправить» свою поврежденную ДНК.
Есть и другие системы SOS-репарации, которые работают по исправлению мутаций, вызванных алкилирующими мутагенами. Оказалось, что активированная метилтрансфераза, т.е. отобравшая алкильную группу от мутантного нуклеотида, служит активатором транскрипции ряда генов – своего собственного и гена кодирующего ДНК-N-гликозилазу, специфичную к алкилированным основаниям (см. «Прямая реактивация»).

 P
P