
- •1.Основные законы химии
- •3.Закон эквивалентов. Эквивалент элементов и соединений.
- •4. Классы неорганических соединений.
- •5. Модель строения атома Резерфорда.
- •7.Принцип квантовой механики: Дискретность энергии, корпускулярно-волновой дуализм, принципы неопределенности Гейзенберга.
- •13. Периодический закон д.И. Менделеева. Периодичность в изменении различных свойств элементов (потенциал ионизации, сродство к электрону, атомные радиусы и т.Д.)
- •14. Сходство и различие химических свойств элементов главных и побочных подгрупп в связи с электронным строением атома.
- •15. Химическая связь. Виды химической связи. Энергетические и геометрические характеристики связи
- •16. Природа химической связи. Энергетические эффекты в процессе образования химической связи
- •17. Основные положения метода вс. Обменный и донорно- акцепторный механизмы образования ковалентной связи
- •18. Валентные возможности атомов элементов в основном и в возбужденном состоянии
- •20. Насыщаемость ковалентной связи. Понятие валентности.
- •21. Полярность ковалентной связи. Теория гибридизации. Виды гибридизации. Примеры.
- •22. Полярность ковалентной связи. Дипольный момент.
- •23. Достоинства и недостатки метода вс.
- •24. Метод молекулярных орбиталей. Основные понятия.
- •26. Ионная связь как предельный случай ковалентной полярной связи. Свойства ионной связи. Основные виды кристаллических решеток для соединений с ионной связью.
- •27. Металлическая связь. Особенности. Элементы зонной теории для объяснения особенностей металлической связи.
- •28. Межмолекулярное взаимодействие. Ориентационный, индукционный и дисперсионный эффекты.
- •29. Водородная связь.
- •30. Основные типы кристаллических решеток. Особенности каждого типа.
- •31. Законы термохимии. Следствия из законов Гесса.
- •32. Понятие о внутренней энергии системы, энтальпии и энтропии
- •33. Энергия Гиббса, ее взаимосвязь с энтальпией и энтропией. Изменение энергии Гиббса в самопроизвольно протекающих процессах.
- •34. Скорость химических реакций. Закон действия масс для гомогенных и гетерогенных реакций. Сущность константы скорости. Порядок и молекулярность реакции.
- •35. Факторы, влияющие на скорость химической реакции
- •36. Влияние температуры на скорость химических реакций. Правило Вант- Гоффа. Энергия активации. Уравнение Аррениуса.
- •37. Особенности протекания гетерогенных реакций. Влияние диффузии и степень дискретности вещества.
- •38. Влияние катализатора на скорость химических реакций. Причины влияния катализатора.
- •39. Обратимые процессы. Химическое равновесие. Константа равновесия.
- •41. Определение раствора. Физико-химические процессы при образовании растворов. Изменение энтальпии и энтропии при растворении.
- •42. Способы выражения концентрации растворов.
- •43. Закон Рауля
- •44. Осмос. Осмотическое давление. Закон Вант-Гоффа.
- •45. Растворы электролитов. Сильные и слабые электролиты. Степень электролитической диссоциации. Изотонический коэффициент.
- •47. Реакция в растворах электролитов, их направленность. Смещение ионных равновесий.
- •48. Ионное произведение воды. Водородный показатель как химическая характеристика раствора.
- •49. Гетерогенные равновесия в растворах электролитов. Произведение растворимости
- •50. Гидролиз солей, его зависимость от температуры, разбавления и природы солей (три типичных случая). Константа гидролиза. Практическое значение в процессах коррозии металла.
- •51. Химическое равновесие на границе металл-раствор. Двойной электрический слой. Скачок потенциала. Водородный электрод сравнения. Ряд стандартных электродных потенциалов.
- •52. Зависимость электродного потенциала от природы веществ, температуры и концентрации раствора. Формула Нернста.
- •53. Гальванические элементы. Процессы на электродах. Эдс гальванического элемента.
- •54. Обратимые источники электрической энергии. Кислотные и щелочные аккумуляторы.
- •56. Электролиз растворов и расплавов. Последовательность электродных процессов. Перенапряжение и поляризация.
- •57. Взаимодействие металлов с кислотами и щелочами.
- •58. Коррозия металлов в растворах солей.
- •59. Применение электролиза в промышленности.
- •61. Методы борьбы с коррозией.
35. Факторы, влияющие на скорость химической реакции
Скорость химической реакции зависит от:
1)от природы реагирующих веществ.Поскольку химическая природа различных веществ неодинакова, они обладают разными химическими свойствами, разной реакционной способностью.
2)от концентрации участников реакции. Необходимым условием реакции является столкновение частиц веществ друг с другом, поэтому скорость реакции пропорциональна числу соударений, которые претерпевают частицы реагирующих веществ. Число соударений, в свою очередь, тем больше, чем выше концентрация каждого из исходных веществ
3) от Т.При увеличении температуры на 10 градусов, скорость увеличивается в 2-4 раза. Причина влияния заключается в количестве активных молекул. Только частицы, обладающие повышенной энергией - активные частицы, способны осуществить акт химической реакции, следовательно, для того, чтобы реакция протекала с заметной скоростью, неактивные частицы нужно перевести в активное состояние, сообщив им недостающую энергию. Эта энергия называется энергией активации. K=A*e^(-E/RT). А – постоянная, отражающая вероятность столкновения реагирующих молекул.
4) от катализатора. В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причем эти стадии энергетически более доступны.
36. Влияние температуры на скорость химических реакций. Правило Вант- Гоффа. Энергия активации. Уравнение Аррениуса.
Впервые количественную оценку влияния температуры дал Вант-Гофф. V2=V1*γ^(t2-t1)/10 (γ=2-4). При увеличении температуры на 10 градусов, скорость увеличивается в 2-4 раза.
Энергия активации-
энергия которой должна обладать молекула
чтобы вступить в химическую реакцию..
K=A*e^(-E/RT). А – постоянная, отражающая
вероятность столкновения реагирующих
молекул.
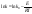 -эмпирическое
уравнение Аррениуса.
-эмпирическое
уравнение Аррениуса.
37. Особенности протекания гетерогенных реакций. Влияние диффузии и степень дискретности вещества.
Гетерогенные реакции протекают на границе (поверхности) раздела фаз, например между веществами, находящимися в жидкой и твердой фазах.
Любые гетерогенные процессы связаны с переносом вещества, и в них можно выделить три стадии: 1) Подвод реагирующего вещества к поверхности. 2) Химическая реакция на поверхности Имеется в виду собственно химическое взаимодействие молекул на поверхности раздела фаз. 3) Отвод продукта реакции от поверхности.
Первая и последняя стадии осуществляются за счет диффузии. Во многих случаях химическая реакция могла бы протекать очень быстро, если подвод реагирующего вещества к поверхности и отвод продуктов от нее тоже происходили бы достаточно быстро. Такие процессы называются диффузионно-контролируемыми, т.к. скорость определяется скоростью переноса вещества (диффузией). Для ускорения таких реакций обычно используют перемешивание.
Если химическая реакция (вторая стадия) имеет высокую энергию активации, то эта стадия оказывается самой медленной, и процесс не ускоряется при перемешивании. Такие гетерогенные реакции называются кинетически- контролируемыми. Для их ускорения необходимо повысить температуру.
Стадия, определяющая скорость протекания реакции, называется лимитирующей стадией. Для диффузионно-контролируемых процессов такой стадией является перенос вещества (1-я или 3-я стадии), а кинетически контролируемые процессы лимитируются 2- й стадией. Скорость любого гетерогенного процесса возрастает при увеличении поверхности контакта фаз. Для этого используют измельчение твердой фазы.
