
Журнал неврологии и психиатрии / 2009 / NEV_2009_03_01
.pdf
ОБЩИЕ ВОПРОСЫ НЕВРОЛОГИИ И ПСИХИАТРИИ
Развивающийся, инволюционирующий мозг, цереброваскулярные заболевания и эпилепсия
В.А. КАРЛОВ
Developing brain, involutional brain, cerebrovascular diseases and epilepsy
V.A. KARLOV
Кафедра нервных болезней лечебного факультета, Московский государственный медико-стоматологический университет
Анализируются возможные механизмы особенностей распределения идиопатической и симптоматической эпилепсии в детском и пожилом возрасте. Основным механизмом для идиопатической эпилепсии является дефицитарность ингибиторных систем в префронтальной коре: в детском возрасте в связи с ее более поздним вызреванием, в пожилом
— в связи с ее прогрессирующей инволюцией. Это объясняет резистентность к АЭП идиопатических форм эпилепсии в пожилом возрасте. Цереброваскулярные заболевания — главный фактор симптоматической эпилепсии пожилых, она характеризуется доброкачественностью течения.
Ключевые слова: развивающийся мозг, инволюционирующий мозг, идиопатическая эпилепсия, симптоматическая
эпилепсия, префронтальная кора, прогноз.
Possible mechanisms of peculiarities in the population distribution of idiopathic and symptomatic epilepsy are analyzed. The insufficiency of inhibition systems in the prefrontal cortex due to the later maturation in children and progressive involution in old age is a basic mechanism of idiopathic epilepsy. This factor explains the therapeutic resistance to antiepileptic drugs in the old age. Cerebrovascular diseases are the main factor of symptomatic epilepsy that has a benign prognosis in aged people.
Key words: developing brain, involutional brain, idiopathic epilepsy, symptomatic epilepsy, prefrontal cortex, prognosis.
Внастоящее время тезис о том, что эпилепсия в большинстве случаев начинается в детстве, подвергается сомнению [19]. Увеличение продолжительности жизни и возрастание когорты пожилых людей дали возможность выявить второй пик эпилепсии — в пожилом и старческом возрасте. Причем это касается как эпилепсии в целом, так
иотдельных типов эпилептических припадков [13, 14]. Можно предположить наличие общих факторов возникновения эпилепсии в этих возрастных группах.
Как известно, в происхождении эпилепсии лежат два кардинальных фактора: генетическая предрасположенность и экзогенные воздействия, приводящие к органическому поражению головного мозга. Это позволило в свое время С.Н. Давиденкову рассматривать популяцию больных эпилепсией как континиум, где крайние варианты представлены идиопатической (ИЭ) и симптоматической (СЭ) эпилепсией.
Впожилом возрасте отмечается рост заболеваемости эпилепсией — весьма значительный для СЭ и незначительный для ИЭ.
Влитературе мало данных об этом аспекте проблемы эпилепсии: обычно анализируют больных с дебютом эпилепсии после 30 и/или 40 лет. Имеются лишь отдельные публикации с описанием ИЭ с дебютом в пожилом возрасте [15, 16, 18, 20—22, 24, 28].
Вразное время к нам обратились за помощью 1200 больных эпилепсией старше 40 лет, в числе которых были 77 (6,4%) с диагнозом ИЭ.
©В.А. Карлов, 2009
Zh Nevrol Psikhiatr Im SS Korsakova 2009;109:3:4
Внастоящее время мы располагаем выборкой из 14 пациентов с ИЭ с дебютом заболевания после 40 лет, из них 8 — после 60 лет. В таблице их характеристика по формам эпилепсии представлена в сопоставлении с группой пациентов старше 40 лет, но заболевание у которых развилось в детском и подростковом возрасте, т.е. они перешли из этой возрастной группы (52 больных).
Выявляются две группы больных эпилепсией после 40 лет — с «продолженной» эпилепсией детства — 5,6% и эпилепсией de novo 1,2%.
Впределах 2-й группы (см. таблицу), т.е. среди 14 больных с началом заболевания после 40 лет, их распределение по возрасту дебюта эпилепсии было следующим: от 40 до 45 лет — у 2 пациентов, от 46 до 50 — у 1, от 51 до 55 — у 2, от 56 до 60 — у 1, от 61 до 65 — у 2, от 66 — до 70 — у 1, от 71 до 75 — у 2 и старше 75 — у 3.
Заметим, что ИЭ позднего возраста в отличие от эпилепсии детей и молодых людей характеризуется фармакорезистентностью [5, 8, 9, 14, 17, 24—26] — обстоятельство, не получившее до сих пор адекватного объяснения.
Поскольку с возрастом нарастает как старение мозга, так и частота цереброваскулярных заболеваний (ЦВЗ), возникает вопрос: какие из этих факторов ответственны за ИЭ и какие — за СЭ пожилых, или это один и тот же фактор? Так как факторы эпилептогенности детского мозга хорошо изучены, обратимся сначала к ним. Главными особенностями развивающего мозга в аспекте его повышенной эпилептогенности являются преобладание системы возбуждения над ингибиторной, слабость системы антиэпилептической защиты, ключевым элементом которой является лобная (префронтальная) кора [2—5].
Что касается инволюционирующего (претерпевающего обратное развитие) мозга, то основополагающие работы по
4 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 3, 2009 |
ИНВОЛЮЦИОНИРУЮЩИЙ МОЗГ, ЦЕРЕБРОВАСКУЛЯРНЫЕ ЗАБОЛЕВАНИЯ, ЭПИЛЕПСИЯ
Идиопатическая эпилепсия у взрослых (старше 40 лет)
Группа |
Типы приступов |
n |
% |
1-я |
ЮМЭ |
25 |
42,4 |
|
ГТКП |
13 |
22,4 |
|
ДАЭ |
9 |
15,3 |
|
ЮАЭ |
5 |
8,3 |
2-я |
ГТКП |
7 |
50 |
|
МЭ |
4 |
28,6 |
|
Абс.Э |
3 |
21,4 |
Примечание. 1-я группа — перешедшие из детского и подросткового возраста (52 человека), 2-я группа — с дебютом после 40 лет (14 человек). ЮМЭ — юношеская миоклоническая эпилепсия, ГТКП — генерализованные тонико-клонические припадки, ДАЭ — детская абсансная эпилепсия, ЮАЭ — юношеская абсансная эпилепсия, МЭ — миоклоническая эпилепсия, Абс.Э — абсансная эпилепсия.
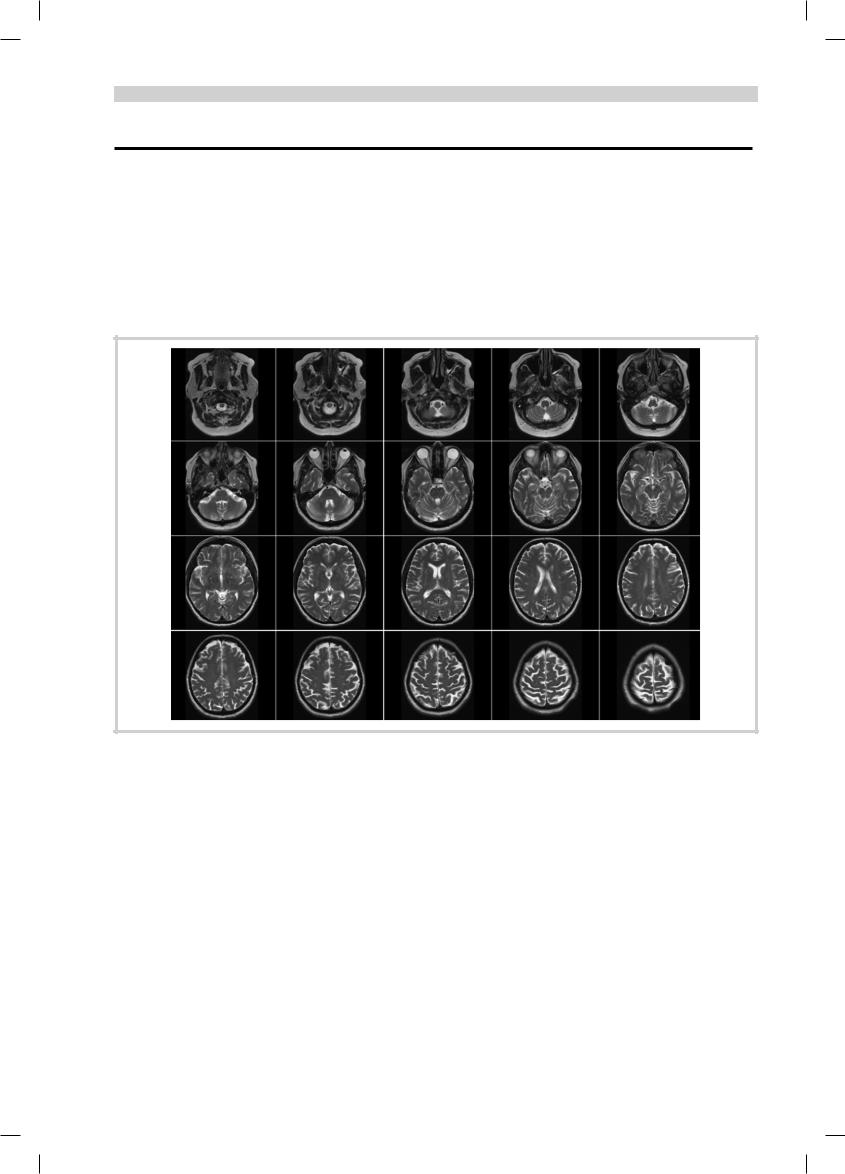
Рис. 1. МРТ пациентки П., 100 лет, Т2-ВИ.
Аксиальный срез. Мелкоочаговые изменения, легкое расширние субарахноидальных пространств в переднелобной области. Отсутствие гидроцефалии и лейкоареоза.
морфологии, биохимии и нейрофизиологии были выполнены еще в 60—80-х годах прошлого столетия [6, 7]. Полученные данные в последующем были подтверждены современными методами нейровизуализации, гистохимии, спектрографии и др. [1, 10, 12, 23, 26, 27].
Их можно суммировать следующим образом. Целостный мозг. Имеет место атрофия паренхимы,
которая в значительной степени носит избирательный характер, преимущественно затрагивая лобную (префронтальную) кору, а также гиппокамп, поясную и парагиппокампальную извилины, черную субстанцию, клетки Пуркинье мозжечка, т.е. поражаются наиболее филогенетически молодые отделы мозга и области с высокой плотностью нейронов. Результатом является недостаточность системы антиэпилептической защиты и активация эпилептогенных структур.
Нейроны. Была обнаружена дегенерация их тел и дендритов, уменьшение и изменение синапсов, появление внутриклеточных депозитов. Результатом этих изменений является денервационная сверхчувствительность.
Глия. Эти клетки отличает сочетание гипертрофии и гиперплазии с распадом глиальных клеток, дегенерация пограничных мембран. В результате нарушается аккумуляторная функция глии, увеличивается содержание внеклеточного калия, нарастает деполяризация мембран.
Апоптоз. Речь идет о каскаде изменений, каждое из звеньев которого может способствовать деполяризации клетки: активация Са2+ каналов, повышение уровня внутриклеточного Са2+ , эксайтдемпинг, оксидантный стресс. В результате этих изменений нестабильность клеточных мембран, деполяризация.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 3, 2009 |
5 |
ОБЩИЕ ВОПРОСЫ НЕВРОЛОГИИ И ПСИХИАТРИИ
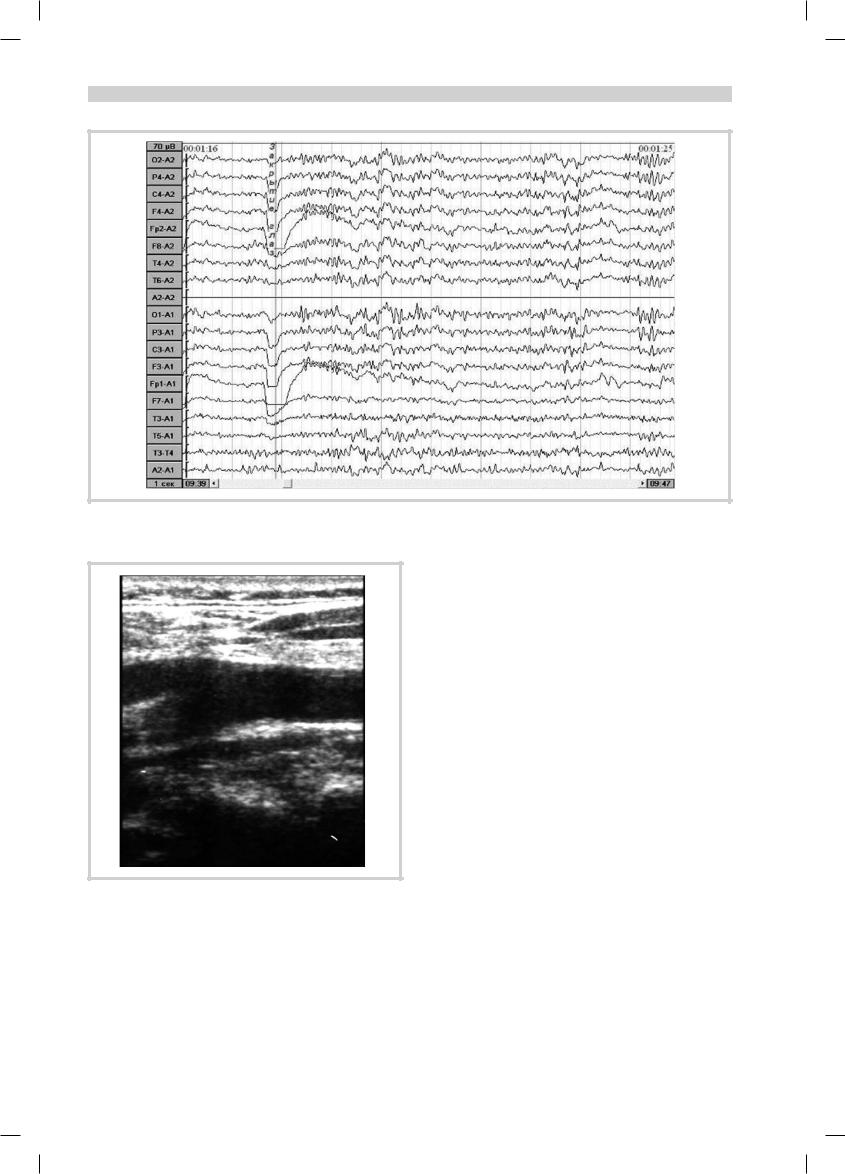
Рис. 2. Фрагмент ЭЭГ больного Ш., 80 лет.
Монотонность ЭЭГ с выраженностью α-ритма по всем отведениям с эпизодами его периодического замедления и избыточной синхронизации.
Рис. 3. Дуплексное сканирование, бифуркация общей сонной артерии пациентки, 79 лет.
Просвет сосуда сохранен, комплекс интима-медиа повышенной эхогенности, на слои дифференцирован, существенно не утолщен.
Таким образом, изменения в инволюционизирующем (стареющем) мозге многообразны, но и они прежде всего проявляются в структурно-функциональных сдвигах в префронтальной коре, вызывая недостаточность системы антиэпилептической защиты.
При анализе больных эпилепсией пожилого возраста по критериям и соотношению инволюционирующий мозг
— цереброваскулярные заболевания (ЦВЗ), «идиопатическая — симптоматическая эпилепсия» было установлено, что среди 162 больных с ЦВЗ не было пациентов с ИЭ, т.е. все пациенты страдали СЭ (у 85% из них была неврологическая симптоматика, характеризующая нарушение мозгового кровообращения), а среди 14 пациентов с ИЭ 12 были практически здоровы (при УЗИ и МРТ у них имелись только возрастные изменения).
Приведенные нами совместно с Институтом неврологии РАМН МРТ-исследования здоровых людей пожилого и старческого возраста (70—100 лет) выявили относительную сохранность головного мозга. Основные изменения — атрофия передних отделов лобной доли (префронтальная кора), незначительная внутренняя и/или наружная гидроцефалия, в некоторых случаях мелкоочаговые изменения. Характерно отсутствие лейкоареоза (рис. 1). На ЭЭГ лиц пожилого и даже старческого возраста хорошо сохраняется доминирующий α-ритм, хотя и наблюдается тенденция к его замедлению и повышению индекса медленной, в основном θ-активности (рис. 2). Что касается мозгового кровотока, то было отмечено его замедление с возрастом, падение реактивности сосудов, максимально выраженное в префронтальном и височном регионе. То же относится к церебральному метаболизму (по литературе падение метаболизма глюкозы максимально выражено в лобной коре [8]). Согласно исследованиям нашей кафедры, при дуплексном сканировании также не было обнаружено существенных изменений (рис. 3).
Таким образом процессы, происходящие в инволюционирующем мозге, являются факторами, способствующими развитию ИЭ. Редкость ИЭ у пожилых объясняется
6 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 3, 2009 |

ИНВОЛЮЦИОНИРУЮЩИЙ МОЗГ, ЦЕРЕБРОВАСКУЛЯРНЫЕ ЗАБОЛЕВАНИЯ, ЭПИЛЕПСИЯ
значительным исчерпыванием генетического фактора за счет его реализации в более молодом, главным образом детском возрасте. Основным обстоятельством, способствующим реализации генетического фактора, является недостаточность системы антиэпилептической защиты прежде всего префронтальной коры. Это обусловливает неблагоприятный прогноз ИЭ у пожилых, в то время как у детей с ИЭ прогноз обычно благоприятный.
Цереброваскулярные заболевания являются фактором риска симптоматической эпилепсии, в происхождении которой основное значение имеют процессы в регионе очага поражения — эпилептизация нейронов, формирование эпилептического очага. Симптоматическая эпилепсия при таких заболеваниях, как правило, обладает хорошей курабельностью.
ЛИТЕРАТУРА
1.Завалишин И.А., Яхно Н.Н., Гаврилова С.И. (ред). Нейродегенеративные изменения и старение. Изменения центральной нервной системы при старении: 243—258.
2.Карлов В.А., Петренко С.Е. Значение функционального состояния орбито-фронтальной коры и хвостатого ядра в эпилептогенезе. Труды конференции «Нейрофизиологические механизмы эпилепсии». Тбилиси: Мецницерба 1980; 221—228.
3.Карлов В.А. Детская эпилептология как инструмент познания развивающегося мозга. Журн неврол и психиат 2002; 4: 5—6.
4.Карлов В.А. Судорожный эпилептический статус. М: Медпресс 2003.
5.Карлов В.А., Гнездицкий В.В. Абсансная эпилепсия у детей и взрослых. М: Прессмедсервис 2005.
6.Маньковский Н.Б., Минц А.Я., Белоног Р.П. Клинико-физиологические аспекты старения мозга. Вестник АМН СССР 1984; 3: 45—52.
7.Фролькис В.В., Безруков В.В. Старение центральной нервной системы. Физиология человека 1978; 4: 506—619.
8.Adams R.D., Victor M., Ropper A.H. Principles of Neurology. 6th ed. New York: McGraw-Hill 1997;
9.Andermann F., Bercovic S.F. Idiopathic generalized epilepsy with generalized and ather seizures in adolescence. Epilepsia 2001; 42: 317—331.
10.Baskerville K.A., Kent C., Personett D. et al. Ageing elevated metabolic gene expression in brain cholinergic neurons. Neurol Agеing 2007; 7.
11.Bernandina B.D., Sgro V., Fejerman N. Epilepsia with centro-temporal spikes and related syndromes. In: J. Roge et al. (eds.). Epileptic Syndromes in Infancy, Childhood and Adolescence. Fourth edition. France: John Libbey Eurotext 2005; 203—226.
12.Chuwluck J.B., Alavi A. Neuroimaging of normal brain and dementia. Neuroimaging: A companion to Adams and Victors. J.O. Crechberg (ed.). Principles of neurology. New York: McGraw-Hill 1995; 253—282.
13.Cloyd J., Hauser W., Towne A. et al. Epidemiological and medical aspects of epilepsy in the elderly. Epilepsy Res 2006; 68: 39—48.
14.Genton P., Gonzales Sanchez M., Thomas P. Epilepsia with grand mal on awakening. In: J. Roge et al. (eds.). Epileptic Syndromes in Infancy, Childhood and Adolescence. Fourth edition. France: John Libbey Eurotext 2005; 389—394.
15.Gram L., Alving J., Sagil C. et al. Juvenile myoclonic epilepsy in unexpected age group. Epilepsy Res 1988; 2: 137—140.
16.Grünewald R.A., Panayiotopoulos C.P. Juvenile myoclonic epilepsy. A review. Acta Neurol 1993; 50: 594—598.
17.Haga K.K., Khor V.P., Wardlaw J.M. A systematic review of brain metabolic changes measured with H magnetic spectroscopy in healthy aging. Neurobiol Aging 2007.
18.Hauser A., Annegers J.F., Kurland L.T. Incidence of epilepsy and unprovoked seizures in Rochester, Minnesota 1935—1984. Epilepsia 1993; 34: 435—468.
19.Hirsch E., Panayiotopoulos P. Childhood absence epilepsy and related syndromes. In: J. Roge et al. (eds.). Epileptic Syndromes in Infancy, Childhood and Adolescence. Fourth edition. France: John Libbey Eurotext 2005; 315—336.
20.Jacob S.J., Martin D., Rajabally V.A. Juvenile myoclonic epilepsy in an oldery patient. Age and Ageing 2006; 35: 194—196.
21.Luef G., Schayer R., Beuer G. Idiopathic generalized epilepsy of late oncet: a new epileptic syndrome? Epilepsia 1996; 37: Suppl 4: 4.
22.Marini C., King M.A., Archer J.S. et al. Idiopathic generalized epilepsy of adult oncet: clinical syndromes and genetics. J Neurol Neurosurg Psychiat 2003; 74: 192—196.
23.Moro F., Segova M.F., Del Arco A. Aging plasticity and environment: structural changes and neurotransmitter dynamics in several areas of the brain. Brain Res Rev 2007; 13.
24.Nishiura N., Oiwa T. Epilepsy above 70 years of age — four cases with spike and wave complet. Folia Psychiat Neurol Jap 1979; 33: 263—268.
25.Ploin P., Anderson E. Benign familial and non-familial neonatal seizures. In: J. Roge et al. (eds.). Epileptic Syndromes in Infancy, Childhood and Adolescence. Fourth edition. France: John Libbey Eurotext 2005; 3—16.
26.Raz M., Guming F., Head D. et al. Selective aging of the human cerebral cortex observed in vivo: Differential vulnerability of the prefrontal cortex. Cerebral cortex 1997; 7: 268—282.
27.Raz M., Deshpande L.S., Blair R.E. et al. Ageing in associated with elevated intracellular calcium level and altered calcium homeostatic mechanisms in hippocampal neurons. Neurosci Lett 2007; 418: 77—81.
28.Thomas P., Beaumanoir A., Genton P., Chatel M. De novo absence status of late onset: reparted of 11 cases. Neurology 1992; 42: 104—110.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 3, 2009 |
7 |
