
Журнал неврологии и психиатрии / 2009 / NEV_2009_10_11
.pdf
Изучение ассоциации полиморфизма гена SCN1 с эффективной дозой ламотриджина
Е.В. КРИКОВА2, д.м.н. Е.А. ВАЛЬДМАН2, проф. Г.Н. АВАКЯН1, Я.А. АНДРЕЕВ3, м.н.с., асп. Е.В. ДЕНИСОВ4,5, к.м.н. Ф.К. РИДЕР1, н.с. Р.Р. БИКТИМЕРОВ6, асп. А.С. ЧУКАНОВА1, д.м.н. С.Г. БУРД1
Association study of the SCN1 gene polymorphism and effective dose of lamotrigine
E.V. KRIKOVA, E.A. VALDMAN, G.N. AVAKYAN, YA.A. ANDREEV, E.V. DENISOV, F.K. RIDER, R.R. BIKTIMEROV, A.S. CHUKANOVA, S.G. BURD
1Кафедра неврологии и нейрохирургии Российского государственного медицинского университета; 2НИИ фармакологии
им. В.В. Закусова РАМН; 3НИИ биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва; 4Томский государственный университет; 5НИИ онкологии Томского научного центра Сибирского отделения РАМН; 6Кафедра клинической лабораторной диагностики Российского государственного медицинского университета, Москва
Работа посвящена исследованию ассоциации полиморфизма гена SCN1 — терапевтической мишени ламотриджина — с эффективной дозой (концентрацией в плазме крови) препарата у пациентов с эпилепсией. Проведено генотипирование по SCN1 IVS5N+5 G→A 50 пациентов с различными формами эпилепсии с использованием метода полимеразной цепной реакции. Установлено распределение аллельного полиморфизма: мутантный гомозиготный генотип (V/V) был
представлен у 23 человек, у 20 выявлен гетерозиготный аллельный вариант (Wt/V) и 7 человек были гомозиготны по дикому типу гена (Wt/Wt). Средние эффективные дозы для ламотриджина составили: для носителей генотипа Wt/Wt — 85,7±7,4 мг/сут, для Wt/V — 113,75±7,13 мг/сут и для V/V — 142,4±15,43 мг/cут. Установленным различиям эффективных доз соответствовали показатели пиковой концентрации препарата в плазме: для Wt/Wt — 0,6±0,065 мг/мл, для V/V — 0,96±0,1 мг/мл и для Wt/V — 0,72±0,1 мг/мл. Подтверждена гипотеза о наличии корреляции между генетическим полиморфизмом SCN1 IVS5N+5 G→A и эффективной дозой (концентрацией) ламотриджина. Достоверно более высокая распространенность мутации SCN1A среди больных эпилепсией по сравнению с контрольной выборкой европейской этнической группы (45,5 и 21,3% соответственно) указывает на возможный вклад полиморфизма SCN1 IVS5N+5 G→A в патогенез эпилепсии.
Ключевые слова: эпилепсия, ген SCN1, генетический полиморфизм, ламотриджин.
An association between a polymorphism of the SCN1 gene, a therapeutical target of lamotrigine, and an effective dose (a blood plasma concentration) of the drug in patients with epilepsy has been studied. Fifty patients with different forms of epilepsy have been genotyped for the SCN1 IVS5N+5 G→A polymorphism using polymerase chain reaction. The distribution of allelic variants was as follows: 23 patients had the mutant homozygous genotype (V/V), 20 — the heterozygous genotype Wt/V and 7 were homozygous for the wild allele (Wt/Wt). Mean lamotrigine doses were 85,7±7,4 mg/day for carriers of the Wt/Wt genotype, 113,75±7,13 mg/day for the Wt/V genotype and 142,4±15,43 mg/day for the V/V genotype. Peak plasma concentrations corresponded to effective doses were 0,6±0,065 mg/ml for Wt/Wt, 0,96±0,1 mg/ml for V/V and 0,72±0,1 mg/ml for Wt/V. The hypothesis on the association between the SCN1 IVS5N+5 G→A polymorphism and the effective dose (concentration) of lamotrigine was confirmed. The significantly higher frequency of the SCN1A mutation in the group of patients with epilepsy compared to the control group of Caucasians (45,5 and 21,3%, respectively) implies that this polymorphism may contribute to the pathogenesis of epilepsy.
Key words: epilepsy, SCN1 gene, gene polymorphism, lamotrigine.
|
Изучение фармакодинамики антиэпилептических |
новлена связь полиморфизма потенциал-зависимого на- |
|
препаратов (АЭП) с биохимических и генетических пози- |
триевого канала SCN1 IVS5N+5 G→A с рефрактерностью |
||
ций является актуальной задачей современной фармако- |
к терапии карбамазепином. |
||
генетики. Имеются данные, свидетельствующие, что ге- |
Определена роль генетических факторов и в патогене- |
||
нетический полиморфизм может не только обусловливать |
зе эпилепсии. Установлены мутации в генах, которые мо- |
||
дифференциальную реакцию на терапию АЭП при эпи- |
гут детерминировать предрасположенность к заболеванию |
||
лепсии, но и коррелировать с фармакорезистентностью к |
[7], кроме того, генетические полиморфизмы в определен- |
||
определенным препаратам. Например, в исследовании |
ной степени могут обусловливать фенотип эпилепсии, что |
||
[2], выполненном в когорте японских пациентов, уста- |
в свою очередь определяет тяжесть заболевания [9]. |
||
|
|
|
|
|
© Коллектив авторов, 2009 |
1e-mail: burds@yandex.ru |
|
|
Zh Nevrol Psikhiatr Im SS Korsakova 2009;109:10:57 |
|
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2009 |
57 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
Таким образом, идентификация и изучение аллельных вариантов, ассоциированных с эпилепсией, а также исследование потенциальной корреляции между генетическим полиморфизмом и ответом на фармакотерапию представляются важными задачами для понимания этиологических причин заболевания и создают предпосылки для персонализированного подхода к терапии эпилепсии.
Современное лечение эпилепсии подразумевает использование как традиционных, так и новых АЭП, одним из новых АЭП является ламотриджин. При монотерапии первично диагностированной эпилепсии ламотриджин демонстрирует сходный эффект с фенитоином и карбамазепином [5, 10, 15]. В экспериментальных исследованиях на моделях эпилепсии in vitro и in vivo также установлены сходные эффекты ламотриджина, фенитоина и карбамазепина [12, 18]. В работах Y. Yang и C. Kuo [17, 18] было показано, что фенитоин, карбамазепин и ламотриджин имеют один и тот же сайт связывания, расположенный с внешней стороны нейронального натриевого канала.
Однако, несмотря на значительное сходство в механизме действия (блокада нейрональных натриевых каналов в инактивированном состоянии), фенитоин, карбамазепин и ламотриджин имеют различную химическую структуру. Фенитоин — гидантоин, содержащий ацилкарбамид, который традиционно рассматривается как важная структурная основа, отвечающая за антиэпилептическую активность. Карбамазепин не содержит ацилкарбамида и представляет собой трициклическое соединение с карбамоильной группой. Ламотриджин является более простым соединением и состоит из двух ароматических колец.
В недавних работах было показано, что антиэпилептический эффект фенитоина и карбамазепина, обусловленный их взаимодействием с натриевым каналом, ассоциирован с генетическим полиморфизмом SCN1 IVS5N+5 G→A в интронной области 5N экзона, кодирующего сенсор напряжения канала. Так, в европейской и китайской популяциях наблюдается корреляция в направлении AA→GA→GG (гомозиготного мутантного → гетерозиготного → дикого типа) аллельных вариантов гена SCN1 для доз указанных АЭП от наибольшей к наименьшей [8, 16].
Учитывая, что нейрональные натриевые каналы являются терапевтической мишенью также и для ламотриджина, нами была выдвинута гипотеза о возможной корреляции между эффективной терапевтической дозой данного препарата и генетическим полиморфизмом гена SCN1 IVS5N+5 G→A.
Целью работы явилось изучение связи полиморфизма гена SCN1 IVS5N+5 G→A с эффективной терапевтической дозой ламотриджина и его концентрацией в плазме крови у пациентов с различными формами эпилепсии.
Материал и методы
Обследованы 50 пациентов в возрасте от 20 до 69 лет (средний возраст — 46 лет) с различными формами эпилепсии и длительностью заболевания от 6 мес до 42 лет (средняя длительность — 6 лет). Включенные в исследование пациенты находились на амбулаторном учете в окружных эпилептологических кабинетах г. Москвы. На этапе скрининга всем пациентам проводились клиниконеврологическое и электроэнцефалографическое обследования, КТ или МРТ головного мозга. Диагноз эпилепсии был установлен на основе Международной классифи-
кации эпилепсии (1989 г.). Тип эпилептических припадков определялся согласно Международной классификации эпилептических приступов (1981 г.). Симптоматическая фокальная эпилепсия (СФЭ) была диагностирована у 27 (54%) пациентов, криптогенная фокальная эпилепсия (КФЭ) при отсутствии структурной патологии головного мозга — у 22 (44%) больных, идиопатическая генерализованная эпилепсия (ИГЭ) — у 1 (2%) человека.
Среди обследованных пациентов было 34 женщины и 16 мужчин, причем большинство женщин были репродуктивного возраста (16—45 лет) — 22 (64,7%) человека, которые наряду с АЭП принимали гормональные контрацептивы. Из литературы известно, что при одновременном приеме стероидных контрацептивов и ламотриджина плазменная концентрация АЭП может снижаться примерно на 50%, по-видимому, за счет индуцированной стероидами активации UGT1A4 [11, 13]. Данное взаимодействие клинически может выражаться в снижении контроля приступов у определенного процента женщин [14], а также повлиять на дозу принимаемого ламотриджина. Таким образом, во избежание возможных некорректных результатов при анализе ассоциации между генетическим полиморфизмом SCN1 IVS5N+5 G→A и эффективной терапевтической дозой ламотриджина проводили определение концентрации ламотриджина в плазме крови пациентов с последующим построением графика зависимости концентрации от генотипа.
Обязательным критерием включения в исследование являлся адекватный ответ на монотерапию ламотриджином, т.е. урежение приступов не менее чем на 50%. Разброс доз ламотриджина составил от 50 до 300 мг/сут. В исследовании был использован препарат ламотриджина в лекарственной форме ламитор.
Для выделения высокомолекулярной геномной ДНК использовали фенол-хлороформный метод. Полимеразную цепную реакцию (ПЦР) проводили с использованием прямого праймера 5’ GAT CGA ATT CCC AGA GTG ACA ACA AGG GTG T 3’ и обратного 5’ GAT CGG ATC CGG TCA CCT TGA CCT CAA ATT ACA 3’. Реакционная смесь (50 мкл) содержала буфер для ПЦР (50 мМ КСl, 10 мМ три-НСl с рН 8,3, 1,5—2,0 мМ MgCl2), смесь 4 dNTP (0,2 мМ каждый), праймерные олигонуклеотиды (10—20 пмоль каждого), 1—10 нг ДНК и 2,5 ед. акт. полимеразы. Условия ПЦР: денатурация (930) — 50 с, отжиг (550—670)
— 40 с, элонгация (720) — 1 мин 30 с. Электрофорез тотальной ДНК и продуктов ПЦР проводился на горизонтальных пластинах 1% и 1,5% агарозного геля (в зависимости от размеров продуктов ПЦР), приготовленного на буфере для электрофореза (трис-ацетатный буфер ТАЕ) с добавлением бромистого этидия. Нуклеиновые кислоты в геле регистрировали по флюоресценции в проходящем ультрафиолете с длиной волны 360 нм. Для обработки результатов использовали систему для видеодокументации гелей DNA analyzer.
После проведения электрофореза проводили выделение ДНК из агарозного геля с последующим высаживанием фенол-хлороформом и промывкой 1 мл 75% этанола, после чего осадок подсушивали на воздухе и растворяли в 20 мкл воды. Секвенирование SCN1A в составе ПЦРфрагментов проводилось на автоматическом секвенаторе (Model 373A Applied Biosistems, США).
Измерение концентрации препарата проводилось также для исключения низкой комплаентности пациен-
58 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2009 |
|
ФАРМАКОГЕНЕТИКА |
тов. Определение пиковой концентрации ламотриджина |
|
в сыворотке крови проводили методом высокоэффектив- |
|
ной жидкостной хроматографии с использованием метода |
|
высаливания препарата, с предварительной депротеини- |
|
зацией на обращенно-фазной хроматографической ко- |
|
лонке Nova Pak C18, зернением 5 мкм, с использованием |
|
предколонки Guard-PakTM μ-BondapakTM C18 10-Pack |
|
при оптимальной длине волны спектрофотометрического |
|
детектора Shimadzu SPD-10Avp, составляющей 225 нм. |
|
Буфер для внесения образцов: 20% ацетонитрила, 80% |
|
деионизированной воды, 0,3% триэтиламина (Fluka), |
|
0,2% концентрированной фосфорной кислоты. Промы- |
|
вочный буфер: 70% ацетонитрила, 20% деионизирован- |
|
ной воды. Буфер для элюции: 20% ацетонитрила, 80% де- |
|
ионизированной воды, 0,3% триэтиламина (Fluka), 0,2% |
|
концентрированной фосфорной кислоты (Реахим). Объ- |
|
емная скорость элюирования составила 0,5 мл/мин. Ко- |
|
эффициент корреляции r=0,998. Относительная ошибка |
|
определения ламотриджина при концентрации препарата |
|
в контрольном образце 2 мкг/мл составила 7,8%. Предел |
|
детектирования составил 25 нг/мл. |
|
Статистический анализ проводился с использовани- |
|
ем пакета статистической программы Statistica.6. Для |
|
определения статистической значимости различий частот |
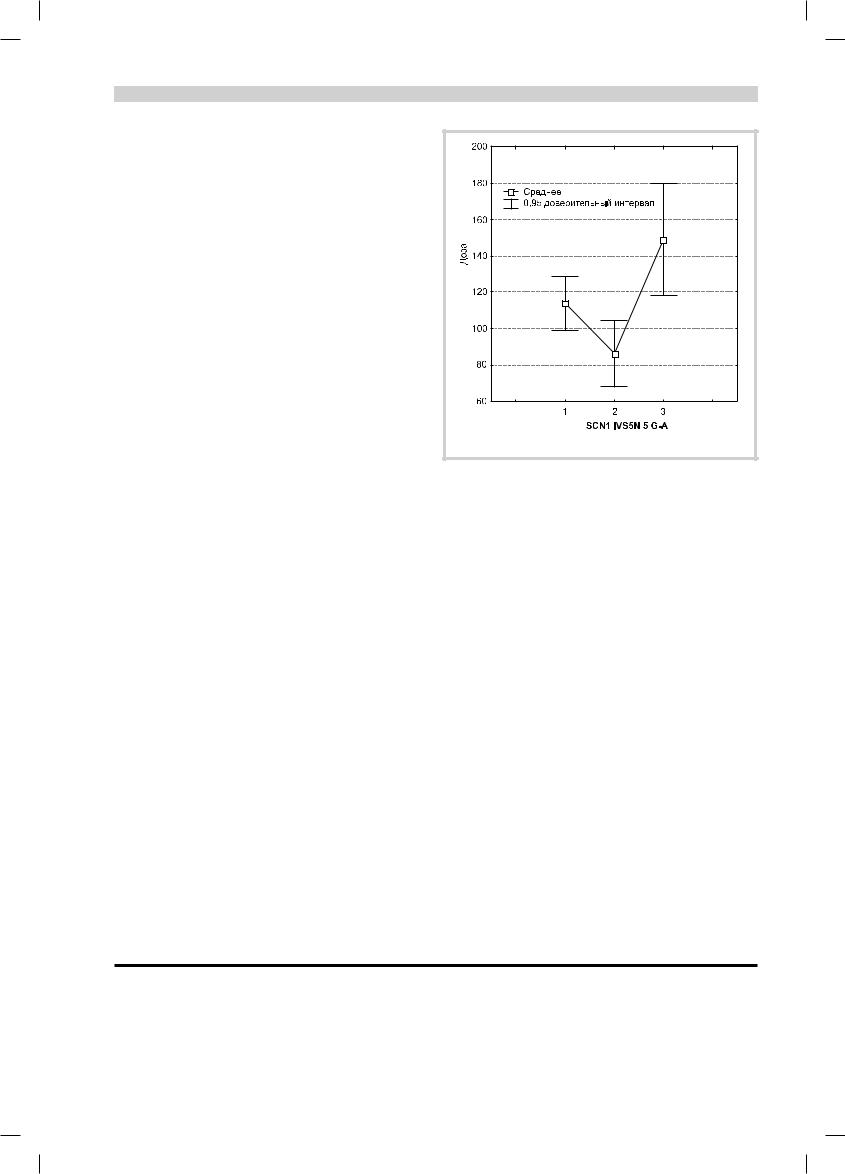
Рис. 1. Зависимость эффективной терапевтической дозы ламо- |
аллелей и генотипов в группах больных применялся кри- |
|
терий χ2, для аллелей применялась поправка Йейтса на |
триджина от генетического полиморфизма SCN1 IVS5N+5 |
непрерывность. Рассчитывались относительные риски. |
G→A. |
Статистическую значимость различий в концентрации |
Больным с гетерозиготным генотипом требуются |
ламотриджина в плазме крови в группах больных опреде- |
|
ляли с помощью непараметрического метода Манна— |
меньшие дозы препарата в отличие от гомозиготных по |
Уитни. |
мутантному аллелю гена SCN1, для которых клинический |
Результаты и обсуждение |
эффект проявляется на фоне терапии более высокими до- |
зами ламотриджина (р=0,03). Достоверная корреляция |
|
В результате генотипирования было установлено, что |
между дозой и аллельным вариантом гена SCN1 была по- |
лучена также для Wt/Wt и V/V генотипов (см. рис. 2). У |
|
аллельный полиморфизм интронной области SCN1 IVS5N |
носителей генотипа дикого типа Wt/Wt терапевтически |
представлен тремя вариантами: Wt/Wt — гомозиготный |
эффективной была достоверно более низкая доза, чем у |
дикий тип, Wt/V — гетерозиготный и V/V — мутантный |
пациентов с мутантным генотипом (р=0,01). |
гомозиготный тип. При анализе распределения генетиче- |
Таким образом, полученные нами результаты по со- |
ского полиморфизма в зависимости от формы эпилепсии |
отношению эффективных доз ламотриджина и генетиче- |
был выявлен 1 (2%) пациент с ИГЭ, при этом был пред- |
ского варианта гена SCN1 соответствуют таковым для фе- |
ставлен только гомозиготный генотип V/V; с СФЭ — 22 |
нитоина и карбамазепина [8, 16] и корреляция прослежи- |
(44%), из них с генотипом Wt/Wt — 3, с Wt/V — 10 и с V/V |
вается в направлении AA→GA→GG (V/V→Wt/V→Wt/Wt) |
— 9 человек; с КФЭ — 27 (54%), из них с Wt/Wt — 4, Wt/V |
генотипов для доз АЭП от наибольшей к наименьшей со- |
— 10 и с V/V — 13 человек (см. таблицу). Следует отметить |
ответственно (p<0,05). |
достаточно низкую представленность варианта дикого ти- |
При объединении пациентов, для которых эффектив- |
па Wt/Wt — 7 человек в исследуемой выборке, тогда как |
ная терапевтическая доза ламотриджина находилась в ди- |
группу с мутантным генотипом V/V составили 23 пациен- |
апазоне 50—100 мг в группу 1, 125—200 мг — в группу 2 и |
та, с гетерозиготным — 20. |
250—300 мг — в группу 3, был проведен дополнительный |
Средние эффективные дозы для ламотриджина соста- |
анализ распределения генотипов SCN1 IVS5N (5G>A) в |
вили для носителей генотипа Wt/Wt — 85,7±7,4 мг/сут, |
зависимости от терапевтического интервала ламотриджи- |
Wt/V — 113,75±7,13 мг/сут и V/V — 142,4±15,43 мг/cут. |
на. Исходя из полученных данных, можно сделать вывод, |
Результаты статистической обработки полученных дан- |
что в случае мутантного аллельного варианта эффект от |
ных подтверждают достоверность зависимости средней |
терапии ламотриджином наблюдается в широком диапа- |
дозы ламотриджина от генотипа (рис. 1). |
зоне доз, захватывая верхнюю границу в 300 мг/сут, а у |
Распределение пациентов, принимающих ламотриджин, в зависимости от формы эпилепсии и аллельного полиморфизма гена SCN1 IVS5N+5 G→A
Генотип |
|
Форма эпилепсии |
|
|
Всего |
|
ИГЭ |
СФЭ |
КФЭ |
абс. |
% |
||
|
||||||
Wt/Wt |
0 |
3 |
4 |
7 |
14 |
|
Wt/V |
0 |
10 |
10 |
20 |
40 |
|
V/V |
1 |
9 |
13 |
23 |
46 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2009 |
59 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
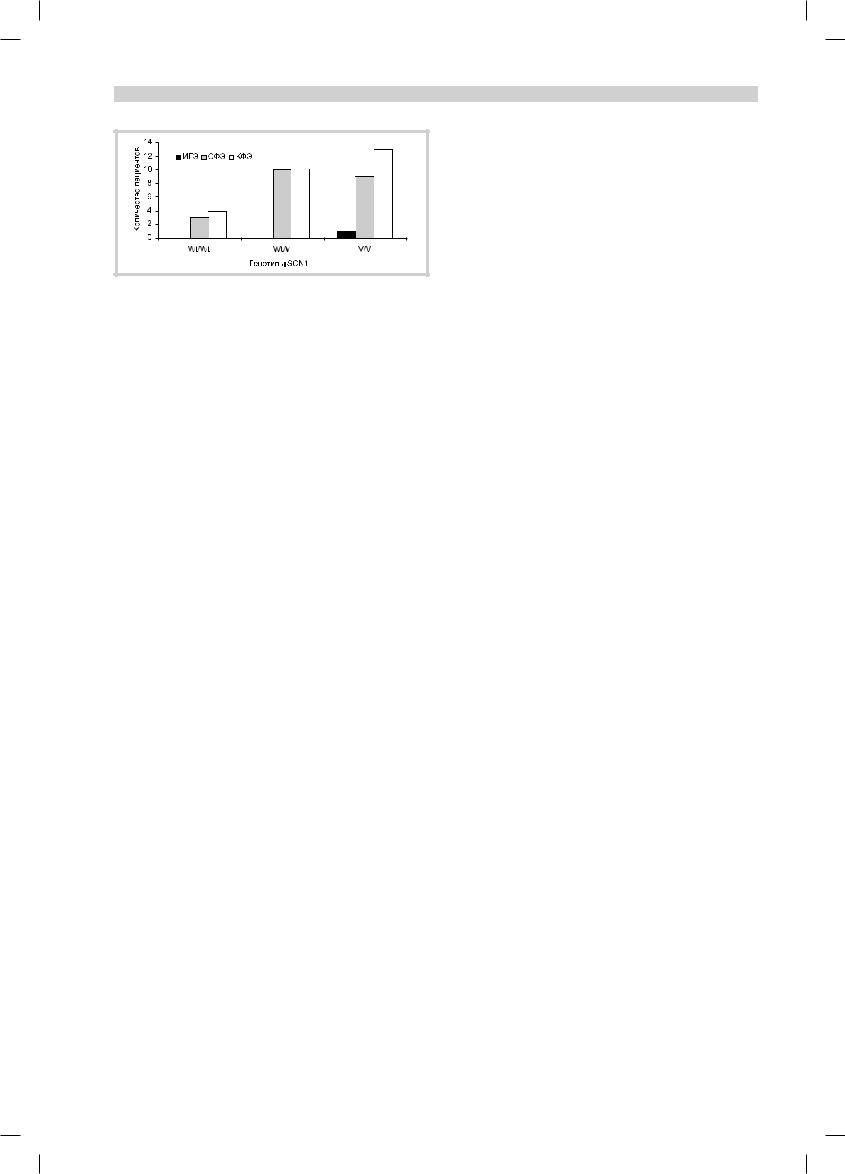
Рис. 2. Распределение генотипов SCN1 IVS5N (5G>A) в зависи- |
мости от эффективной терапевтической дозы ламотриджина. |
Рис. 3. Оценка ассоциации терапевтически эффективной кон- |
центрации ламотриджина в плазме крови и генетического по- |
лиморфизма SCN1 IVS5N+5 G→A. |
носителей гетерозиготного генотипа верхний порог терапевтически эффективного интервала доз представлен 200 мг/сут. При наличии GG генотипа (дикий тип) эффективность исследуемого препарата регистрируется в более узком дозовом интервале — 50—100 мг/сут. Указанные нами интервалы (1, 2, 3) соответствуют низким, средним и высоким дозам ламотриджина, как правило, назначаемым в клинической практике. Таким образом, результаты нашего исследования позволяют построить модель зависимости терапевтических диапазонов ламотриджина от генотипа пациентов по SCN1 IVS5N (5G>A) (рис. 2).
В результате анализа распределения генетического полиморфизма от пиковой концентрации препарата в плазме крови были получены следующие значения: для Wt/Wt — 0,6±0,065 мг/мл, для V/V — 0,96±0,1 мг/мл и для Wt/V — 0,72±0,1 мг/мл. Показана достоверная корреляция между концентрацией ламотриджина и аллельным вариантом для групп Wt/Wt и V/V (рис. 3). Так, у носителей гомозиготного дикого типа наблюдалась более низкая пиковая концентрация ламотриджина в крови по сравнению с пациентами, гомозиготными по мутантному аллелю (p=0,001), что соотносится с результатами, получен-
ными при оценке корреляции между дозой и генотипом, а также соответствует линейному характеру фармакокинетики ламотриджина.
Результаты работы свидетельствуют о статистически достоверно более высокой распространенности мутации SCN1A среди пациентов с эпилепсией по сравнению с контрольной выборкой европейской этнической группы. Так, для пациентов с эпилепсией частота встречаемости данного полиморфизма в исследовании составила 45,5%, тогда как в нормальной популяции — 21,3%. Таким образом, наличие данной мутации может свидетельствовать в пользу генетически обусловленной предрасположенности к заболеванию эпилепсией (отношение шансов = 3,07, доверительный интервал (1,31; 7,32), (p<0,05).
Гипотеза о значимом вкладе наследственных факторов в развитие идиопатических генерализованных эпилепсий и детских мягких фокальных эпилепсий получила подтверждение в многочисленных клинико-генетических исследованиях. Так, в работе L. Urak и соавт. [15] было показано наличие ассоциации между ГАМКA рецептором β3- субъединицы GABRB3 гена и детской абсансной эпилепсией (ДАЭ). Были также определены гаплотипы для соответствующих областей гена GABRB3, некоторые из которых коррелировали с изменением уровня транскрипционной активности (снижение связывания нейронального специфического транскрипционного активатора N-Oct-3
сучастком промотера). Соответственно снижение экспрессии GABRB3 может потенциально обусловливать развитие ДAЭ. В другой работе в экспериментальной модели на животных было показано, что мутации в интронных, а также в 5’ нетранслируемых районах гена CACNG3 (потенциал-зависимого кальциевого канала) также могут обусловливать развитие ДАЭ [6]. Таким образом, в литературе имеются свидетельства того, что мутации, влияющие на транскрипционную активность генов нейрональных структур, а также расположенные в некодирующей области, могут обусловливать развитие определенных форм заболевания.
Более того, в последнее время появляются работы, указывающие на существование корреляции между определенными гаплотипами и СФЭ. В нашей работе, согласно анализу распределения форм эпилепсии, диагноз идиопатической эпилепсии был представлен лишь в 1 случае
сналичием гомозиготного генотипа V/V по гену SCN1. В то же время в группе с КФЭ была отмечена высокая распространенность мутантного гомозиготного аллельного варианта, а также гетерозиготного генотипа Wt/V. Та же тенденция прослеживалась и в группе с СФЭ (рис. 4).
Таким образом, высокая представленность мутации SCN1 IVS5N+5 G→A в группах СФЭ и КФЭ при одновременно низкой частоте данного полиморфизма в контрольной выборке европейской популяции может свидетельствовать о потенциальном вкладе этого полиморфизма в патогенез данных форм эпилепсии. Другими словами, на основании того, что в исследовании частота встречаемости мутантного аллельного варианта составляет 45,5% при различных формах эпилепсии, можно предположить, что мутация SCN1 IVS5N+5 G→A может сохранять латентность до вступления в силу стрессовых факторов, приводящих к развитию диагностированной симптоматической или криптогенной эпилепсии. Это согласуется с признанной в настоящее время гипотезой о более выраженном, чем считалось ранее, вкладе генетического полиморфиз-
60 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2009 |
ФАРМАКОГЕНЕТИКА
Рис. 4. Распределение форм эпилепсии в зависимости от гено- |
типов. |
ма в развитие криптогенных [7] и симптоматических эпилепсий. Однако важно отметить, что ввиду небольшой выборки в данном исследовании мы не можем говорить о статистически достоверной ассоциации каких-либо определенных типов эпилепсии с указанным выше генетическим полиморфизмом, что требует дальнейшего набора материала и его анализа.
Заключение
Продукт гена SCN1 является терапевтической мишенью действия ламотриджина [4]. На сегодняшний день описано более 200 мутаций его α-субъединицы, ассоциированных с наследуемыми эпилептическими синдромами различной степени тяжести. В гене SCN1А экзон 5 кодирует один из четырех доменов сенсора напряжения канала
— I-S4. В геноме одновременно представлены две формы альтернативного сплайсинга данного экзона — неонатальная (Н) и взрослая (В) копии, и в норме в головном мозге коэкспрессируются оба этих экзона в пропорции H>B. Полиморфизм гена SCN1 IVS5N+5 G→A, расположенный в интроне после неонатальной формы экзона 5N, определяет включение неонатального или взрослого транскрипта в структуру канала.
G-аллель (дикий тип) разрешает экспрессию обоих экзонов, а мутантный А-аллель почти полностью запрещает экспрессию неонатальной формы. Экспрессия неонатальной или взрослой формы продукта сплайсинга динамично и дифференциально регулируется целым рядом факторов, в том числе имеются свидетельства о функциональной значимости данной регуляции. Конечные белковые продукты, по-видимому, обладают разными электрофизиологическими характеристиками в связи с различием в 3 аминокислотных остатках в районе сенсора напряжения у неонатальной и взрослой формы, что в свою очередь обусловливает различную чувствительность натриевого канала к АЭП.
В проведенной работе была подтверждена гипотеза о наличии корреляции между генетическим полиморфизмом SCN1 IVS5N+5 G→A и эффективной дозой ламотриджина, которая убывала в ряду GG→GA→AA соответственно. Также выявлена корреляция зависимости пиковой концентрации препарата от аллельного варианта гена
SCN1. В результате было обнаружено наличие достоверной ассоциации между генетическим полиморфизмом SCN1 IVS5N+5 G→A α-субъединицы потенциал-зависи- мого натриевого канала и средней максимальной концентрацией ламотриджина в плазме крови.
Различия в средних эффективных дозах ламотриджина могут быть опосредованы наличием определенного варианта продукта транскрипции гена SCN1A, обладающего измененными электрическими характеристиками у пациентов с эпилепсией, иными словами тяжесть заболевания увеличивается в ряду GG→GA→AA, что соответствует повышению терапевтических доз ламотриджина для эффективного контроля приступов. С другой стороны, зависимость дозы препарата от генотипа можно интерпретировать и с точки зрения изменения фармакодинамики ламотриджина в присутствии различных аллельных вариантов.
Полученные в исследовании результаты позволяют говорить и о возможном вкладе полиморфизма SCN1 IVS5N+5 G→A в патогенез эпилепсии, что выражается в достоверно более высокой распространенности данной мутации среди больных эпилепсией по сравнению с контрольной выборкой европейской этнической группы. Таким образом, наличие замены SCN1 IVS5N+5 G→A может обусловливать генетическую предрасположенность к заболеванию эпилепсией. При этом в рамках концепции о значимом вкладе генетических факторов в развитие симптоматических и криптогенных форм заболевания высокая частота встречаемости данного полиморфизма в группах СФЭ и КФЭ позволяет отнести ген SCN1 к генамкандидатам для дальнейшего пристального изучения на уровне популяции.
В ряде исследований показано, что эпилептические приступы могут регулировать пропорцию альтернативных транскриптов гена SCN1 [16]. При этом влияние приступов зависит от генотипа. Так, в работе S. Tate и соавт. [14] у пациентов с рефрактерной височной эпилепсией — носителей GG-генотипа — наблюдалось значительное повышение неонатальной 5N формы в височной доле относительно гиппокампа. Теми же авторами отмечается вероятность того, что наличие или отсутствие 5N транскрипта на стадии развития может приводить к измененным характеристикам других натриевых каналов, что влияет на их чувствительность к блокаторам во взрослом состоянии. Однако, согласно анализу литературы [3, 8], данные об опосредованном влиянии приступов на продукты транскрипции гена SCN1 противоречивы.
Таким образом, данное исследование демонстрирует важность изучения фармакогенетических аспектов терапии эпилепсии ламотриджином. Для подтверждения клинической значимости полученных результатов необходимо проведение дополнительных популяционных контролируемых клинических исследований, направленных на выявление ассоциации обозначенного генетического маркера SCN1 IVS5N+5 G→A и эффективности терапии ламотриджином, а также возможного вклада данного маркера в патогенез заболевания.
ЛИТЕРАТУРА
1. Аксенова М.Г., Бурд С.Г., Качалин Е.Ю. и др. Анализ полиморфизма 2. |
Abe T., Seo T., Ishitsu T. et al. Association between SCN1A polymorphism |
гена FABP2 в связи с эффективностью действия препаратов вальпро- |
and carbamazepine-resistant epilepsy. Br J Clin Pharmacol 2008; 66: 2: |
евой кислоты. Журн неврол и психиат 2007; 107: 1: 42—45. |
304—307. |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2009 |
61 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
3.Aronica E., Yankaya B., Troost D. et al. Induction of neonatal sodium channel II and III alpha-isoform mRNAs in neurons and microglia after status epilepticus in the rat hippocampus. Eur J Neurosci 2001; 13: 6: 1261— 1266.
4.Beck H. Plasticity of antiepileptic drug targets. Epilepsia 2007; 48: Suppl 1: 14—18.
5.Brodie M.J., Richens A., Yuen A.W. Double-blind comparison of lamotrigine and carbamazepine in newly diagnosed epilepsy. UK Lamotrigine/Carbamazepine 1995.
6.Everett K.V., Chioza B., Aicardi J. et al. Linkage and association analysis of CACNG3 in childhood absence epilepsy. Eur J Hum Genet 2007; 15: 4: 463—472.
7.Harkin L.A., McMahon J.M., Iona X. et al. The spectrum of SCN1A-related infantile epileptic encephalopathies. Brain 2007; 130: Pt 3: 843—852.
8.Heinzen E.L., Yoon W., Tate S.K. et al. Nova2 interacts with a cis-acting polymorphism to influence the proportions of drug-responsive splice variants of SCN1A. Am J Hum Genet 2007; 80: 5: 876—883.
9.Kanai K., Hirose S., Oguni H. et al. Effect of localization of missense mutations in SCN1A on epilepsy phenotype severity. Neurology 2004; 63: 2: 329—334.
10.Miller A.A., Wheatley P., Sawyer D.A. et al. Pharmacological studies on lamotrigine, a novel potential antiepileptic drug: I. Anticonvulsant profile in mice and rats. Epilepsia 1986; 27: 5: 483—489.
11.Sabers A., Buchholt J.M., Uldall P., Hansen E.L. Lamotrigine plasma levels reduced by oral contraceptives. Epilepsy Res 2001; 47: 1—2: 151—154.
12.Sabers A., Ohman I., Christensen J., Tomson T. Oral contraceptives reduce lamotrigine plasma levels. Neurology 2003; 61: 4: 570—571.
13.Steiner T.J., Dellaportas C.I., Findley L.J. et al. Lamotrigine monotherapy in newly diagnosed untreated epilepsy: a double-blind comparison with phenytoin. Epilepsia 1999; 40: 5: 601—607.
14.Tate S.K., Depondt C., Sisodiya S.M. et al. Genetic predictors of the maximum doses patients receive during clinical use of the anti-epileptic drugs carbamazepine and phenytoin. Proc Natl Acad Sci USA 2005; 102: 15: 5507—5512.
15.Urak L., Feucht M., Fathi N. et al. A GABRB3 promoter haplotype associated with childhood absence epilepsy impairs transcriptional activity. Hum Mol Genet 2006; 15: 16: 2533—2541.
16.Xie X., Lancaster B., Peakman T., Garthwaite J. Interaction of the antiepileptic drug lamotrigine with recombinant rat brain type IIA Na+ channels and with native Na+ channels in rat hippocampal neurones. Pflugers Arch 1995;
430:3: 437—446.
17.Yang Y.C., Kuo C.C. Inhibition of Na(+) current by imipramine and related compounds: different binding kinetics as an inactivation stabilizer and as an open channel blocker. Mol Pharmacol 2002; 62: 5: 1228—1237.
18.Yang Y.C., Kuo C.C. An inactivation stabilizer of the Na+ channel acts as an opportunistic pore blocker modulated by external Na+. J Gen Physiol 2005;
125:5: 465—481.
* * *
62 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2009 |
