
Журнал неврологии и психиатрии / 2009 / NEV_2009_04_07
.pdf
МЕТОДЫ ИССЛЕДОВАНИЯ И ДИАГНОСТИКИ
Оценка информативности методов локализации эквивалентных источников биоэлектрической активности в диагностике затяжных бессознательных состояний
К.м.н., асс. каф. О.Е. ГУРСКАЯ1, к. биол. н., с.н.с. В.А. ПОНОМАРЕВ2
Methods of localization of equivalent EEG sources in the diagnostics of protracted loss of consciousness
O.E. GURSKAYA, V.A. PONOMARYOV
1Санкт-Петербургская медицинская академия последипломного образования; 2Институт мозга человека РАН, Санкт-Петербург
Приведены результаты исследования ЭЭГ 16 больных в затяжных бессознательных состояниях в результате тяжелой черепно-мозговой травмы методами локализации источников (метод независимых компонент, метод LORETA) с целью определения их диагностической ценности. Также приводятся результаты сопоставления исследования соматосенсорных вызванных потенциалов (ССВП) при стимуляции срединных нервов и ЭЭГ. Независимые компоненты ЭЭГ наибольшей мощности имели преобладание ∆-активности, локализовались преимущественно в передних отделах больших полушарий головного мозга (лобные, височные доли), положительно коррелировали с патологическими нейродинамическими изменениями ССВП (r=0,69; p=0,003) и показали отрицательную корреляционную связь со шкалой исходов Глазго (r=–0,66; p=0,005).
Ключевые слова: метод независимых компонент, метод LORETA, соматосенсорные вызванные потенциалы, тяжелая
черепно-мозговая травма, кома.
Results of EEG study of patients in a protracted unconscious state due to severe cranial trauma using different methods of source localization (independent component analysis, the LORETA method) are presented in order to compare their diagnostic value. Also the results of the study of somatosensory evoked potentials (SSEP) to median nerve stimulation of and EEG are compared. The independent higher frequency components of the EEG power spectrum had the higher activity in the delta-band, were localized predominantly in the frontal brain hemispheres (frontal, temporal regions), positively correlated with pathological neurodynamic SSEP changes (r=0,69; p=0,003) and negatively with the scores on the Glasgow outcome scale (r=–0,66; p=0,005).
Key words: independent component analysis, the LORETA method, somatosensory evoked potentials, severe cranial trauma, coma.
У больных в затяжных бессознательных состояниях в результате тяжелой черепно-мозговой травмы были выявлены нейродинамические изменения соматосенсорных вызванных потенциалов (ССВП), характеризующиеся патологическим многократным увеличением амплитуд компонентов ССВП, регистрирующихся с экстрацефалическим референтным электродом, что позволило предположить нарушение нормального баланса между специфическими и неспецифическими системами мозга [1, 2]. Высокоамплитудные ССВП коррелировали с неблагоприятным исходом в затяжное бессознательное состояние. Так как нарушение деятельности регуляторных систем мозга отражается не только в вызванной, но и в спонтанной биоэлектрической активности мозга, вызывает определенный интерес сопоставление выявленных изменений ССВП и ЭЭГ у больных в затяжных бессознательных состояниях.
Одним из рутинных методов исследования больных в затяжных бессознательных состояниях является ЭЭГ, в
которой, как правило, наблюдается медленно-волновая активность в - и θ-диапазонах [3]. Однако визуальный или спектральный анализ ЭЭГ имеет ограничения. Сигналы, регистрируемые со скальпа при записи ЭЭГ, представляют суперпозицию потенциалов от многих источников, находящихся внутри головного мозга, что существенно усложняет задачу локализации этих источников.
Для локализации источников биоэлектрической активности головного мозга часто используются локализация эквивалентных дипольных источников, вычисление трехмерного распределения эквивалентной плотности токов (метод LORETA — Low Resolution Electro-Magnetic tomography [16]), метод слепого разделения источников (BSS — Blind Source Separation), недавно появившийся метод независимых компонент (ICA — Independent Component Analysis) [5, 12—15, 18, 21].
Целью работы являлась оценка диагностической ценности методов локализации источников электроэнцефа-
© О.Е. Гурская, В.А. Пономарев, 2009 |
1e-mail: gurskaya_olesya@mail.ru |
Zh Nevrol Psikhiatr Im SS Korsakova 2009;109:4:36
36 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2009 |

ДИАГНОСТИКА ЗАТЯЖНЫХ БЕССОЗНАТЕЛЬНЫХ СОСТОЯНИЙ
лограммы у больных в затяжных бессознательных состояниях в результате тяжелой черепно-мозговой травмы, а также сопоставление с исследованием ССВП срединного нерва.
Материал и методы
Работа основана на анализе данных ЭЭГ и ССВП у 16 пациентов (14 мужчин и 2 женщины) с тяжелой черепномозговой травмой (ТЧМТ), находившихся на лечении в Александровской больнице Санкт-Петербурга с 2005 по 2008 г. Больные пребывали в длительной коме (более 10 сут), с последующим исходом в затяжное бессознательное состояние (вегетативное состояние, или состояние малого сознания) и наблюдались от 4 до 10 мес после ТЧМТ. Исследование ССВП и ЭЭГ проводили на 2—3-и сутки после поступления больного в стационар с последующим еженедельными обследованиями в течение 1-го месяца после ТЧМТ и далее ежемесячно в зависимости от срока наблюдения. Запись ЭЭГ в острый период ТЧМТ проводилась на фоне отмены седативных препаратов.
Возраст пациентов варьировал от 18 до 54 лет (в среднем — 32 года). Комплексное обследование включало оценку неврологического статуса с градацией по шкале комы Глазго, рентгенографию черепа, компьютерную томографию (КТ) головного мозга по стандартным методикам, оценку ранних исходов по шкале исходов Глазго (на 4-й месяц после ТЧМТ), регистрацию ССВП и ЭЭГ.
При исследовании ССВП стимулировали срединные нервы электрическим током частотой 4,7 Гц, длительностью 0,2 мс. Интенсивность стимуляции подбирали на основе моторного порога, за который принимали видимое движение большого пальца кисти. Частотная полоса пропускания составляла 10—2000 Гц, эпоха анализа — 70 мс. Вызванные потенциалы мозга регистрировали с помощью 4-канальной электрофизиологической системы Нейромиан (Россия). Активные электроды располагались в точках С3', С4' (по схеме 10—20), референтные электроды — в точке Fz (по схеме 10—20) и в проекции ипсилатеральной ключицы (по средней линии). Помимо компонентов P14, N18 N20 ССВП, обычно оцениваемых у больных в бессознательных состояниях, также исследовали более поздние компоненты N30 и N48 в отведениях с экстрацефалическим референтным электродом, нормативные значения для которых были получены в предыдущих исследованиях [1, 2]. В контрольной группе здоровых испытуемых (n=20) средние латентный период и амплитуда для компонента N30 были равны — 30,7±3,2 мс и 3,04±1,92 мкВ, а для компонента N48 — 48,5±3,8 мс и 4±1,7 мкВ соответственно.
ЭЭГ регистрировали на 19-канальной системе Мицар. Электроды на скальпе располагались по схеме 10—20. Запись ЭЭГ проводилась без предъявления афферентных раздражителей (фоновая запись) в течение 7—10 мин.
При количественном анализе ЭЭГ в качестве исходных данных выбирался безартефактный непрерывный отрезок записи ЭЭГ длительностью более 60 с при условии отсутствия внешних раздражителей. Далее многоканальная запись сигналов раскладывалась на независимые компоненты [11]. Для каждой выделенной независимой компоненты рассчитывались спектры мощности: весь анализируемый интервал разбивался на полуперекрывающиеся эпохи длительностью 2 с. Для каждой эпохи вычислялись
параметры полиномиального тренда второго порядка, и этот тренд компенсировался. Для подавления просачивания энергии через боковые максимумы каждый отрезок сглаживается временным окном Ханна. С помощью быстрого преобразования Фурье вычисляется спектр мощности (периодограмма).
Для последующего анализа выбирали первые 10 независимых компонент, имеющих наибольшую мощность, при этом из их числа исключали компоненты, которые могли быть связаны с различными артефактами: морганиями, мышечными артефактами, пульсовой волной и др.
Для локализации эквивалентных источников сигналов в качестве исходных данных использовали так называемые топографии независимых компонент [11]. Локализацию проводили методами топографического картирования, вычислением параметров эквивалентного дипольного источника и распределения эквивалентной плотности токов (LORETA).
Спектры независимых компонент ЭЭГ сопоставляли с нормативной базой данных ЭЭГ, разработанной в Институте мозга человека РАН, в состав которой входили более 800 здоровых лиц в возрасте от 7 до 89 лет. Статистическую обработку полученных данных проводили с помощью непараметрических методов оценки (Statistica 6.0).
Результаты
В основную группу больных в затяжных бессознательных состояниях вошли 10 больных с диффузным аксональным повреждением (ДАП) мозга I—III типов и 6 больных с интракраниальными гематомами и контузионными повреждениями головного мозга (табл. 1).
Нативная ЭЭГ у всех обследованных больных характеризовалась выраженным полиморфизмом. Широко была представлена -активность: у 3 больных — постоянный полиморфный тип, у 5 — непостоянный мономорфный тип [7—10, 16]. У 10 больных на фоне диффузных изменений биоэлектрической активности головного мозга определялись локальные изменения, представленные полиморфной -активностью. Биоэлектрическая активность волн θ-диапазона в качестве субдоминирующего ритма регистрировалась у 5 больных, доминирующего — у 3. Также у 6 больных субдоминировала полиморфная низкоамплитудная активность волн β-диапазона.
При исследовании ССВП выявлялось одноили двустороннее отсутствие компонентов N20 (8 больных), увеличение латентных периодов компонентов N18, N20 (6), а также увеличение амплитуд компонентов N30 и N48, ре-
Таблица 1. Результаты компьютерной томографии головного мозга в основной группе больных при поступлении в стационар
Данные КТ-исследования |
Число больных |
|
|
ДАП |
|
без видимых очаговых повреждений |
5 |
с видимыми очаговыми повреждениями |
5 |
Смещение срединных структур |
4 |
Контузионно-геморрагические очаги |
|
лобные доли |
8 |
височные доли |
6 |
ствол головного мозга |
1 |
теменные или затылочные доли |
3 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2009 |
37 |

МЕТОДЫ ИССЛЕДОВАНИЯ И ДИАГНОСТИКИ
Рис. 1. Локализация эквивалентных источников биоэлектрической активности мозга методом LORETA. Нормативная группа.
А — распределение эквивалентной плотности токов, полученной методом LORETA для первых 10 независимых компонент.
Здесь и на рис. 2 и 3 принятые обозначения: R — правая сторона, L — левая сторона, A — передние отделы, Р — задние отделы, S — верх, I — низ, bottom — вид снизу, back — вид сзади, top — вид сверху, left — вид слева, right — вид справа. 14.39 — абсолютная мощность компоненты, мкВ2.
Б — спектры мощности независимых компонент ЭЭГ в частотном диапазоне. По оси абсцисс — диапазон частот в Гц; по оси ординат — индивидуальный масштаб графиков, мкВ2.
В — результаты локализации эквивалентных точечных источников независимых компонент ЭЭГ в нормативной группе. RRE — относительная остаточная дисперсия.
38 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2009 |

ДИАГНОСТИКА ЗАТЯЖНЫХ БЕССОЗНАТЕЛЬНЫХ СОСТОЯНИЙ
Рис. 2. Локализация первых 3 независимых компонент ЭЭГ у больных с ДАП.
А — примеры локализации доминирующих по мощности первых 3 независимых компонент у больных с ДАП I—III типов. Стрелкой указана локализация максимальной величины эквивалентной плотности токов в базальных отделах лобных долей.
9.87 — абсолютная мощность компоненты, мкВ2.
Б— ССВП, записанные у этих же больных в отведениях с экстрацефалическим референтным электродом. P11, Р14, N18, N30, N48 — компоненты ССВП, описание дано в тексте. Стрелкой указаны компоненты ССВП увеличенной амплитуды.
гистрирующихся в отведении с экстрацефалическим референтным электродом (9).
При анализе спектров мощности ритмов ЭЭГ и максимальных амплитудных значений ССВП (Amax CCВП) была выявлена корреляционная связь с ритмами ЭЭГ преимущественно в -диапазоне (табл. 2). Наиболее сильная положительная корреляционная связь между Amax CCВП и спектрами мощности -диапазона отмечалась в передних лобных (r=0,7—0,85) и правом затылочном отведениях (r=0,7). Более слабая положительная корреляционная связь определялась в височно-теменных (r=0,55—0,60) и левом затылочном отведениях (r=0,64). Слабая положительная корреляционная связь определялась при анализе спектров мощности ЭЭГ θ-диапазона и Аmax ССВП в левых центрально-теменном и правом затылочном отведениях (r=0,55—0,59) (см. табл. 2).
При сопоставлении 10 независимых компонент ЭЭГ наибольшей мощности спектра у больных в затяжных бессознательных состояниях и здоровых испытуемых определялись выраженные различия.
Во-первых, в норме — в α-диапазоне (рис. 1), а у больных в затяжных бессознательных состояниях доминирую-
щая частота спектра независимых компонент ЭЭГ лежала в -диапазоне (см. табл. 2, рис. 2).
Во-вторых, при определении локализации независимых компонент ЭЭГ методом LORETA у подавляющего большинства больных выявлялось появление дополнительных источников биоэлектрической активности в передних отделах головного мозга, обусловленных травмой и выделяемых с помощью метода независимых компонент (см. рис. 2). В нормативной группе наблюдалось теменнозатылочное и задневисочное распределение (см. рис. 1).
Следует отметить, что распределение независимых компонент ЭЭГ у больных в затяжных бессознательных состояниях обладало выраженным полиморфизмом, что исключало возможность использования методики усреднения.
В-третьих, в группе больных в затяжных бессознательных состояниях отмечалась тенденция к резкому увеличению мощности спектра одной из независимых компонент ЭЭГ, локализующейся в базальных отделах лобных долей, по сравнению с нормативной группой (см. рис. 2).
Оценка независимых компонент ЭЭГ наибольшей мощности спектра выявила, что компонента ЭЭГ, лока-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2009 |
39 |

МЕТОДЫ ИССЛЕДОВАНИЯ И ДИАГНОСТИКИ
Таблица 2. Корреляционный анализ по методу Спирмена спектров мощности ритмов ЭЭГ в ∆- и θ-диапазонах и Аmax ССВП
Отведения по схеме 10—20
Коэффициент корреляции между Аmax ССВП |
Коэффициент корреляции между Аmax ССВП |
|||||
и спектрами мощности ЭЭГ |
-диапазона |
и спектрами мощности ЭЭГ θ-диапазона |
||||
|
|
|
|
|
|
|
коэффициент |
|
средняя |
коэффициент |
|
средняя |
|
р |
мощность |
р |
мощность |
|||
корреляции |
корреляции |
|||||
|
спектра, мкВ2 |
|
спектра мкВ2 |
|||
|
|
|
|
|||
Fp1 |
0,7* |
0,005 |
20,6 |
–** |
– |
5,7 |
Fp2 |
0,85* |
0,0001 |
13,7 |
–** |
– |
4,9 |
F3 |
0,63* |
0,015 |
13,3 |
–** |
– |
4,3 |
F4 |
–** |
– |
12,3 |
–** |
– |
4,5 |
F7 |
–** |
– |
37,7 |
–** |
– |
6,2 |
F8 |
0,54* |
0,05 |
22,7 |
–** |
– |
8,63 |
C3 |
–** |
– |
14,5 |
0,55* |
0,04 |
6,26 |
C4 |
–** |
– |
9,2 |
–** |
– |
4,2 |
T3 |
0,55* |
0,04 |
31,4 |
–** |
– |
7,24 |
T4 |
–** |
– |
19,3 |
–** |
– |
7,9 |
Т5 |
–** |
– |
30,2 |
–** |
– |
7,2 |
T6 |
0,60* |
0,02 |
21,6 |
–** |
– |
9,23 |
P3 |
0,56* |
0,04 |
28,1 |
0,55* |
0,04 |
5,82 |
P4 |
0,57* |
0,03 |
17,9 |
–** |
– |
5,67 |
O1 |
0,64* |
0,01 |
32,5 |
–** |
– |
8,89 |
O2 |
0,70* |
0,005 |
10,7 |
0,59* |
0,02 |
3,69 |
Примечание. * — статистически достоверный коэффициент корреляции, ** — отсутствие статистически достоверного коэффициента корреляции.
лизующаяся в базальных отделах лобных долей, является одной из первых трех компонент наибольшей мощности у 11 (69%) больных. У оставшихся 5 пациентов наблюдалось иное распределение локализации независимых компонент ЭЭГ наибольшей мощности и более благоприятные исходы на 4-й месяц после ТЧМТ (4—5 уровни шкалы исходов Глазго). Также у этих больных регистрировался дополнительный пик на спектрограммах независимых компонент ЭЭГ в θ- (3 больных) и α- (1 больной) диапазонах (рис. 3).
При анализе значений спектра мощности независимой компоненты ЭЭГ, локализующейся в лобных долях, была выявлена отрицательная корреляционная связь (r= –0,66, p=0,005) со шкалой исходов Глазго на 4-й месяц после ТЧМТ.
У 3 пациентов с небольшим увеличением мощности изучаемой компоненты (5—7 мкВ2, норма — 3,9 мкВ2) наблюдались лучшие ранние исходы на 4-й месяц после травмы. У оставшихся 8 больных в затяжных бессознательных состояниях ее мощность составляла 14,7—107 мкВ2, 7 пациентов продолжали оставаться в состоянии малого сознания при оценке ранних исходов на 4-й месяц после травмы. Причем увеличение мощности данной компоненты наблюдалось как с наличием видимых на компьютерной томограмме контузионных очагов в лобных долях, так и без видимых очаговых изменений (см. табл. 1) у больных с диффузным аксональным повреждением мозга.
Корреляционный анализ выявил также положительную корреляционную связь (r=0,69, p=0,003) между мощностью изучаемой компоненты и Amax ССВП.
Обсуждение
Ограничением нашего исследования являются небольшая группа больных и достаточно разнородные
компьютерно-томографические данные о первичном повреждении головного мозга. Возможно, это явилось одной из причин выраженного полиморфизма распределения независимых компонент ЭЭГ, что не позволило использовать методику усреднения и обобщить данные по всем независимым компонентам ЭЭГ, которые были выделены. Однако даже на этом фоне наблюдалась тенденция к локализации источников патологических ритмов -диа- пазона ЭЭГ преимущественно в передних отделах больших полушарий головного мозга, что является существенным отличием от нормы. Корреляционный анализ показал тесную взаимосвязь между патологически увеличенными амплитудами компонентов ССВП и мощностью спектров -диапазона, в частности наиболее сильная положительная корреляционная связь была выявлена в передних лобных отведениях. Также тесная взаимосвязь была выявлена между патологически увеличенными амплитудами компонентов ССВП и мощностью спектров -ди- апазона независимой компоненты ЭЭГ, локализующейся в базальных отделах лобных долей. Была отмечена корреляция между мощностью спектра этой компоненты и исходами по шкале исходов Глазго. Полученные результаты позволяют нам высказать предположение о нарушениях в работе фронтоталамической регуляторной системы, описанной Ч. Инглингом и Д. Скиннером и по современным теоретическим и экспериментальным данным лежащей в основе когнитивной деятельности [4, 19].
Нарушения в работе фронто-таламической регуляторной системы, вероятно, обусловливают и нейродинамические изменения ССВП. В нашем исследовании мы получили данные о наличии тесной взаимосвязи между мощностью патологических ритмов ЭЭГ -диапазона в проекции лобных долей и патологическим увеличением амплитуд компонентов ССВП. В экспериментальных исследованиях повреждение таламо-кортикальных связей в области фронтальной коры вызывало селективное увели-
40 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2009 |
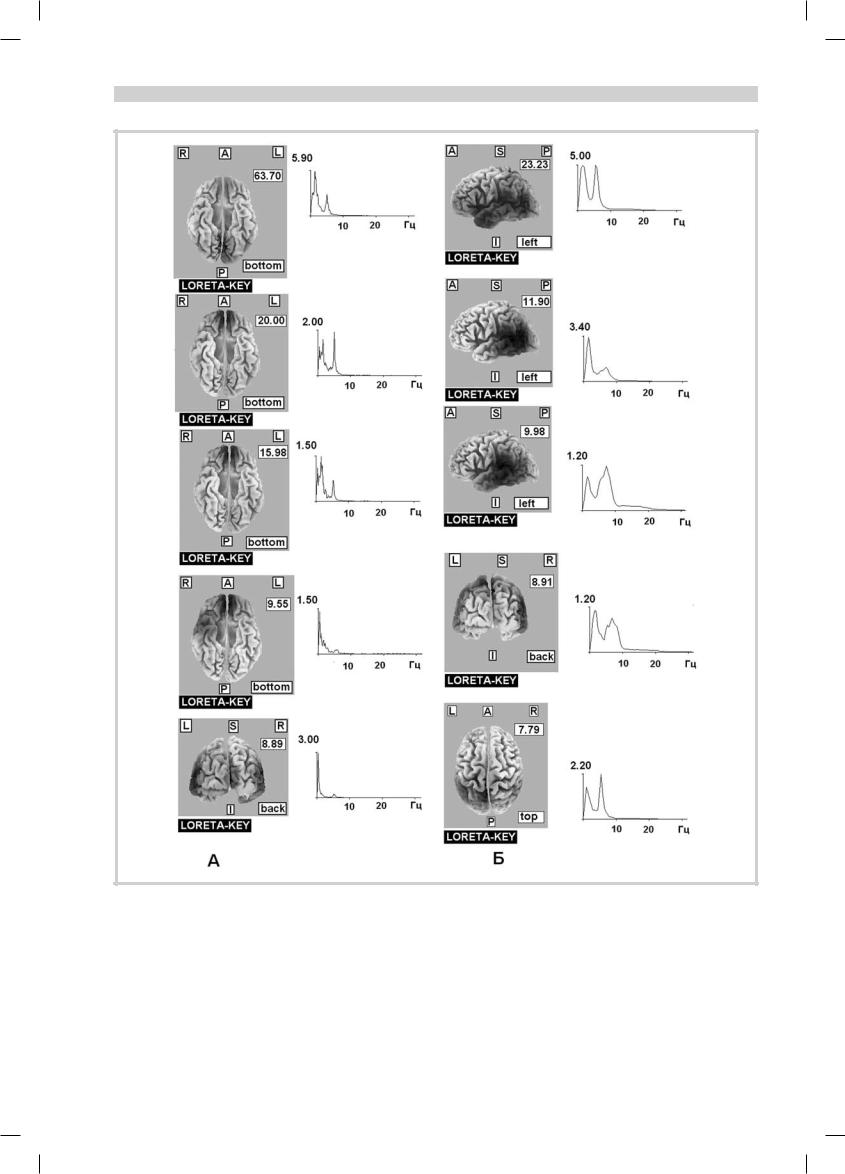
ДИАГНОСТИКА ЗАТЯЖНЫХ БЕССОЗНАТЕЛЬНЫХ СОСТОЯНИЙ
Рис. 3. Локализация эквивалентной плотности токов для независимых компонент ЭЭГ у больного А. (36 лет).
А — состояние малого сознания (2 мес после ТЧМТ); Б — восстановление сознания, уровень 4-й шкалы исходов Глазго (4 мес после ТЧМТ). 63.7 — абсолютная мощность компоненты, мкВ2.
чение амплитуд вызванных потенциалов разных модальностей за счет перерыва тормозных влияний со стороны ретикулярного ядра таламуса, что вело к увеличению объема афферентных посылок в кору через специфические таламические ядра [19, 20, 21]. В исследованиях ЭЭГ у жи-
вотных [6, 7] было показано, что корковая деафферентация от холинергических влияний со стороны базальных отделов переднего мозга вела к появлению медленноволновой активности коркового генеза, и появление постоянной полиморфной локальной или диффузной -актив-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2009 |
41 |

МЕТОДЫ ИССЛЕДОВАНИЯ И ДИАГНОСТИКИ |
|
ности может быть сопряжено с частичной корковой деаф- |
ческом исследовании выявляется диффузная дегенерация |
ферентацией [8—10, 17]. Подобная -активность наблю- |
миелина в белом веществе. |
далась у большинства из наших больных, только у 5 из них |
Таким образом, нарушение распределения и патоло- |
определялся билатерально-синхронный мономорфный |
гическое увеличение мощности независимых компонент |
тип, что предполагало источник патологической активно- |
ЭЭГ -диапазона в передних отделах головного мозга, а |
сти на уровне глубоких срединных структур мозга. При |
также нейродинамические изменения ССВП могут слу- |
диффузном аксональном поражении мозга, как известно, |
жить в качестве объективных диагностических количе- |
повреждения рассеяны в разных областях головного моз- |
ственных критериев у больных в затяжных бессознатель- |
га, преимущественно в белом веществе, а при гистологи- |
ных состояниях. |
ЛИТЕРАТУРА
1.Гурская О.Е. Специфические изменения соматосенсорных вызван11. Goldensohn E.S. Use of the EEG for evaluation of focal intracranial lesions.
ных потенциалов, регистрирующиеся в затяжных бессознательных состояниях. Сб. тез. докл.: Восстановление сознания и психической деятельности после травмы мозга: междисциплинарный подход. М 2008; 52.
2.Гурская О.Е., Беляков Н.А., Данилевич М.О. Комплексное исследование вызванных потенциалов мозга в выявлении ранних и поздних электрофизиологических критериев неблагоприятного прогноза при тяжелой черепно-мозговой травме. Научно-практический журнал «Нейрохирургия» 2008; 4: в печати.
3.Зенков Л.Р. Клиническая электроэнцефалография (с элементами эпилептологии). Руководство для врачей. 3-е изд. М: МЕДпрессинформ 2004; 75—79.
4.Мачинская Р.И. Нейрофизиологические механизмы произвольного внимания (аналитический обзор). Журн высш нервн деятельн 2003; 53: 133—150.
5.Bell A.J., Sejnowski T.J. An information-maximization approach to blind separation and blind deconvolution. Neural Computation 1995; 7: 1129— 1159.
6.Buzsaki G., Bickford R.G., Ponomareff G. et al. Nucleus basalis and thalamic control of neocortical activity in the freely moving rat. J Neurosci 1988; 8: 4007—4026.
7.Detary L., Vanderwolf C.H. Activity of cortically projecting and other basal forebrain neurons during large slow waves and cortical activation in anesthetized cat. Brain Res 1987; 43: 7: 1—8.
8.Gloor P., Kalabay O., Giard N. The electroencephalogram in diffuse encephalopathies: electroencephalographic correlates of grey and white matter lesions. Brain 1968; 91: 779—802.
9.Gloor P. Generalized and widespread bilateral paroxysmal abnormalities. In: A. Remond (ed.). Handbook of Electroencephalography and Clinical Neurophysiology, Part B. Elsevier. Amsterdam 1976; 52—87.
10.Gloor P., Ball G., Schaul N. Brain lesions that produce delta waves in the EEG. Neurology 1977; 27: 326—333.
In: D.W. Klass and D.D. Daly (eds.). Current Practice of Electroencephalography. New York: Raven Press 1979; 307—341.
12.Jung T.P., Makeig S., Bell A.J., Sejnowski T.J. Independent Component Analysis of electroencephalographic and event-related data. In: P. Poon, J. Brugge (eds.). Auditory Processing and Neural Modeling. New York: Plenum Press 1998; 189—197.
13.Makeig S., Bell A.J., Jung T.P., Sejnowski T.J. Independent component analysis of electroencephalographic data. Advances in Neural Information Processing Systems 1996; 8: 145—151.
14.Makeig S., Jung T.P., Bell A.J., Sejnowski T.J. Blind separation of auditory event-related brain responses into independent components. Proc Nat Acad Sci USA 1997; 94: 10: 979—984.
15.Michel C.M. et al. EEG source imaging. Clin Neurophysiol 2004; 115: 10: 2195—2222.
16.Pascual-Marqui R.D., Michel C.M., Lehmann D. Low resolution electromagnetic tomography: a new method for localizing electrical activity in the brain. Int J Psychophysiol 1994; 18: 1: 49—65.
17.Richards J.E. Recovering dipole sources from scalp-recorded potentials using component analysis: principal component analysis and independent component analysis. Int J Psychophysiol 2004; 54: 3: 201—220.
18.Steriade M., Gloor P., Llinas R.R. et al. Basic mechanisms of cerebral rhythmic activities. Electroencephalography and Clin Neurophysiol 1990; 76: 481—508.
19.Yingling C.D., Skinner J.E. Regulation of unit activity in nucleus reticularis thalami by mesencephalic reticular formation and the frontal granular cortex. Electroencephalography Clin Neurophysiol 1975; 39: 635—642.
20.Yingling C.D., Skinner J.E. Selective regulation of thalamic sensory relay nuclei by nucleus reticularis thalami. Electroencephalography Clin Neurophysiol 1976; 41: 476—482.
21.Zhukov L., Weinstein D., Johnson C. Independent component analysis for EEG source localization. IEEE Eng Med Biol Mag 2000; 19: 3: 87—96.
42 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2009 |
