
Журнал неврологии и психиатрии / 2010 / NEV_2010_07_073
.pdf
Никотиновая зависимость: поиск новых средств фармакотерапии
К.б.н. О.А. ДРАВОЛИНА, д.м.н., проф. А.Ю. БЕСПАЛОВ, к.м.н. Е.С. ЗАХАРОВА, д.м.н., проф. Э.Э. ЗВАРТАУ
Behavioral mechanisms of nicotine dependence: a search for new drugs
O.A. DRAVOLINA, A.YU. BESPALOV, E.S. ZAKHAROVA, E.E. ZVARTAU
Институт фармакологии им. А.В. Вальдмана Санкт-Петербургского государственного медицинского университета им. И.П. Павлова
Ключевые слова: никотин — антагонисты НР — антагонисты NMDA-рецепторов — антагонисты метаботропных
глутаматных рецепторов — никотиновая зависимость (табакокурение).
Key words: Nicotine — Nicotinic receptor antagonist — NMDA-receptor antagonist — Metabotropic glutamate receptor antagonist
— Nicotine abuse (tobacco smoking).
Табакокурение — один из ведущих факторов риска сердечно-сосудистых и бронхолегочных заболеваний. Однако, несмотря на растущую в обществе поддержку мер по ограничению табакокурения и готовность большинства курильщиков в развитых странах отказаться от этой привычки, табачная зависимость плохо поддается терапии и легко рецидивирует. Разработка новых и совершенствование существующих методов терапии табачной зависимости является одной из приоритетных задач современной медицинской науки.
В настоящее время широко используется заместительная терапия с применением содержащих никотин пластырей, жевательных резинок, спреев, ингаляторов или веществ, действие которых частично повторяет свойства никотина (например, цитизин). Смысл такого лечения состоит в замене способа доставки никотина в кровь с постепенным уменьшением суточной дозы получаемого никотина с развитием минимально выраженного синдрома отмены. Эффективность заместительной терапии увеличивается при сочетанном применении с веществами, имеющими антидепрессивное действие, например бупропионом [43, 44]. С помощью такого рода терапии можно достичь быстрого купирования абстинентного синдрома, возникающего после отказа от курения, но эффективность вышеперечисленных методов в лечении никотиновой зависимости остается низкой. Например, вероятность прекращения курения при применении никотинового пластыря составляет 27% в конце лечения по сравнению с 13% для группы, получающей плацебо [2]. Однако наиболее сложной проблемой лечения как никотиновой, так и любой другой лекарственной зависимости является предупреждение возвращения к приему аддиктивного вещества после или в процессе лечения. Многие фармацевтические компании пытаются найти новые средства лечения табакокурения на основе общей концепции химической зависимости, поскольку механизмы формирования нико-
тиновой зависимости во многом сходны с механизмами, лежащими в основе формирования зависимости к таким психоактивным веществам, как опиоиды, психостимуляторы и др. Кроме того, в последние годы накоплена обширная информация, касающаяся нейроанатомии и нейрохимии острых и хронических эффектов никотина.
Никотиновые рецепторы
Первичной мишенью действия никотина являются никотиновые рецепторы (НР), расположенные как в центральной, так и в периферической нервной системе. НР являются ионными каналами, связывание никотина с которыми приводит к кратковременному повышению проницаемости клеточной мембраны для Na+ и Ca2+, развитию деполяризации и увеличению возбудимости нервной клетки. НР — это пентамерная структура, в состав которой входит от 1 до 4 различных субъединиц, расположенных в определенном порядке.
Субъединицы, входящие в состав НР, подразделяют на α- и β-подтипы. В нервных клетках позвоночных животных представлено 9 видов α-субъединиц (α2 — α10) и три вида β-субъединиц (β2 — β4) [61]. В состав каждого НР входят, по крайней мере, 2 α-субъединицы, из которых образуются участки связывания агонистов НР [56]. Несмотря на то что не все возможные комбинации приведенных видов субъединиц составляют активные НР in vivo, количество разнообразных подтипов функциональных НР достаточно велико. Селективность имеющихся на данный момент лигандов НР не позволяет разделить НР на все существующие подтипы [81].
НР с различной композицией субъединиц имеют функциональные характеристики, отличающиеся по степени проводимости для ионов Na+ и Ca2+ и чувствительности к антагонистам [87, 88]. Разнообразие НР вносит свой вклад в способность никотина вызывать широкий спектр эффектов у курящих людей [25].
© Коллектив авторов, 2010 |
e-mail: olga.dravolina@gmail.com |
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:7:73 |
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
73 |

ОБЗОРЫ
Нейроанатомия системы «награды» и нейрохимические основы подкрепляющих эффектов никотина
Дофаминергические проекции из вентральной тегментальной области (ВТО) в прилежащее ядро перегородки являются ключевыми в функционировании мозговой системы «награды», а увеличение выброса дофамина в прилежащем ядре — один из центральных механизмов, опосредующих подкрепляющие свойства различных веществ, обладающих аддиктивным потенциалом [1]. По данным литературы, большинство дофаминергических нейронов ВТО мозга предположительно имеют α4β2*1 и α7 гомомерные НР [51].
В отличие от кокаина и амфетамина, эффекты которых обусловлены взаимодействием с пресинаптическими переносчиками дофамина на мембране нервных окончаний, эффекты никотина в большей степени зависят от изменений активности нейронов среднего мозга. Другими словами, под действием агониста НР, находящиеся на телах и дендритных отростках дофаминергических нейронов ВТО, активируются, вызывая прямой выброс дофамина, в то время как активация пресинаптических НР на аксонах этих клеток, контактирующих с нейронами прилежащего ядра, может не влиять на выброс дофамина [88].
Уже после однократного введения никотина выброс дофамина в прилежащем ядре, опосредованный дофаминергическими нейронами ВТО, продолжается более 1 ч [22]. Тем не менее, хотя никотин вызывает продолжительную активацию нейронов области вентральной покрышки среднего мозга, НР дофаминергических нейронов десенситизируются в течение нескольких секунд после введения никотина, что наталкивает на мысль о том, что столь длительное действие никотина опосредовано другими рецепторными механизмами [60, 89].
Дофаминергические нейроны ВТО находятся под тоническим ингибирующим контролем ГАМКергических нейронов, как местных, так и располагающихся в проекционных волокнах из различных областей мозга, включая прилежащее ядро перегородки и вентральные отделы бледного шара [46, 61, 79, 85]. Никотин, действуя на α4β2* НР, располагающиеся на телах ГАМКергических нейронов, увеличивает ГАМКергическую трансмиссию [51, 61]. Однако связывание никотина с рецепторами также приводит к их быстрой десенситизации, что блокирует эффекты эндогенного ацетилхолина и снижает ингибирующее влияние ГАМКергических нейронов, в свою очередь вызывая последующее увеличение дофаминергической нейропередачи [61].
Нейроны ВТО, как дофаминергические, так и ГАМКергические, подвергаются тоническому стимулирующему влиянию глутаматергических проекционных волокон из коры, миндалины, гиппокампа [19, 45, 64, 76]. Никотин, действуя на НР, преимущественно содержащие α7субъединицы, вызывает развитие долговременной потенциации возбуждающей глутаматергической стимуляции дофаминергических нейронов [61]. Действительно, было показано, что никотин увеличивает высвобождение глутамата в области вентральной покрышки среднего мозга [75], а N-метил-D-аспартатные (NMDA) рецепторы опосредуют способность никотина стимулировать выброс до-
1 Звездочка означает, что в состав рецептора могут входить также и другие субъединицы.
фамина в прилежащем ядре перегородки и модифицировать долговременную потенциацию возбуждающих входов [60, 89].
Таким образом, существует 2 основных механизма, посредством которых никотин оказывает свое стимулирующее влияние на дофаминергические нейроны вентральнойпокрышкисреднегомозга:угнетениеГАМКергической передачи и долговременная потенциация глуматергических входов ВТО мозга.
Направления поиска новых средств лечения никотиновой зависимости
Одним из перспективных направлений поиска средств для лечения табакокурения представляется разработка препаратов, действующих на глутаматергическую систему. Глутамат — наиболее распространенный возбуждающий нейромедиатор мозга, на долю которого приходится около 70% синаптической передачи в ЦНС, его концентрация в синаптической щели высока и может достигать миллимолярного уровня. Глутаматергическая система вовлечена в различные формы обучения и памяти, имеющие отношение к формированию зависимости от психоактивных веществ. Так, антагонисты NMDA-рецепторов препятствуют опосредованному введением никотина повышению уровня дофамина в мезолимбической системе [27], ослабляют подкрепляющее действие никотина [31] и снижают развитие вызванных никотином изменений, таких как толерантность и сенситизация [60, 77]. Однако использование антагонистов NMDA-рецепторов ограничивается вызываемыми ими нарушениями обучения и памяти, а также наличием психотомиметического и собственного аддиктивного потенциалов [5, 6, 16, 21, 69, 70].
Антагонисты NMDA-рецепторов имеют сродство и к НР с различной композицией субъединиц, среди них — канальные блокаторы NMDA-рецепторного комплекса, а именно, дизоцилпин (МК-801), мемантин и противокашлевое средство декстрометорфан [14, 30, 39, 55]. Cпособность данных веществ снижать потребление никотина и других психоактивных веществ в эксперименте может быть связана не только с блокадой глутаматных рецепторов, но и с воздействием на НР [31—33]. Действительно, существует множество исследований, в которых изучалось влияние никотина на нейромедиаторные системы, но общая картина выглядит достаточно сложной, так как никотин не только изменяет глутамат-, ГАМК- и дофаминергическую передачу в мезолимбических областях мозга, но также затрагивает метаболизм в различных структурах мозга ацетилхолина, серотонина, норадреналина, эндогенных опиоидных пептидов [83, 90, 92]. Все эти изменения начинаются со связывания никотина с НР, и не удивительно, что именно их блокада способна предотвратить большую часть последствий, связанных с острым и хроническим воздействием никотина.
Таким образом, изучение веществ, действующих на НР может являться одним из перспективных направлений разработки средств для фармакотерапии табакокурения. Подобные вещества должны удовлетворять некоторым критериям, в частности полностью блокировать эффекты никотина, которые ответственны за формирование зависимости, что может быть достигнуто за счет неконкурентного характера антагонизма. В идеале такие вещества должны быть эффективны в фазе отказа от курения, когда предъявление различных стимулов, ассоциированных с
74 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |

ЛЕЧЕНИЕ НИКОТИНОВОЙ ЗАВИСИМОСТИ
действием никотина, приводит к запуску поведения поиска никотина, а лекарство должно снижать реактивность на подобного рода стимулы. Важно также отметить, что субъединицы НР имеют различное анатомическое распределение: некоторые преимущественно экспрессируются на периферии, а некоторые — в ЦНС. Соответственно, блокада центральных НР предпочтительна для достижения желаемого эффекта, так как в этом случае наименее вероятно появление побочных эффектов, характерных для антагонистов НР и связанных с влиянием на вегетативные ганглии и нервно-мышечные синапсы, и преципитирование компонентов абстинентного синдрома, имеющих отношение к физической зависимости.
Неконкурентные антагонисты центральных НР
Антагонист НР мекамиламин ранее был исследован в качестве как самостоятельного, так и вспомогательного средства в комбинации с никотин-заместительной терапией для лечения табачной зависимости [7, 37]. В некоторых работах показана эффективность лечения мекамиламином [73]. В комбинации с никотиновым пластырем мекамиламин увеличивал вероятность прекращения курения по сравнению с использованием только заместительной терапии, что подтверждает способность мекамиламина блокировать подкрепляющие свойства никотина [72]. Однако мекамиламин обладает рядом нежелательных побочных эффектов, таких как седативность, снижение артериального давления, связанных с неселективным действием этого вещества на разные подтипы НР, что ограничивает его применение в клинике.
Мекамиламин является классическим ганглиоблокатором и обладает высокой тропностью к α3β4* НР [65], широко представленным в автономной нервной системе. Разработанное на основе строения канальных блокаторов NMDA-рецепторов компанией Merz Pharmaceuticals GmbH вещество MRZ 2/621 (1-амино-1,3,3-триметил- циклогексан; [30, 55]) имеет уникальный профиль связывания с НР: является более селективным Н-холинолити- ком, чем мекамиламин, и не взаимодействует с ганглионарными α2β4* НР (см. таблицу). Можно ожидать, что MRZ 2/621 обладает меньшим количеством побочных эффектов, связанных с действием на вегетативные ганглии, в то же время это вещество способно эффективно блокировать центральные эффекты никотина.
Наиболее адекватным подходом к изучению субъективных ощущений, вызываемых фармакологическими агентами, является метод диссоциированного обучения [20]. Хорошо известно, что никотин обладает комплексом дифференцировочных стимульных свойств, и интенсивность субъективных эффектов никотина достаточна для выработки устойчивого диссоциированного поведения [57]. Классический неконкурентный антагонист НР мекамиламин ослабляет дифференцировочные стимульные
свойства никотина при диссоциированном обучении [91], блокируя несколько подтипов НР, включая α7, α4β2* и α3β4* НР (среднеэффективные концентрации — 6,9, 2,5 и 0,6 μМ соответственно [17, 65]). Антагонист НР MRZ 2/621 также значительно снижает вероятность «никотинового» ответа, связываясь с α7 и α4β2* (0,7 и 0,8 μМ соответственно [30]), но не влияя на α3β4* НР [91]. Декстрометорфан, к свойствам которого относят взаимодействие с α3β4*-рецепторами [39], не влияет на дифференцировочные стимульные свойства никотина [91], на основании чего можно предположить, что α3β4*-НР не играют существенной роли в проявлении субъективных эффектов никотина. Данные результаты согласуются с результатами ряда исследований, в которых было высказано предположение о том, что субъективные эффекты никотина при диссоциированном обучении более всего опосредованы действием на НР, в состав которых входит β2-субъединица [13, 34, 58, 80]. Следует отметить, что блокирующее дифференцировочные стимульные свойства никотина действие MRZ 2/621 не сопровождается угнетением общей оперантной активности и не преодолевается увеличением дозы никотина [91].
В исследовании Е.А. Блохиной и соавт. [12] при изучении действия антагонистов НР на подкрепляющие свойства никотина была использована методика выработки внутривенного самовведения (ВВС) никотина у мышей. Метод самовведения базируется на способности позитивных первично-подкрепляющих стимулов увеличивать вероятность поведенческой реакции, которая способствовала их предъявлению. На этом принципе основаны практически все экспериментальные модели ВВС наркотиков, в которых получение наркотика следует практически сразу за выполнением определенной поведенческой реакции (в нашем случае — выглядывания в отверстия экспериментальной установки). Считается, что модели ВВС обладают максимальной валидностью («внешнее соответствие»), а принцип позитивного подкрепления применим к анализу различных форм аддиктивного поведения. Было установлено [12], что предварительное введение антагонистов НР мекамиламина и MRZ 2/621 ведет к угнетению реакции ВВС никотина, подтверждая тот факт, что оба этих вещества блокируют рецепторы в степени, достаточной для подавления подкрепляющих свойств никотина.
Единственным более или менее общим свойством всех позитивно-подкрепляющих стимулов (включая фармакогенные, свойственные никотину и другим аддиктивным веществам) является активация мезокортиколимбической мозговой системы «награды», проявляющаяся в повышенном высвобождении дофамина в прилежащем ядре перегородки и последующим снижением порогов электрической самостимуляции (СС) мозга [8, 10, 52]. Ранее было установлено [36, 42], что предварительное введе-
Аффинность мекамиламина и MRZ 2/621 по отношению к разным подтипам НР и NMDA-рецепторам
Сродство к рецепторам |
Мекамиламин |
MRZ 2/621 |
α7* никотиновым рецепторам, μМ |
6,91 |
0,72 |
α4β2* никотиновым рецепторам, μМ |
2,51 |
0,82 |
α3β4* никотиновым рецепторам, μМ |
0,61 |
03 |
NMDA-рецепторам, μМ |
5,04 |
92,44 |
Примечание. Данные представлены в виде среднеэффективных ингибирующих концентраций (ИК 50%). Надстрочные цифры — ссылки на источник литературы: 1 — R.L. Papke и соавт. [65]; 2 — K.E. Gilling и соавт. [30]; 3 — E.S. Zakharova и соавт. [91]; 4 — W. Loscher и соавт. [55].
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
75 |
ОБЗОРЫ
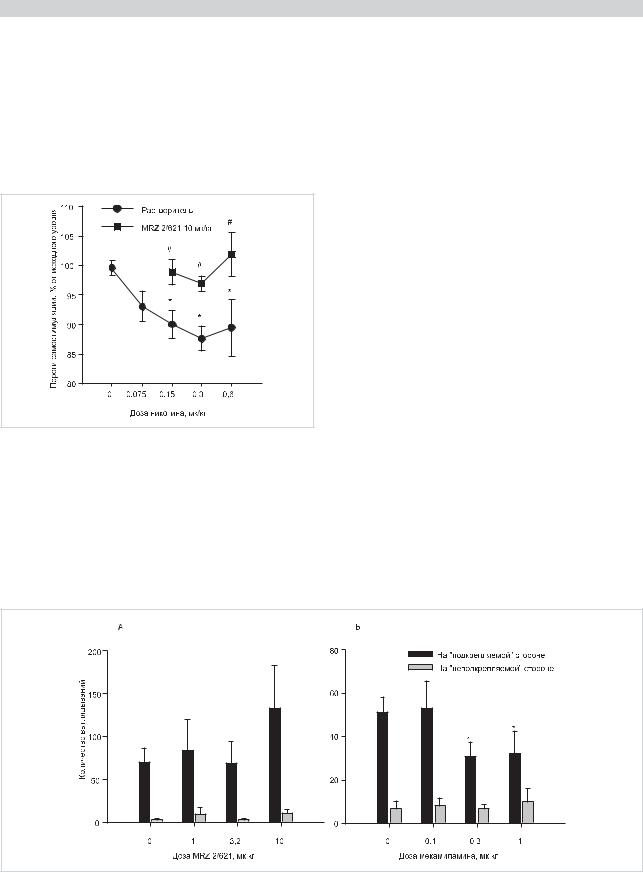
ние антагонистов НР мекамиламина и дигидро-β- эритроидина, действующего преимущественно на α2β4* и α4β4* НР, препятствует вызванному никотином снижению порогов электрической СС мозговой системы «награды» [36, 42]. На фоне действия антагониста НР MRZ 2/621 в дозе 10 мг/кг, не вызывающей повышения порога СС, никотин также теряет способность к снижению порогов СС мозга (рис. 1). Таким образом, неконкурентный антагонист НР MRZ 2/621 эффективно блокирует первично-
Рис. 1. Влияние MRZ 2/621 на снижение пороговой интенсивности электрической самостимуляции мозга, вызванное введением никотина.
Данные представлены в виде изменения (М±m) пороговой интенсивности стимуляции (%) по сравнению с предварительным тестированием. Никотин (0—0,6 мг/кг) и MRZ 2/621 (0,10 мг/кг) вводили за 15 и 30 мин до теста, соответственно. N=5—9. * — достоверность различий р<0,05 (тест Даннетта) по сравнению с данными тестов, в которых животные перед тестом получали растворитель вместо никотина (данные над точкой «0»). # — достоверность различий р<0,05 (тест Бонферрони) по сравнению с данными тестов, в которых животные перед тестом получали растворитель вместо MRZ 2/621. По оси ординат — изменение порога электрической самостимуляции мозга в % от исходного уровня, по оси абсцисс — доза никотина.
подкрепляющие свойства никотина, что предположительно связано с воздействием на рецепторы, содержащие преимущественно α4- и β2/β4-субъединицы.
Сравнительный анализ эффектов антагонистов НР мекамиламина и MRZ 2/621 на моделях поведения, обусловленного никотином, выявил некоторые различия в их действии. В рецидиве и поддержании поведения поиска наркотика большую роль играют условные стимулы, ранее ассоциированные с действием аддиктивного вещества, так называемые дискретные и обстановочные стимулы. Эффективность исследуемых антагонистов НР была оценена на модели условнорефлекторного восстановления угашенной реакции ВВС никотина при предъявлении дискретных стимулов, ранее ассоциированных с никотином [9, 15, 24]. Мекамиламин подавлял условнорефлекторное восстановление ВВС никотина (рис. 2), что хорошо согласуется с данными, полученными в более ранних исследованиях. В одной из работ X. Liu и соавт. [54] было показано, что при предъявлении световых стимулов в тесте восстановления мекамиламин в дозе 2 мг/кг избирательно уменьшал число нажатий на педаль, прежде ассоциированную с получением внутривенных инфузий никотина. Единственная доза мекамиламина, использованная в цитируемом исследовании, была выбрана на основании эффективности этой дозы вещества для подавления реакции ВВС никотина в более ранних экспериментах [32, 86]. Однако в данном диапазоне доз мекамиламин также обладает способностью неспецифически подавлять оперантное поведение в целом. Например, S. Glick и соавт. [32] продемонстрировали значительное угнетение оперантной реакции ВВС никотина и питья воды только после введения 2 мг/кг мекамиламина, в то время как 1 мг/кг мекамиламина селективно подавлял реакцию ВВС никотина. Поэтому в исследовании влияния мекамиламина на реактивность на стимулы, ассоциированные с действием никотина, использованы его низкие дозы, не превышающие 2 мг/кг (см. рис. 2). В выбранном интервале доз мекамиламин способен угнетать самовведение ни-
Рис. 2. Влияние MRZ 2/621 (А) и мекамиламина (Б) на восстановление угашенной реакции самовведения при предъявлении стимулов, прежде ассоциированных с получением никотина.
Перед тестом животные получали инъекции MRZ 2/621 (0—10 мг/кг) или мекамиламина (0—1 мг/кг). Данные представлены как суммарное количество выглядываний в отверстия на «подкрепляемой» (темные столбики) и «неподкрепляемой» (светлые столбики) сторонах экспериментальной камеры в течение 60-минутного теста. N=8. * — достоверность различий р<0,05 (тест Даннетта) по сравнению с контрольными группами животных, получавших растворитель. По оси ординат — число выглядываний, по оси абсцисс — доза препарата.
76 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |

ЛЕЧЕНИЕ НИКОТИНОВОЙ ЗАВИСИМОСТИ
котина [32], ослаблять дифференцировочные стимульные свойства никотина [91], блокировать реакцию предпочтения места, обусловленного никотином [28], подавлять проявление сенситизации к психомоторным эффектам никотина [48], а также преципитировать соматические признаки абстинентного синдрома у крыс, самовводящих никотин [67].
Начиная с дозы 0,3 мг/кг, мекамиламин значительно подавлял восстановление реакции ВВС, обусловленное предъявлением стимулов, прежде ассоциированных с инфузиями никотина, не влияя на число выглядываний на «неподкрепляемой стороне» (см. рис. 2), равно как и не оказывал влияния на оперантное поведение, поддерживаемое первично-подкрепляющими агентами, такими как, например, пища [91]. Однако приведенные примеры не доказывают в полной мере избирательность наблюдаемых эффектов мекамиламина в отношении поведения, связанного с предъявлением условнорефлекторных никотиновых стимулов.
Никотин способен вмешиваться в различные когнитивные процессы, включая внимание и ассоциативное обучение [63, 71, 78]. Несмотря на то что влияние мекамиламина на процессы памяти наблюдали в дозах, значительно превосходящих использованные в данном исследовании (например, [40]), эффективный диапазон доз в большой степени определяется типом исследуемого когнитивного процесса. Например, было показано [63], что никотин увеличивает частоту выполнения реакции, поддерживаемой условнорефлекторным подкреплением, в то время как мекамиламин (0,3 мг/кг) способен подавлять эффект никотина при сочетанном введении, а в более высокой дозе (1 мг/кг) сам по себе угнетает выполнение такой реакции. Таким образом, как было показано ранее [54], возможно, что ослабление восстановления реакции ВВС в данном исследовании под действием мекамиламина является результатом его общего ингибирующего влияния на мотивированное поведение, а не специфического действия на вызванное условнорефлекторными стимулами поведение поиска никотина.
Остается спорным вопрос о том, могла ли развиться никотиновая зависимость за время выработки самовведения никотина. Проведенные N. Paterson и A. Markou эксперименты [66] показали, что однократные инъекции мекамиламина (1 мг/кг) преципитируют соматические проявления абстинентного синдрома у крыс, имевших ежедневный доступ к внутривенным инфузиям никотина (0,03 мг/кг) в течение 30 дней. В отличие от упомянутой работы N. Paterson и A. Markou в данном исследовании сессии ВВС никотина длительностью в 1 ч проводили ежедневно в течение 20 дней. Хотя единичная инфузия содержала 0,01 мг/кг никотина, средний уровень самовведения был выше, чем в работе N. Paterson и A. Markou [66]
— соответственно 0,22 и 0,36 мг/кг/день. Вероятно, в настоящей работе никотиновая зависимость развивалась в меньшей степени, что снижало способность мекамиламина преципитировать соматические признаки абстинентного синдрома во время тестов, проводившихся на 11, 15, 19-й и 23-й дни после последней сессии самовведения никотина, хотя нельзя исключить, что она усиливает угнетающие эффекты мекамиламина на оперантное поведение во время тестов восстановления оперантной реакции. Например, известно, что поведение, мотивированное пищевым подкреплением, нарушается в состоянии абсти-
ненции даже в случае, когда это состояние не вызывает выраженных соматических или вегетативных признаков [26, 84].
На данный момент относительно мало известно о вовлечении НР различных подтипов в развитие абстинентного синдрома. Существующие данные свидетельствуют о важной роли субъединицы β4 в способности мекамиламина преципитировать абстинентный синдром. Например, мекамиламин вызывает значительно менее выраженный абстинентный синдром у мышей, лишенных субъединицы β4, по сравнению с контрольной группой мышей или группой мышей, лишенных субъединицы β2 [74].
Антагонист НР MRZ 2/621, в отличие от мекамиламина, не оказывает влияния на восстановление оперантной реакции самовведения, вызванной предъявлением дискретных стимулов, ранее ассоциированных с действием никотина (см. рис. 2). Так как MRZ 2/621 не активен по отношению к α3β4*-рецепторам, и, как ожидается, не вызывает синдром отмены у животных, зависимых от никотина (по крайней мере, его компонентов, имеющих отношение к физической зависимости), это еще раз подтверждает, что подавление мекамиламином вызванного предъявлением условных стимулов восстановления реакции самовведения, скорее всего, обусловлено каким-то неспецифическим действием.
В дальнейших экспериментах было обнаружено, что и мекамиламин, и MRZ 2/621 ослабляют воспроизведение реакции предпочтения места, обусловленного никотином (рис. 3). Метод выработки условнорефлекторного предпочтения места, основанный на формировании ассоциативной связи между действием фармакологического вещества и обстановкой, в которой это действие испытывалось, является одним из наиболее популярных подходов оценки наличия аддиктивного потенциала у веществ. Полученные результаты свидетельствуют о различиях механизмов, лежащих в основе поведения, индуцированного предъявлением дискретных (условнорефлекторное восстановление прежде угашенного ВВС никотина) и обстановочных (условнорефлекторное предпочтение места) стимулов.
Таким образом, можно заключить, что подобные MRZ 2/621 антагонисты центральных НР вызывают блокаду субъективных и подкрепляющих эффектов никотина (эффект не преодолевается увеличением дозы никотина), снижают реактивность на обстановочные стимулы, прежде ассоциированные с получением никотина, а также имеют улучшенный рецепторный профиль, который может способствовать лучшей переносимости и большей безопасности при клиническом использовании.
Антагонисты 1-й группы метаботропных глутаматных рецепторов
Возвращаясь к обоснованию выбора веществ, влияющих на глутаматергическую систему, как вторичную мишень действия никотина, логично предположить, что одними из потенциальных кандидатов при разработке средств, препятствующих развитию никотиновой зависимости, могут быть также вещества, механизм действия которых связан с модулирующим влиянием на NMDAрецепторы. Действительно, глутамат воздействует на различные типы ионотропных и метаботропных рецепторов, среди которых наиболее хорошо охарактеризованы поведенческие эффекты веществ, действующих на ионотроп-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
77 |

ОБЗОРЫ
Рис. 3. Влияние MRZ 2/621 (А) и мекамиламина (Б) на экспрессию предпочтения места, обусловленного введением никотина.
Во время обусловливания никотин (0,4 мг/кг) вводили перед посадкой в непредпочитаемый отсек челночной камеры, а перед посадкой в другой отсек вводили изотонический раствор NaCl (растворитель). Животным контрольных групп вводили перед обусловливанием непредпочитаемого отсека растворитель. Перед тестом животные получали инъекции MRZ 2/621 (0—10 мг/кг) или мекамиламина (0—1 мг/кг). Данные представлены как изменение времени (M±m), проведенного в прежде непредпочитаемом отсеке челночной камеры, по сравнению с предварительным тестированием. N=8. * — достоверность различий р<0,05 (тест Бонферрони) по сравнению с группами животных, получавших перед тестом растворитель вместо MRZ 2/621 или мекамиламина. # — достоверность различий р<0,05 (тест Бонферрони) по сравнению с группой животных, получавших во время обусловливания растворитель вместо никотина. Темные столбцы — данные контрольных групп, у которых непредпочитаемый отсек был обусловлен растворителем, светлые
— данные групп животных, у которых непредпочитаемый отсек был обусловлен никотином. По оси абсцисс — доза препарата, по оси ординат — приращение времени пребывания в «никотиновом» отсеке.
ные, в частности NMDA-рецепторы, в связи с большей |
уменьшает разнообразные эффекты аддиктивных ве- |
доступностью селективно действующих лигандов. В по- |
ществ. Например, MPEP уменьшал самовведение нико- |
следнее время был синтезирован целый ряд веществ, се- |
тина и кокаина у крыс и мышей [50, 65, 82], блокировал |
лективных к различным подтипам метаботропных рецеп- |
сенситизацию к стимулирующим эффектам никотина на |
торов, что в значительной степени облегчило изучение их |
локомоторную активность [82] и снижал депривационный |
физиологических функций и последующую оценку по- |
эффект алкоголя [4]. Приведенные данные согласуются с |
тенциальной терапевтической значимости воздействия на |
результатами исследования, в котором было показано, |
них. |
что у мышей, лишенных МГР пятого подтипа, не развива- |
Метаботропные глутаматные рецепторы (МГР) свя- |
ется реакция самовведения кокаина [18]. Кроме того, вве- |
заны с G-белковым комплексом и модулируют уровень |
дение MPEP угнетало восстановление реакции самовве- |
продукции вторичных мессенджеров. Выделяют 3 группы |
дения никотина, вызванного введением «запускающей» |
рецепторов [49]. Рецепторы 1-й группы, МГР первого и |
(«прайминг») его дозы [82], так же как и восстановление |
пятого подтипов, активируют фосфолипазу С, что ведет к |
самовведения этанола, инициированного сочетанным |
активации внутриклеточных посредников: инозитолтри- |
предъявлением разовой дозы этанола и стимулов, ассо- |
фосфатов, протеинкиназы С и ионов кальция. Рецепторы |
циированных с его введением [4]. Однако в одной из ра- |
2-й и 3-й групп, МГР второго и третьего подтипов и МГР |
бот [82] были получены данные об ограниченной способ- |
четвертого, шестого, седьмого и восьмого подтипов, реа- |
ности MPEP влиять на реакцию восстановления самовве- |
лизуют сигнал, подавляя синтез цАМФ. Особого внима- |
дения никотина под действием стимулов, ассоциирован- |
ния заслуживает 1-я группа МГР, так как именно их акти- |
ных с введением никотина, что согласуется с отсутствием |
вация потенцирует возбуждающее действие глутамата по- |
эффектов на выработку и воспроизведение реакции пред- |
средством модуляции активности NMDA-рецепторов в |
почтения места, обусловленного разными аддиктивными |
различных областях мозга [3, 11, 23]. Антагонисты 1-й |
веществами, исключая кокаин [62, 68]. Тем не менее в ра- |
группы МГР усиливают эффекты антагонистов NMDA- |
боте M. Tessari и соавт. [82], скорее всего, исследовали |
рецепторов, и их действие на поведенческом уровне во |
влияние MPEP на реакцию угашения самовведения нико- |
многом схоже с действием антагонистов NMDA- |
тина (в присутствии стимулов, ассоциированных с дей- |
рецепторов [35, 38, 41]. Данная группа веществ имеет не- |
ствием никотина), чем его эффекты в отношении стимул- |
которые преимущества перед антагонистами НР, так как |
индуцированного восстановления ранее угашенной реак- |
однозначно не преципитирует синдром отмены и не влия- |
ции самовведения никотина, так как в последнем случае |
ет на субъективные эффекты никотина [91], что показано |
MPEP значимо ослабляет условнорефлекторное восста- |
на примере действия антагониста МГР пятого подтипа — |
новление в дозах, не влияющих на восстановление пове- |
2-метил-6-фенилэтинил-пиридина гидрохлорида (MPEP) |
дения, обусловленного пищевым подкреплением [9]. |
[29]. |
В отличие от МГР пятого подтипа, мало изучена роль |
Исследования последних лет свидетельствуют о том, |
МГР первого подтипа в реализации эффектов аддиктив- |
что блокада не только NMDA-рецепторов, но и МГР |
ных веществ и, в частности, никотина. До сегодняшнего |
78 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |

ЛЕЧЕНИЕ НИКОТИНОВОЙ ЗАВИСИМОСТИ
дня существовало только одно сообщение [47] о том, что хроническое введение никотина способно увеличивать уровни мРНК и Homer протеинов МГР первого подтипа. Функциональная значимость такой up-регуляции ясна не до конца, однако, по результатам О.А. Драволиной и соавт. [24], селективный антагонист рецепторов первого подтипа EMQMCM (3-этил-2-метил-хинолин-6-ил)-(4- метокси-циклогексил)-метанон метансульфонат [53] ослабляет условнорефлекторное восстановление ранее угашенной реакции самовведения в меньших дозах, чем восстановление поведения, обусловленного пищевым подкреплением, что свидетельствует об участии МГР первого подтипа в механизмах условнорефлекторного запуска поведения поиска никотина. Более того, предварительное введение EMQMCM также предотвращает восстановление поведения, обусловленного никотином, при введении «запускающей» («прайминг») дозы никотина.
Таким образом, антагонисты 1-й группы МГР снижают реактивность к стимулам, ассоциированным с никотином, и запуску поведения поиска, обусловленного никотиновым «праймингом», в дозах, не влияющих на дифференцировочные стимульные свойства никотина, а также разделяют поведенческие и нейрохимические эффекты антагонистов NMDA-рецепторов при отсутствии психотомиметической активности.
Обобщая вышеизложенное, можно заключить, что представители рассмотренных групп веществ снижают реактивность на связанные с никотином условные раздражители, с параллельной способностью снижать субъективные и подкрепляющие эффекты никотина (антагонисты центральных НР) или без воздействия на субъективные эффекты никотина (антагонисты 1-й группы МГР) и могут рассматриваться в качестве новых кандидатов для разработки средств терапии никотиновой зависимости.
ЛИТЕРАТУРА
1.Беспалов А.Ю., Звартау Э.Э. Нейропсихофармакология антагонистов NMDA-рецепторов. Ст-Петербург: Невский диалект 2000; 297.
2.Фридман Л.С., Флеминг Н.Ф., Робертс Д.Г., Хайман С.Е. Наркология. Пер. с англ. Ст-Петербург: Невский диалект 1998; 318.
3.Attucci S., Clodfelter G.V., Thibault O. et al. Group I metabotropic glutamate receptor inhibition selectively blocks a prolonged Ca2+ elevation associated with age-dependent excitotoxicity. Neuroscience 2002; 112: 183—194.
4.Backstrom P., Bachteler D., Koch S. et al. mGluR5 antagonist MPEP reduces ethanol-seeking and relapse behavior. Neuropsychopharmacology 2004;
29:921—928.
5.Balster R.L., Willetts J. Phencyclidine: a drug of abuse and a tool for neuroscience research. Pharmacological aspects of drug dependence: Towards an integrated neurobehavioral approach. Handbook of experimental pharmacology. Eds. C.R. Schuster, M.J. Kuhar. Berlin: Springer-Verlag 1996; 118: 233—262.
6.Beardsley P.M., Hayes B.A., Balster R.L. The self-administration of MK801 can depend upon drug-reinforcement history, and its discriminative stimulus properties are phencyclidine-like in rhesus monkeys. J Pharmacol Exp Ther 1990; 252: 953—959.
7.Benowitz N.L., Peng M.W. Non-nicotine pharmacology for smoking cessation: mechanisms and prospects. CNS Drugs 2000; 13: 265—285.
8.Bespalov A., Dravolina O., Belozertseva I. et al. Lowered brain stimulation reward thresholds in rats treated with a combination of caffeine and N-methyl-D-aspartate but not alpha-amino-3-hydroxy-5-methyl-4- isoxazole propionate or metabotropic glutamate receptor-5 receptor antagonists. Behav Pharmacol 2006; 17: 295—302.
9.Bespalov A.Y., Dravolina O.A., Sukhanov I. et al. Metabotropic glutamate receptor (mGluR5) antagonist MPEP attenuated cueand scheduleinduced reinstatement of nicotine self-administration behavior in rats. Neuropharmacology 2005; 49: 167—178.
10.Bespalov A., Lebedev A., Panchenko G., Zvartau E. Effects of abused drugs on thresholds and breaking points of intracranial self-stimulation in rats. Eur Neuropsychopharmacol 1999; 9: 377—383.
11.Blaabjerg M., Fang L., Zimmer J., Baskys A. Neuroprotection against NMDA excitotoxicity by group I metabotropic glutamate receptors is associated with reduction of NMDA stimulated currents. Exp Neurol 2003;
183:573—580.
12.Blokhina E.A., Kashkin V.A., Zvartau E.E. et al. Effects of nicotinic and NMDA receptor channel blockers on intravenous cocaine and nicotine self-administration in mice. Eur Neuropsychopharmacol 2005; 15: 219— 225.
13.Brioni J.D., Kim D.J., O’Neill A.B. Nicotine cue: lack of effect of the alpha 7 nicotinic receptor antagonist methyllycaconitine. Eur J Pharmacol 1996;
301:1—5.
14.Buisson B., Bertrand D. Open-channel blockers at the human alpha4beta2 neuronal nicotinic acetylcholine receptor. Mol Pharmacol 1998; 53: 555— 563.
15.Caggiula A.R., Donny E.C., White A.R. et al. Cue dependency of nicotine self-administration and smoking. Pharmacol Biochem Behav 2001; 70: 515—530.
16.Carlezon W.A. Jr., Wise R.A. Microinjections of phencyclidine (PCP) and related drugs into nucleus accumbens shell potentiate medial forebrain bundle brain stimulation reward. Psychopharmacology 1996; 128: 413— 420.
17.Chavez-Noriega L.E., Crona J.H., Washburn M.S. et al. Pharmacological characterization of recombinant human neuronal nicotinic acetylcholine receptors h α2 β2, h α2 β4, h α3 β2, h α3 β4, h α4 β2, h α4 β4 and h α7 expressed in Xenopus oocytes. J Pharmacol Exp Ther 1997; 280: 346—356.
18.Chiamulera C., Epping-Jordan M.P., Zocchi A. et al. Reinforcing and locomotor stimulant e.ects of cocaine are absent in mGluR5 null mutant mice. Nature Neuroscience 2001; 4: 873—874.
19.Christie M.J., James L.B., Beart P.M. An excitant amino acid projection from the medial prefrontal cortex to the anterior part of nucleus accumbens in the rat. J Neurochem 1985; 45: 477—482.
20.Colpaert F.C. Drug-discrimination: behavioral, pharmacological and molecular mechanisms of discriminative drug effects. Behavioral Analysis of Drug Dependence. Eds. S.R. Goldberg, I.P. Stolerman. Orlando, Florida: Acad Press 1986; 161—194.
21.Corbett D. Possible abuse potential of the NMDA antagonist MK-801. Behav Brain Res 1989; 34: 239—246.
22.Di Chiara G., Clementi F., Fomasari D., Gotti C. Behavioural pharmacology and neurobiology of nicotine reward and dependence. Handbook of Experimental Pharmacology, Neuronal Nicotinic Receptors. Berlin: Springer-Verlag 2000; 144: 603—750.
23.Doherty A.J., Palmer M.J., Henley J.M. et al. (RS)-2-chloro-5-hydroxy- phenylglycine (CHPG) activates mGlu5, but no mGlu1, receptors expressed in CHO cells and potentiates NMDA responses in the hippocampus. Neuropharmacology 1997; 36: 265—267.
24.Dravolina O.A., Zakharova E.S., Shekunova E.V. et al. mGlu1 receptor blockade attenuates cueand nicotine-induced reinstatement of extinguished nicotine self-administration behavior in rats. Neuropharmacology 2007; 52: 263—269.
25.Ford R.D., Balster R.L. Schedule-controlled behavior in the morphinedependent rat. Pharmacol Biochem Behav 1976; 4: 569—573.
26.Fattinger K., Verotta D., Benowitz N.L. Pharmacodynamics of acute tolerance to multiple nicotinic effects in humans. J Pharmacol Exp Ther 1997; 281: 1238—1246.
27.Fu Y., Matta S.G., Gao W. et al. Systemic nicotine stimulates dopamine release in nucleus accumbens: re-evaluation of the role of N-methyl-D- aspartate receptors in the ventral tegmental area. J Pharmacol Exp Ther 2000; 294: 458—465.
28.Fudala P.J., Teoh K.W., Iwamoto E.T. Pharmacologic characterization of nicotine-induced conditioned place preference. Pharmacol Biochem Behav 1985; 22: 237—241.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
79 |

ОБЗОРЫ
29.Gasparini F., Lingenhohl K., Stoehr N. et al. 2-Methyl-6-(phenylethynyl)- 52. Kornetsky C., Esposito R.U. Euphorigenic drugs: effects on the reward
pyridine (MPEP), a potent, selective and systemically active mGlu5 receptor antagonist. Neuropharmacology 1999; 38: 1493—1503.
30.Gilling K.E., Weston A., Jatzke C. et al. Are the beneficial therapeutic effects of neuronal nicotinic receptor agonists due to activation or inactivation/ desensitization of alpha7 and alpha4beta2 receptors. Abstr Soc Neurosci 2002; 28: 432.
31.Glick S.D., Maisonneuve I.M., Dickinson H.A., Kitchen B.A. Comparative effects of dextromethorphan and dextrorphan on morphine, methamphetamine, and nicotine self-administration in rats. Eur J Pharmacol 2001; 422: 87—90.
32.Glick S.D., Maisonneuve I.M., Kitchen B.A. Modulation of nicotine self-
administration in rats by combination therapy with agents blocking α3 β4 nicotinic receptors. Eur J Pharmacol 2002; 448: 185—191.
33.Glick S.D., Maisonneuve I.M., Kitchen B.A., Fleck M.W. Antagonism of α3
β4 nicotinic receptors as a strategy to reduce opioid and stimulant selfadministration. Eur J Pharmacol 2002; 438: 99—105.
34.Gommans J., Stolerman I.P., Shoaib M. Antagonism of the discriminative and aversive stimulus properties of nicotine in C57BL/6J mice. Neuropharmacology 2000; 39: 2840—2847.
35.Gravius A., Pietraszek M., Schmidt W.J., Danysz W. Functional interaction of NMDA and group I metabotropic glutamate receptors in negatively reinforced learning in rats. Psychopharmacology (Berl) 2006; 185: 58—65.
36.Harrison A.A., Gasparini F., Markou A. Nicotine potentiation of brain stimulation reward reversed by DH beta E and SCH 23390, but not by eticlopride, LY 314582 or MPEP in rats. Psychopharmacology (Berl) 2002;
160:56—66.
37.Haustein K.O. Pharmacotherapy of nicotine dependence. Int J Clin Pharmacol Ther 2000; 38: 273—290.
38.Henry S.A., Lehmann-Masten V., Gasparini F. et al. The mGluR5 antagonist MPEP, but not the mGluR2/3 agonist LY314582, augments PCP effects on prepulse inhibition and locomotor activity. Neuropharmacology 2002; 43: 1199—1209.
39.Hernandez S.C., Bertolino M., Xiao Y. et al. Dextromethorphan and its metabolite dextrorphan block alpha3beta4 neuronal nicotinic receptors. J Pharmacol Exp Ther 2000; 293: 962—967.
40.Hiramatsu M., Murasawa H., Nabeshima T., Kameyama T. Effects of U-50,488H on scopolamine-, mecamylamineand dizocilpine-induced learning and memory impairment in rats. J Pharmacol Exp Ther 1998; 284: 858—867.
41.Homayoun H., Stefani M.R., Adams B.W. et al. Functional interaction between NMDA and mGlu5 receptors: effects on working memory, instrumental learning, motor behaviors, and dopamine release. Neuropsychopharmacology 2004; 29: 1259—1269.
42.Ivanova S., Greenshaw A.J. Nicotine-induced decreases in VTA electrical self-stimulation thresholds: blockade by haloperidol and mecamylamine but not scopolamine or ondansetron. Psychopharmacology (Berl) 1997;
134:187—192.
43.Jones R.T., Benowitz N.L., Davis K.L. et al. Therapeutics for nicotine addiction. Neuropsychopharmacology: the fifth generation of progress 2002; Chapter 107: 1533—1543.
44.Jorenby D.E., Leischow S.J., Nides M.A. et al. A controlled trial of sustainedrelease bupropion, a nicotine patch, or both for smoking cessation. N Engl J Med 1999; 340: 685—691.
45.Kalivas P.W. Neurotransmitter regulation of dopamine neurons in the ventral tegmental area. Brain Res Rev 1993; 18: 75—113.
46.Kalivas P.W., Duffy P., Barrow J. GABA and enkephalin projection from the nucleus accumbens and ventral pallidum to the ventral tegmental area. Neuroscience 1993; 57: 1047—1060.
47.Kane J.K., Hwang Y., Konu O. et al. Regulation of Homer and group I metabotropic glutamate receptors by nicotine. Eur J Neurosci 2005; 21: 1145—1154.
48.Kempsill F.E., Pratt J.A. Mecamylamine but not the alpha7 receptor antagonist alpha-bungarotoxin blocks sensitization to the locomotor stimulant effects of nicotine. Br J Pharmacol 2000; 131: 997—1003.
49.Kenny P.J., Markou A. The ups and downs of addiction: role of metabotropic glutamate receptors. Trends Pharmacol Sci 2004; 25: 265—272.
50.Kenny P.J., Paterson N.E., Boutrel B. et al. Metabotropic glutamate 5 receptor antagonist MPEP decreased nicotine and cocaine selfadministration but not nicotine and cocaine-induced facilitation of brain reward function in rats. Ann N Y Acad Sci 2003; 1003: 415—418.
51.Klink R., de Kerchove d’Exaerde A., Zoli M., Changeux J-P. Molecular and physiological diversity of nicotinic acetylcholine receptors in the midbrain dopaminergic nuclei. J Neurosci 2001; 21: 1452—1463.
pathways of the brain. Fed Proc 1979; 38: 2473—2476.
53.Lesage A.S.J., Bischoff F., Van Beijsterveldt L. et al. Novel, centrally active mGluR1antagonists:invitroandinvivopharmacology.Neuropharmacology 2002; 43: 295.
54.Liu X., Caggiula A.R., Yee S.K. et al. Reinstatement of nicotine-seeking behavior by drug-associated stimuli after extinction in rats. Psychopharmacology (Berl) 2005; 15: 1—9.
55.Loscher W., Potschka H., Wlaz P. et al. Are neuronal nicotinic receptors a target for antiepileptic drug development? Studies in different seizure models in mice and rats. Eur J Pharmacol 2003; 466: 99—111.
56.Lukas R.J., Changeux J.P., Le Novere N. et al. International Union of Pharmacology. XX. Current status of the nomenclature for nicotinic acetylcholine receptors and their subunits. Pharmacol Rev 1999; 51: 397— 401.
57.Malin D.H., Alvarado C.L., Woodhouse K.S. et al. Passive immunization against nicotine attenuates nicotine discrimination. Life Sci 2002; 70: 2793—2798.
58.Mansbach R.S., Chambers L.K., Rovetti C.C. Effects of the competitive nicotinic antagonist erysodine on behavior occasioned or maintained by nicotine: comparison with mecamylamine. Psychopharmacology (Berl) 2000; 148: 234—242.
59.Mansvelder H.D., De Rover M., McGehee D.S., Brussaard A.B. Cholinergic modulation of dopaminergic reward areas: upstream and downstream targets of nicotine addiction. Eur J Pharmacol 2003; 480: 117—123.
60.Mansvelder H.D., Keath J.R., McGehee D.S. Synaptic mechanisms underlie nicotine-induced excitability of brain reward areas. Neuron 2002; 33: 905— 919.
61.Mansvelder H.D., McGehee D.S. Long-term potentiation of excitatory inputs to brain reward areas by nicotine. Neuron 2000; 27: 349—357.
62.McGeehan A.J., Olive M.F. The mGluR5 antagonist MPEP reduces the conditioned rewarding effects of cocaine but not other drugs of abuse. Synapse 2003; 47: 240—242.
63.Olausson P., Jentsch J.D., Taylor J.R. Nicotine enhances responding with conditioned reinforcement. Psychopharmacology (Berl) 2004; 171: 173— 178.
64.Overton P.G., Clark D. Burst firing in midbrain dopaminergic neurons. Brain Res Brain Res Rev 1997; 25: 312—334.
65.Papke R.L., Sanberg P.R., Shytle R.D. Analysis of mecamylamine stereoisomers on human nicotinic receptor subtypes. J Pharmacol Exp Ther 2001; 297: 646—656.
66.Paterson N.E., Markou A. Prolonged nicotine dependence associated with extended access to nicotine self-administration in rats. Psychopharmacology (Berl) 2004; 173: 64—72.
67.Paterson N.E., Semenova S., Gasparini F., Markou A. The mGluR5 antagonist MPEP decreased nicotine self-administration in rats and mice. Psychopharmacology (Berl) 2003; 167: 257—264.
68.Popik P., Wrobel M. Morphine conditioned reward is inhibited by MPEP, the mGluR5 antagonist. Neuropharmacology 2002; 43: 1210—1217.
69.Ranaldi R., Bauco P., Wise R.A. Synergistic effects of cocaine and dizocilpine (MK-801) on brain stimulation reward. Brain Res 1997; 760: 231—237.
70.Ranaldi R., French E., Roberts D.C. Systemic pretreatment with MK-801 (dizocilpine) increases breaking points for self-administration of cocaine on a progressive-ratio schedule in rats. Psychopharmacology 1996; 128: 83— 88.
71.Rezvani A.H., Levin E.D. Cognitive effects of nicotine. Biol Psychiatry 2001; 49: 258—267.
72.Rose J.E., Behm F.M., Westman E.C. Nicotine-mecamylamine treatment for smoking cessation: the role of pre-cessation therapy. Exp Clin Psychopharmacol 1998; 6: 331—343.
73.Rose J.E., Behm F.M., Westman E.C. Brand-switching and gender effects in mecamylamine/nicotine smoking cessation treatment. Nicotine Tobacco Res 1999; 1: 286—287.
74.Salas R., Pieri F., De Biasi M. Decreased signs of nicotine withdrawal in mice null for the beta4 nicotinic acetylcholine receptor subunit. J Neurosci 2004; 24: 10035—10039.
75.Schilstrom B., Fagerquist M.V., Zhang X. et al. Putative role of presynaptic alpha7* nicotinic receptors in nicotine stimulated increases of extracellular levels of glutamate and aspartate in the ventral tegmental area. Synapse 2000; 38: 375—383.
76.Sesack S.R., Pickel V.M. Prefrontal cortical efferents in the rat synapse on unlabeled neuronal targets of catecholamine terminals in the nucleus
80 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |

ЛЕЧЕНИЕ НИКОТИНОВОЙ ЗАВИСИМОСТИ
accumbens septi and on dopamine neurons in the ventral tegmental area. J Comp Neurol 1992; 320: 145—160.
77.Shoaib M., Benwell M.E., Akbar M.T. et al. Behavioural and neurochemical adaptations to nicotine in rats: influence of NMDA antagonists. Br J Pharmacol 1994; 111: 1073—1080.
78.Shoaib M., Bizarro L. Deficits in a sustained attention task following nicotine withdrawal in rats. Psychopharmacology (Berl) 2005; 178: 211— 222.
79.Steffensen S.C., Svingos A.L., Pickel V.M., Henriksen S.J. Electrophysiological characterization of GABAergic neurons in the ventral tegmental area. J Neurosci 1998; 18: 8003—8015.
80.Stolerman I.P., Chamberlain S., Bizarro L. et al. The role of nicotinic receptor alpha 7 subunits in nicotine discrimination. Neuropharmacology 2004; 46: 363—371.
81.Taylor P., Hardman J.G., Limbird L.E., Gilman A.G. Agents acting at the neuromuscular junction and autonomic ganglia. Goodman & Gilman’s the pharmacological basis of therapeutics 10th ed 2001; Chapter 9: 193—214.
82.Tessari M., Pilla M., Andreoli M. et al. Antagonism at metabotropic glutamate 5 receptors inhibits nicotineand cocaine-taking behaviours and prevents nicotine-triggered relapse to nicotine-seeking. Eur J Pharmacol 2004; 499: 121—133.
83.Touiki K., Rat P., Molimard R., Chait A., de Beaurepaire R. Effects of tobacco and cigarette smoke extracts on serotonergic raphe neurons in the rat. Neuroreport 2007; 18: 925—929.
84.Vann R., Balster R., Beardsley P. Dose, duration, and pattern of nicotine administration as determinants of behavioral dependence in rats. Psychopharmacology (Berl) 2005; 7: 1—12.
85.Walaas I., Fonnum F. Biochemical evidence for glutamate as a transmitter in hippocampal efferents to the basal forebrain and hypothalamus in the rat brain. Neuroscience 1980; 5: 63—72.
86.Watkins S.S., Epping-Jordan M.P., Koob G.F., Markou A. Blockade of nicotine self-administration with nicotinic antagonists in rats. Pharmacol Biochem Behav 1999; 62: 743—751.
87.Wonnacott S. Presynaptic nicotinic ACh receptors. Trends Neurosci 1997; 20: 92—98.
88.Wonnacott S. The paradox of nicotinic acetylcholine receptor upregulation by nicotine. Trends Pharmacol Sci 1990; 11: 216—219.
89.Wooltorton J.R., Pidoplichko V.I., Broide R.S., Dani J.A. Differential desensitization and distribution of nicotinic acetylcholine receptor subtypes in midbrain dopamine areas. J Neurosci 2003; 23: 3176—3185.
90.Xue Y., Domino E.F. Tobacco/nicotine and endogenous brain opioids. Prog Neuropsychopharmacol Biol Psychiat 2007. (in press).
91.Zakharova E.S., Danysz W., Bespalov A.Y. Drug discrimination analysis of NMDA receptor channel blockers as nicotinic receptor antagonists in rats. Psychopharmacology (Berl) 2005; 179: 128—135.
92.Zhao R., Chen H., Sharp B.M. Nicotine-induced norepinephrine release in hypothalamic paraventricular nucleus and amygdala is mediated by N-methyl-D-aspartate receptors and nitric oxide. J Pharmacol Exp Ther 2007; 320: 837—844.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
81 |
