
Журнал неврологии и психиатрии / 2010 / NEV_2010_07_059
.pdf
ЛЕКЦИЯ
Рациональные фармакотерапевтические алгоритмы ведения пациентов с болезнью Альцгеймера
Чл.-корр. РАМН, д.м.н., проф. Ю.Б. БЕЛОУСОВ, А.Н. ДАНИЛОВ, д.м.н., проф. С.К. ЗЫРЯНОВ
Rational pharmaco-therapeutic algorithms for the management of Alzheimer’s disease
YU.B. BELOUSOV, A.N. DANILOV, S.K. ZYRIANOV
Кафедра клинической фармакологии РГМУ, Москва
Ключевые слова: болезнь Альцгеймера, лечение, ингибиторы холинэстеразы, антагонисты NMDA-рецепторов.
Key words: Alzheimer’s disease, treatment, acetylholinest inhibitors, NMDA-receptors.
За последние 10 лет был достигнут значительный успех в фармакотерапии болезни Альцгеймера (БА). Основу терапии составляют ингибиторы холинэстеразы
— ривастигмин, донепезил и галантамин, а также антагонист NMDA-рецепторов — мемантин.
Первичное звено здравоохранения играет все возрастающую роль в диагностике и лечении пациентов с БА. На сегодняшний день врачам общей практики в развитых странах доступен ряд национальных руководств по диагностике и лечению БА, имеющих своей целью установление эффективного контроля над заболеванием. В разработке таких руководств принимают участие ведущие специалисты в области неврологии, психиатрии, гериатрии, терапии и сестринской помощи, формируются специальные междисциплинарные рабочие группы, государственные и общественные организации, занятые проблематикой БА. В США такой рабочей группой является Совет по лечению болезни Альцгеймера (Alzheimer’s Disease Management Council — ADMC), в Европе — экспертная комиссия Европейской федерации неврологических обществ (European Federation of Neurological Societies — EFNS) [6, 24].
Цель настоящей работы — обобщение принятых в США и Европе клинических рекомендаций в аспекте актуальных, доказательно обоснованных фармакотерапевтических алгоритмов, при следовании которым удается достичь улучшения у пациентов с различными стадиями БА.
Ранняя диагностика болезни Альцгеймера
Ранняя диагностика и своевременное начало лечения необходимы для сохранения максимально высокого уровня когнитивных и функциональных способностей у пациентов, страдающих БА. Следовательно, диагностические критерии должны быть достаточно чувствительными, чтобы выявлять БА на самых ранних стадиях заболевания. С этой целью ADMC рекомендует простые диагностические критерии для БА из принятой в США справочной системы по диагностике и статистике психических расстройств DSM-IV (Diagnostic and Statistical Manual of Mental Disorders — 4th Edition).
© Коллектив авторов, 2010
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:7:59
Согласно DSM-IV, БА характеризуется снижением памяти или, по меньшей мере, одним из следующих когнитивных расстройств: афазией, апраксией, агнозией или нарушением исполнительных функций. При этом должны отсутствовать другие причины, вызывающие сходную симптоматику. Когнитивные отклонения при БА представлены постепенным снижением умственных способностей по сравнению с исходным уровнем. Характерно прогредиентное течение заболевания. Постепенное, прогрессирующее когнитивное снижение и ухудшение функционального статуса, которые происходят при БА, не соответствуют нормальным возрастным изменениям. В отличие от возрастных изменений, когнитивные расстройства при БА носят более грубый характер: наблюдаются снижение памяти по амнестическому типу вплоть до амнестической афазии, нарушение пространственно-зри- тельного восприятия, снижение критики. Пациенты теряют социальные навыки и со временем перестают себя обслуживать. Для количественной оценки состояния психического здоровья возможно применение различных тестов и шкал, подобных опроснику MMSE (Mini-Mental State Examination). Они играют ключевую роль в мониторинге терапевтических вмешательств при данном заболевании. Возможно применение и более сложных шкал, позволяющих провести более детальную оценку психического состояния больных.
Цели лечения болезни Альцгеймера
В связи с невозможностью окончательного излечения от БА основными целями лекарственной терапии являются временное улучшение, стабилизация или смягчение когнитивных, функциональных и поведенческих расстройств. При выполнении этих целей становится возможным уменьшение затрат по уходу за больным и более поздняя госпитализация (или помещение в интернат). Важно, чтобы врачи объясняли пациентам и лицам, осуществляющим уход за больным, что клинические улучшения могут быть не всегда явными и следует особо подчеркивать, что лекарственная терапия предназначена для замедления ухудшения психического состояния пациентов,
Тел.: 8 (499) 2612590
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
59 |
|
|
60 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |

ФАРМАКОТЕРАПИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
течение 24 нед. При лечении БА легкой и средней тяжести добавление мемантина к АХЭ-терапии не оправдано, поскольку не приносит дополнительной клинической выгоды [17]. В 2007 г. немецкими исследователями [7] был проведен мета-анализ, суммировавший результаты 7 рандомизированных плацебо-контролируемых клинических исследований. Результаты мета-анализа свидетельствуют о недостаточной эффективности мемантина в отношении различных показателей (когнитивные показатели, способность к самообслуживанию, качество жизни пациентов и их опекунов, смертность) как в виде монотерапии, так и в комбинации с АХЭ-средствами даже при БА средней и тяжелой степени. Тем не менее следует отметить необходимость проведения дальнейших качественных исследований для оценки долговременных эффектов мемантина, поскольку в вышеуказанном мета-анализе оценивались эффекты только через 6 мес после начала лечения.
Таким образом, на основании результатов двойных слепых, рандомизированных, плацебо-контролируемых исследований ривастигмин, донепезил и галантамин рекомендованы в качестве препаратов выбора у пациентов с легкой и средней степенями тяжести БА; тогда как мемантин рекомендован для использования только у пациентов со степенью тяжести заболевания от средней до тяжелой.
Нежелательные явления, дозирование и титрование дозы
Нежелательные явления, которые наблюдаются при использовании АХЭ-средств, напрямую связаны с их холинергическим влиянием на парасимпатическую нервную систему и эффекторные органы, в первую очередь, секреторные железы и мышечную ткань [14]. Холинергические побочные эффекты, такие как слабо или умеренно выраженная тошнота, рвота и диарея, являются транзиторными и встречаются по большей части на протяжении периода титрования дозы. Прямая зависимость выраженности нежелательных явлений от дозы препарата сохраняется только в случае резких изменений дозировки. При длительном регулярном приеме ингибитора холинэстеразы в постоянной дозе наступает десенситизация периферических холинорецепторов, поэтому нежелательные явления редуцируются. Пациенты и ухаживающие за ними лица должны быть информированы о возможных побочных эффектах при лечении ингибиторами холинэстеразы и заверены, что эти явления пройдут с продолжением терапии. Пациентам также следует советовать принимать ривастигмин или галантамин с пищей, чтобы уменьшить побочные эффекты со стороны желудочно-кишечного тракта. Следует контролировать массу тела пациентов, принимающих ривастигмин, ввиду повышенного риска
ееснижения при длительном использовании препарата.
Вкрупном когортном исследовании [10] показан высокий риск развития клинически значимой брадикардии, синкопальных состояний и травм, обусловленных падениями, на фоне приема ингибиторов холинэстеразы. Механизм развития брадикардии с последующими синкопами и падениями обусловлен холинергическим влиянием препаратов на сердце. В профилактике данных осложнений большую роль играет регулярный контроль ЭКГ у пациентов, получающих АХЭ-средства.
Потенциальный риск побочных эффектов, встречающихся при фармакокинетическом лекарственном взаимо-
действии, особенно высок у пожилых пациентов, так как они, как правило, получают несколько медикаментов. Донепезил и галантамин метаболизируются цитохромом Р450 в печени, в связи с чем они могут взаимодействовать с другими лекарственными средствами, влияющими на работу цитохрома Р450. Ривастигмин первоначально подвергается гидролизу эстеразами головного мозга, поэтому при терапии ривастигмином клинически значимых лекарственных взаимодействий не отмечено.
Для предупреждения развития холинергических побочных эффектов разработаны ступенчатые схемы назначения препаратов с последовательным титрованием дозы. Особенно пристальное внимание следует уделить необходимости постоянного регулярного приема лекарства. Поскольку даже при кратковременных перерывах наблюдается увеличение числа нежелательных явлений, при прекращении приема препарата более чем на неделю требуется повторное его назначение в самой низкой дозировке, что отрицательно влияет на сроки достижения оптимальных дозировок и эффективность всего лечения. Решением данной проблемы могут стать новые формы доставки лекарственных средств, включая трансдермальные терапевтические системы (ТТС) [1], перспективы применения которых обсуждаются ниже.
При использовании мемантина спутанность сознания может возникнуть при титровании дозы препарата и обычно является преходящей. Основными причинами для прекращения приема препарата являются сонливость, падения, головные боли и спутанность сознания.
Перспективные подходы в применении ингибиторов холинэстеразы
Ингибиторы холинэстеразы проявляют дозозависимый эффект, при этом увеличение дозы сопровождается увеличением эффективности. Однако назначение высоких доз ингибиторов холинэстеразы сопровождается значительными изменениями плазменной концентрации препарата, что вообще типично при назначении препаратов per os, и соответственно приводит к развитию неблагоприятных побочных реакций со стороны желудочнокишечного тракта. Развитие побочных эффектов, которые возникают в процессе титрования дозы может стать препятствием для достижения оптимальной, терапевтической дозы орального ингибитора холинэстеразы в клинической практике.
Избежать вышеупомянутых флюктуаций плазменной концентрации препарата позволяет использование такой лекарственной формы препарата, как ТТС [1], которая обеспечивает равномерное поступление в кровь действующего вещества и поддержание стабильной плазменной концентрации за счет продленного высвобождения лекарственного препарата, что позволяет избегать значительных пиков концентрации (Сmax) и резких ее провалов (Cmin), которые зачастую и приводят к появлению побочных эффектов лекарственного средства. В настоящее время ТТС разработана только для ривастигмина.
Из результатов клинических исследований ингибиторов холинэстеразы можно заключить, что их эффективность максимальна при возможно более длительном применении. Однако вследствие недостаточной комплаентности пациентов, связанной в большинстве случаев с развивающимися побочными эффектами, и недостаточной эффективности субоптимальных дозировок лечение зача-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
61 |

ЛЕКЦИЯ
стую продолжается менее 1 года. Исходя из вышесказанного, можно предположить, что использование ТТС, как способа доставки лекарственного средства, может улучшить комплаентность больных и вследствие этого повысить клиническую эффективность терапии пациентов с деменцией.
В исследовании IDEAL пациенты, страдающие БА, были рандомизированы в 4 группы, одна из которых получала плацебо, а остальные — активное лечение: ТТС, высвобождающие по 9,5 мг (10 см2) либо 17,4 мг (20 см2) ривастигмина равномерно в течение 24 ч, или капсулы с ривастигмином в дозе 6 мг 2 раза в день. Активное лечение в каждой группе оказывало существенный положительный эффект на когнитивные показатели в отличие от плацебо. ТТС, выделяющая 9,5 мг препарата оказывала эффект, сравнимый с приемом внутрь 12 мг в сутки ривастигмина, при этом частота нежелательных явлений была примерно в 3 раза меньше. Пластырь, обеспечивающий поступление в организм 17,4 мг ривастигмина в сутки, был практически эквивалентен пероральному приему 12 мг в сутки препарата по количеству побочных эффектов, при этом улучшение когнитивных функций наступало раньше и было сильнее выражено при использовании трансдермального пути введения [26].
Применение лекарственных препаратов и биологически активных добавок с недоказанной эффективностью
При БА нередко используются альтернативные перечисленные выше препараты, биопрепараты и биологически активные добавки. Одним из них является гингко билоба — препарат, обладающий некоторой эффективностью. Однако недавно проведенные исследования [24] показали непостоянство соответствующих результатов. Сомнительной остается и эффективность витамина Е, хотя в некоторых исследованиях [16] было установлено его положительное действие по показателям смертности больных, частоты помещения их в интернат и переходу в тяжелую стадию деменции. В последующих крупных исследованиях [16] эти данные не были подтверждены. Кроме того, оказалось, что применение витамина Е связано с высоким риском развития тромбоза.
Препаратами, в отношении которых данных недостаточно или предполагается даже полное отсутствие эффективности при их применении, являются ницерголин, пирацетам, витамин С, заместительная гормональная терапия, нестероидные противовоспалительные препараты, лецитин, ацетил-L-карнитин, мелатонин, витамин В12 и витамин В6, церебролизин [6, 24]. В отношении последнего в настоящее время имеются крайне ограниченные доказательные данные, указывающие на большую эффективность его применения лишь в сочетании с донепезилом по сравнению с комбинацией донепезила и плацебо. Для уточнения роли этого препарата в лечении БА требуются дальнейшие контролируемые исследования.
Идея применения противовоспалительных средств для лечения БА основана на патоморфологических данных о наличии воспаления с вовлечением аутоиммунных механизмов в патогенезе заболевания. Однако клинические исследования [15] преднизолона, рофекоксиба, напроксена и диклофенака не показали какой-либо эффективности. В моделях на животных было установлено, что эстрогены увеличивают активность ацетилхолинтрансферазы, растворимость амилоида и даже способствуют вос-
становлению синапсов. Но недавно завершенные длительные рандомизированные клинические исследования [23] заместительной гормональной терапии у женщин в постменопаузе показали не только отсутствие профилактической ценности такого лечения в отношении БА, но даже обратный эффект — возрастание риска развития данной патологии. Применение мелатонина основано на дефиците этого пептида в ткани головного мозга и связанных с этим нарушениях сна при БА, однако клинические исследования [19] не подтвердили наличия преимуществ экзогенного мелатонина по сравнению с плацебо.
Одной из перспективных групп препаратов для профилактики развития БА в настоящее время считаются статины. В эпидемиологических исследованиях [11, 12] показано меньшее число госпитализаций по поводу деменции и снижение относительного риска развития БА при длительном приеме статинов вне зависимости от липофильности применяемого препарата. Однако для окончательного суждения об антидементных возможностях статинов требуются дальнейшие проспективные рандомизированные контролируемые исследования.
Мониторинг терапевтического ответа |
Схемы обследования больных, применяемые в науч- |
ных исследованиях для оценки эффективности препара- |
тов при БА, в основном не пригодны к использованию в |
клинической практике. Методы оценки, которые могут |
быть использованы в клинической практике для монито- |
ринга изменения когнитивных и функциональных спо- |
собностей в связи с назначенной фармакотерапией, вклю- |
Рис. 1. Алгоритм лечения пациентов с болезнью Альцгеймера от |
легкой до умеренной степени тяжести, одобренный специали- |
стами ADMC. |
62 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
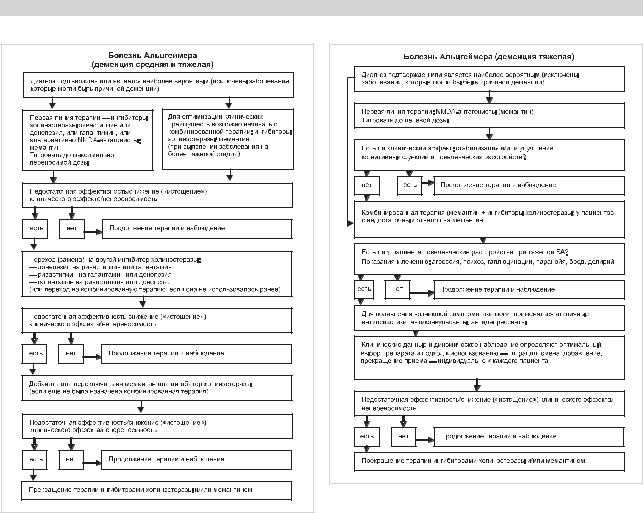
Рис. 2. Алгоритм лечения пациентов с болезнью Альцгеймера от |
умеренной до тяжелой степени, одобренный специалистами |
ADMC. |
чают упомянутый ранее тест MMSE, а также менее распространенную шкалу IADLS (Instrumental Activities of Daily Living Scale). Следует заметить, что чувствительность этих инструментов к изменениям, вызываемым лекарственными препаратами, не столь высока и зачастую целенаправленный опрос персонала и родственников, оказывающих больному помощь, позволяет составить гораздо более полную картину изменений в состоянии пациентов на фоне лечения.
Период, в течение которого должно происходить наблюдение психического состояния больного, составляет не менее 6 мес, и только по его окончании возможно принятие решения об эффективности терапии.
Замена препарата внутри группы ингибиторов холинэстеразы
Неуспех при применении одного ингибитора холинэстеразы не означает, что пациент нечувствителен к другим препаратам этой группы. Возможность замены препаратов внутри группы ингибиторов холинэстеразы следует учитывать в тех случаях, когда со временем развивается недостаточность или потеря эффективности терапии, либо проблемы, связанные с безопасностью/переносимостью препарата. Перед заменой препарата необходимо провести корректировку дозы уже принимаемого лекарства, так как это является последней возможностью оптимизации его приема.
ФАРМАКОТЕРАПИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА |
Рис. 3. Алгоритм лечения пациентов с болезнью Альцгеймера |
тяжелой степени ADMC. |
Установлено, что смена галантамина или донепезила на ривастигмин может быть безопасной без «отмывочного» периода, если при приеме первого препарата отсутствовали нежелательные побочные явления. Однако если у пациента имелись побочные эффекты на фоне приема первого препарата, то такой период (7—14 дней) является обязательным. Пациентов следует наблюдать особенно тщательно в связи с возможным развитием холинергической токсичности в период смены препаратов. Ривастигмин и галантамин имеют более короткий период полувыведения, и смена одного из этих препаратов может проводиться после однодневного отмывочного периода [4].
Алгоритмы лечения и препараты выбора
Эксперты упоминавшихся в начале статьи рабочих групп — ADMC и EFNS [6, 24] разработали доказательно обоснованные алгоритмы лечения, очерчивающие пути эффективного фармакологического вмешательства при БА с разной степенью тяжести психических расстройств: от легкой до умеренной, от умеренной до тяжелой и у пациентов с тяжелыми расстройствами. Они воспроизведены на рис. 1—3.
Ведущие организации, изучающие проблему БА, отводят ингибиторам холинэстеразы роль препаратов выбора при лечении пациентов со степенью тяжести заболевания от легкой до умеренной. Для того, чтобы получить наилучший результат лечения при приеме этих препаратов, важно начать его максимально рано после установления диагноза и медленно титровать дозу лекарственного
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
63 |

ЛЕКЦИЯ
средства до максимальной переносимой у данного пациента в пределах терапевтического интервала применения ингибиторов холинэстеразы. Если эффективная доза внутри терапевтического интервала для исходно назначенного ингибитора холинэстеразы не может быть достигнута, следует начать титрование другого препарата из этой группы.
Одним из решений проблемы развития непереносимости ингибиторов холинэстеразы в результате их периферического холинергического влияния является применение ТТС (в настоящее время такая форма разработана только для ривастигмина). Данная форма доставки проста и удобна в использовании, что позволяет улучшить комплаентность пациента. С учетом когнитивного дефицита, развивающегося при БА, немаловажно отметить удобство трансдермального способа доставки для лиц, осуществляющих уход за пациентом. В случае использования трансдермальной системы как для опекунов, так и для врача упрощается контроль за соблюдением назначения ингибитора холинэстеразы. Кроме того, следует отметить по-
тенциальную дополнительную выгоду от двойного ингибирования ацетилхолинэстеразы и бутирилхолинэстеразы за счет использования в качестве активного компонента ривастигмина.
Мемантин может использоваться в качестве монотерапии или в комбинации с ингибиторами холинэстеразы у пациентов с БА умеренной и тяжелой степени, использование этого препарата при степени тяжести заболевания от легкой до умеренной не приносит дополнительной клинической выгоды.
Оптимальное качество лечения на ранних и средних стадиях БА нуждается в мониторинге ответа пациента на лечение в целях своевременного определения момента для смены препарата или назначения комбинированной лекарственной терапии и в максимально возможном сохранении качества жизни как самого пациента, так и лиц, его окружающих. На поздних стадиях БА поддержание функций, контроль нарушений поведения, поддержка семьи и комфорт пациента являются наиболее важными результатами помощи больному.
ЛИТЕРАТУРА
1.Белоусов Ю.Б. Трансдермальные терапевтические системы. Каче15. McGeer P.L., McGeer E.G. NSAIDs and Alzheimer disease: epidemiologi-
ственная клиническая практика 2001;1:7—10.
2.Ballard G.G. Advances in the treatment of Alzheimer’s disease: benefits of dual cholinesterase inhibition. Eur Neurol 2002;47:64—70.
3.Birks J. Cholinesterase inhibitors for Alzheimer’s disease. Cochrane Database Syst Rev 2006;CD005593.
4.Dantoine T., Auriacombe S., Sarazin M. et al. Rivastigmine monotherapy and combination therapy with memantine in patients with moderately severe Alzheimer's disease who failed to benefit from previous cholinesterase inhibitor treatment. Int J Clin Pract 2006;60:1:110—118.
5.Farlow M., Anand R., Messina J. Jr. et al. A 52-week study of the efficacy of rivastigmine in patients with mild to moderately severe Alzheimer’s disease. Eur Neurol 2000;44:4:236—241.
6.Farlow M.R., Cummings J.L. Effective pharmacologic management of Alzheimer disease. Am J Med 2007;120:388—397.
7.Final report is now available. IQWiG doubts the effectiveness of memantine. MMW Fortschr Med 2009;151:39:6.
8.Francis P.T., Palmer A.M., Snape M. et al. The cholinergic hypothesis of Alzheimer’s disease: a review of progress. J Neurol Neurosurg Psychiat 1999;66:137—147.
9.Gehrman P.R., Connor D.J., Martin J.L. et al. Melatonin fails to improve sleep or agitation in double-blind randomized placebo-controlled trial of institutionalized patients with Alzheimer disease. Am J Geriat Psychiat 2009;17:2:166—169.
10.Gill S.S., Anderson G.M., Fischer H.D. et al. Syncope and its consequences in patients with dementia receiving cholinesterase inhibitors: a populationbased cohort study. Arch Int Med 2009;169:9:867—873.
11.Haag M.D., Hofman A., Koudstaal P.J. et al. Statins are associated with a reduced risk of Alzheimer disease regardless of lipophilicity. The Rotterdam Study. J Neurol Neurosurg Psychiat 2009;80:1:13—17.
12.Horsdal H.T., Olesen A.V., Gasse C. et al. Use of statins and risk of hospitalization with dementia: a Danish population-based case-control study. Alzheimer Dis Ass Dis 2009;23:1:18—22.
13.Hynd M.R., Scott H.L., Dodd P.R. Glutamate-mediated excitotoxicity and neurodegeneration in Alzheimer’s disease. Neurochem Int 2004;45:5:583— 595.
14.Imbimbo B.P. Pharmacodynamic-tolerability relationships of cholinesterase inhibitors for Alzheimer’s disease. CNS Drugs 2001;15:5:375—390.
cal, animal model and clinical studies. Neurobiol Aging 2007;28:5:639— 647.
16.Petersen R.C., Thomas R.G., Grundman M. et al. Vitamin E and donepezil
for the treatment of mild cognitive impairment. N Engl J Med 2005;352:23:2379—2388.
17.Porsteinsson A.P., Grossberg G.T., Mintzer J. et al. Memantine treatment in patients with mild to moderate Alzheimer‘s disease already receiving a cholinesterase inhibitor: a randomized, double-blind, placebo-controlled trial. Curr Alzheimer Res 2008;5:1:83—89.
18.Raskind M.A., Peskind E.R., Wessel T., Yuan W. Galantamine in AD: A 6-month randomized, placebo-controlled trial with a 6-month extension. The Galantamine USA-1 Study Group. Neurology 2000;54:12:2261— 2268.
19.Rogers S.L., Farlow M.R., Doody R.S. et al. A 24-week, double-blind, place- bo-controlled trial of donepezil in patients with Alzheimer’s disease. Donepezil Study Group. Neurology 1998;50:1:136—145.
20.Rosler M., Anand R., Cicin-Sain A. et al. Efficacy and safety of rivastigmine in patients with Alzheimer’s disease: international randomised controlled trial. BMJ 1999;318:7184:633—638.
21.Schmitt F.A., van Dyck C.H., Wichems C.H. et al. Cognitive response to memantine in moderate to severe Alzheimer disease patients already receiving donepezil: an exploratory reanalysis. Alzheimer Dis Ass Dis 2006;20:4:255— 262.
22.Schneider L.S., Anand R., Farlow M.R. Systematic review of the efficacy of rivastigmine for patients with Alzheimer’s disease. Int J Geriatr Psychopharmac 1998;1:Suppl 1:26—34.
23.Simpkins J.W., Singh M. More than a decade of estrogen neuroprotection. Alzheimers Dement 2008;4:1:Suppl 1:131—136.
24.Waldemar G., Dubois B., Emre M. et al. Recommendations for the diagnosis and management of Alzheimer’s disease and other disorders associated with dementia: EFNS guideline. Eur J Neurol 2007;14:1—26.
25.Winblad B., Jelic V. Long-term treatment of Alzheimer disease: efficacy and safety for acetylholinesterase inhibitors. Alzheimer Dis Ass Dis 2004;18:Suppl 1:2—8.
26.Winblad B., Grossberg G., Frölich L. et al. IDEAL: a 6-month, double-blind, placebo-controlled study of the first skin patch for Alzheimer disease. Neurology 2007;69:4:Suppl 1:14—22.
64 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
