
Журнал неврологии и психиатрии / 2010 / NEV_2010_07_035
.pdf
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
Патогенетические особенности развития постинсультных аффективных расстройств
Член-корр. РАМН, проф. В.И. СКВОРЦОВА1,2, к.м.н., доц. Е.А. ПЕТРОВА1,2, к.б.н., рук. лаб. О.С. БРУСОВ3, к.м.н., с.н.с. М.А. САВИНА3, Н.В. ШАКЛУНОВА1,
д.б.н., рук. лаб. Т.П. КЛЮШНИК3, Н.А. ГЕОРГИЕВСКАЯ1, к.б.н., в.н.с. М.И. ФАКТОР3
Pathogenetic characteristics of post stroke affective disorders
V.I. SKVORTSOVA, E.A. PETROVA, O.S. BRUSOV, M.A. SAVINA, N.V. SHAKLUNOVA, T.P. KLUSHNIK, N.A. GEORGIEVSKAYA, M.I. FACTOR
1Кафедра фундаментальной и клинической неврологии и нейрохирургии Российского государственного медицинского университета;
2НИИ цереброваскулярной патологии и инсульта Российского государственного медицинского университета; 3Научный центр
психического здоровья РАМН, Москва
Обследованы 50 больных с впервые возникшим церебральным ишемическим инсультом. Спектр аффективных нарушений включал постинсультные депрессии, генерализованное тревожное расстройство, тревожно-депрессивные состояния, псевдопостинсультные депрессии. Исследование уровня тромбоцитарного серотонина (ТС) позволило заключить, что концентрация ТС в 1-е сутки инсульта и динамика изменения его уровня к 28-м суткам связана с развитием у больных постинсультных аффективных нарушений. Развитие тревожно-депрессивных расстройств в остром периоде инсульта связано с локализацией очага поражения головного мозга. Фактором риска развития отсроченных аффективных расстройств может служить низкий уровень ТС у больных в 1—3-и сутки инсульта.
Ключевые слова: инсульт, постинсультные аффективные расстройства, тромбоцитарный серотонин, сывороточный α1 протеиназный ингибитор.
Fifty patients with affective disorders developed after first cerebral stroke were studied. A spectrum of affective disorders included post-stroke depressions, generalized anxiety disorders, anxiety-depressive disorders and pseudo post-stroke depressions. Platelet serotonin (PS) levels were measured in these patients as well. The levels of PS at the first three days after stroke and their changes towards the 28th day are associated with the development of post-stroke affective disorders. The development of anxiety-depressive disorders in the acute period of stroke is related to the localization of brain lesion focus. The low levels of PS in patients at the first three days after stroke may be the risk factor of delayed affective disorders development.
Key words: stroke, post-apoplectic affective disorders, platelet serotonin, serum α1 proteinase inhibitor.
Проблема лечения и реабилитации больных с церебральным инсультом до сих пор одна из наиболее актуальных и трудных в современной клинической неврологии. Одним из факторов, влияющих на процесс реабилитации, является формирование целого комплекса психопатологических состояний. Нередко психическая патология может не только выходить на первый план, но и быть определяющей в восстановлении двигательных и речевых функций больных, их социальной и бытовой адаптации, влиять на показатели смертности.
По данным различных исследований, распространенность аффективных нарушений после инсульта достигает 30—60%, а риск возникновения деменции увеличивается в 4—12 раз [4, 7, 17, 44]. Депрессивные нарушения являются самыми частыми психическими расстройствами после инсульта [4—7]. Развитие постинсультных депрессий (ПД) увеличивает длительность госпитализации, замедляет восстановление нарушенных неврологических функций, ухудшает качество жизни и повышает частоту смер-
тельных исходов у больных в течение последующих лет [14, 22]. Кроме того, более 50% пациентов, перенесших инсульт, страдают тревожно-депрессивными расстройствами [11, 23, 39]. Чаще всего речь идет о коморбидном для ПД генерализованном тревожном расстройстве (ГТР). Показано, что ГТР влияет на многие клинические аспекты ПД, включая период появления, продолжительность, степень тяжести, реакцию на терапию [6, 8, 13].
Генез возникающих в результате инсульта аффективных расстройств весьма сложен и недостаточно изучен. Обобщая данные литературы, можно выделить несколько основных этиологических факторов постинсультных психических нарушений: психогенная реакция на нарушение неврологических функций; психосоциальный фактор (одиночество, развод, потеря работы, социальная изоляция и другие немедицинские факторы); индивидуальные особенности личности и наследственная предрасположенность; поражение определенных отделов мозга, связанных с регуляцией эмоций и психической деятельности
© Коллектив авторов, 2010 |
3e-mail: klushnik2004@mail.ru |
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:7:35 |
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
35 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
человека; нарушения функционирования моноаминергических систем.
Ранее основное место при рассмотрении причин постинсультной депрессии занимало представление о психогенной реакции на возникшую инвалидизацию [20]. Однако дальнейшие исследования показали, что риск развития депрессии у пациентов с инсультом в 4—5 раз выше, чем у больных с ортопедической патологией, причем с идентичной, а иногда и большей степенью физической дезадаптации [32].
Дискуссия о влиянии локализации очага церебрального инсульта на развитие депрессии продолжается на протяжении всего периода изучения данного страдания. Значительное количество исследований не обнаружило достоверных различий частоты депрессии у больных с инсультами в правом и левом полушариях мозга [9, 45]. Не менее обоснована и противоположная точка зрения. Исследования предполагают существование нейроанатомических и патофизиологических предпосылок развития депрессии, включающих размер, локализацию очага поражения, а также развитие нейрохимических изменений в постинсультном периоде [34, 35].
Внастоящее время не вызывает сомнений важная роль, которую играют в патогенезе многих психопатологических состояний функциональные нарушения некоторых нейротрансмиттеров и нейромодуляторов. Начало пристального изучения этой проблемы можно отнести к концу 1950-х — началу 1960-х годов. Первоначально, основываясь на опыте применения антидепрессантов первого поколения, ряд авторов [15, 37] предлагали концепцию дефицита норадреналина или серотонина в серотонинергических синапсах ЦНС как одну из причин развития депрессивных состояний. С тех пор накоплен большой клинико-экспериментальный материал, подчеркивающий сложность и неоднозначность проблемы расстройства моноаминовой нейротрансмиссии при аффективных нарушениях [25, 26, 29, 34, 35].
Воснове патогенеза развития как тревоги, так и депрессии лежит дисфункция нейротрансмиттерных систем
вЦНС; из них важнейшее значение придается серотониновой [10]. В настоящее время известно, что серотониновые нейроны составляют лишь 2—3% от всех нейронов головного мозга. Однако роль этой популяции нейронов очень велика, так как считается, что они выполняют тоническую функцию, влияя на все нейротрансмиттерные системы головного мозга.
Серотонинергические нейроны сгруппированы в девяти ядрах ствола головного мозга. Известно по крайней мере пять проводящих путей от этих ядер, реализующих разнообразные регулирующие влияния серотонина. Аффективные процессы регулируются аркообразновосходящими терминалями, которые заканчиваются в различных мозговых структурах: в лимбико-ретикулярном комплексе, подкорковых ядрах и преимущественно в лобной коре больших полушарий головного мозга [27].
Для оценки активности серотониновой системы при психических расстройствах общепринятым является использование тромбоцитов в качестве доступной модели серотониновой системы ЦНС. Это обусловлено тем, что у тромбоцитов и серотонинергических нейронов идентичны рецепторы, система везикуляции и захвата серотонина, а также система генетического кодирования серотонинового транспортера [16, 31]. По данным литературы [15,
28, 43], снижение способности захвата серотонина тромбоцитами является маркером депрессии. Однако эти исследования проводились в основном при эндогенных формах депрессии, а постинсультные аффективные расстройства остаются малоизученными.
Целью данного исследования явилось изучение патогенетических механизмов развития тревожнодепрессивных расстройств у больных с церебральным инсультом.
Материал и методы
Работа проводилась на базе нейрореанимационного и неврологического отделений московской городской клинической больницы №31. В исследование включены 50 пациентов: 23 (45%) женщины, 27 (55%) мужчин, средний возраст — 65,4±11,3 года. Это были пациенты с впервые возникшим церебральным ишемическим инсультом различной локализации, включая больных с афатическими расстройствами, поступивших в стационар в 1-е сутки от развития заболевания. Критериями исключения явились сопутствующие соматические (в том числе онкологические) заболевания в стадии декомпенсации, алкоголизм.
Для объективизации тяжести состояния больного, выраженности очагового неврологического дефицита, регистрации динамики состояния пациента использовали шкалу инсульта Национального института здоровья NIH (National Institutes of Health) и шкалу Оргогозо на 1, 7, 14, 28-е сутки и 3, 6 и 12-й месяцы от момента развития заболевания. Способность к самообслуживанию, повседневную активность и выраженность нарушений жизнедеятельности оценивали с использованием индекса Бартел и шкалы Рэнкина в те же сроки.
Обследование и оценку психического состояния больных проводили с использованием клинического и клинико-катамнестического методов. Нозологическую диагностику депрессии и тревожных расстройств проводили в соответствии с критериями DSM-IV. Для стандартизированной оценки психического статуса использовали шкалы Гамильтона (HAM-A, HAM-D), госпитальную шкалу тревоги и депрессии, шкалу для оценки депрессии у больных с афазией, краткую шкалу оценки психического статуса (MMSE) на 1, 7, 14, 28-е сутки, 3, 6 и 12-й месяцы от начала развития инсульта.
Кроме того, всем пациентам проводилось биохимическое исследование крови на 1-е и 28-е сутки заболевания. Определяли содержание тромбоцитарного серотонина (ТС, спектрофлюорометрическим методом, как описано P. Frattini и соавт. [19]) и активность α1-протеиназного ингибитора (α1-ПИ, как описано I. Shcherbakova и соавт. [36]). Для определения нормативных значений тромбоцитарного серотонина была набрана группа здоровых доноров (23 человека), сопоставимых по полу и возрасту.
Для уточнения локализации, размера и характера поражения головного мозга всем больным проводили КТ и/ или МРТ (0,5 Тл) головного мозга. Патогенетический вариант инсульта уточняли при помощи дуплексного сканирования магистральных артерий головы, при необходимости — эхокардиографии, данных клинических и биохимических анализов, исследования свертываемости и реологии крови.
Электроэнцефалографию (ЭЭГ) проводили на 1, 7, 28-е сутки и 3, 6 и 12-й месяцы от начала развития заболе-
36 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |

ПОСТИНСУЛЬТНЫЕ АФФЕКТИВНЫЕ РАССТРОЙСТВА
вания по стандартной методике с помощью 19-канально- го энцефалографа.
Статистический анализ материала проводили с использованием пакета статистических программ Statistiсa 6.0.
Результаты и обсуждение
Аффективные нарушения были выявлены у большинства — 44 (88%) обследованных больных общей группы. ПД наблюдались у 10 (20%) больных, ГТР — у 13 (26%), сочетание ПД и ГТР — у 12 (24%). Кроме того, 9 (18%) пациентов составили группу больных с псевдопостинсультной депрессией, у которых детальный сбор анамнестических сведений позволил выделить депрессивные состояния, имевшие начало в период, предшествующий инсульту. У 6 (12%) пациентов психических нарушений выявлено не было, и они составили группу сравнения.
Анализ времени возникновения аффективных расстройств показал, что депрессии в основном возникали в остром (48% случаев) и раннем восстановительном (41%) периодах инсульта и лишь у 11% больных отмечались в позднем восстановительном периоде; ГТР в 2,5 раза чаще наблюдалось в остром периоде инсульта по сравнению с ранним восстановительным и наиболее редко (2% случаев) возникало спустя 12 мес от начала заболевания.
При определении уровня ТС было выявлено, что в 1-е сутки у всех больных с инсультом концентрация серотонина в тромбоцитах не отличалась от здоровых доноров. К 28-м суткам его концентрация повышалась статистически значимо (р=0,02).
Была получена прямая корреляция между приростом уровня ТС от 1-х к 28-м суткам инсульта и размером очага поражения головного мозга: чем больше очаг поражения, тем выше прирост ТС (r=0,54, р=0,004).
Согласно последним исследованиям, объяснить повышение ТС у тяжелых больных можно следующим образом: процессы перекисного окисления липидов, локального воспаления в очаге ишемии приводят к постепенному снижению неспецифического и приобретенного Т-клеточного иммунитета 1-го типа. При этом наблюдается значительное снижение генерации Т-лимфоцитами (CD4+T-helper 1 (TH1)) γ-интерферона [24, 42]. γ-Интерферон является физиологическим супрессором активности белка-переносчика серотонина в ЦНС и на тромбоцитах [18], и поэтому его снижение приводит к активации белка-переносчика серотонина, что в свою очередь ведет к повышению содержания серотонина в тромбоцитах.
Можно предположить, что наблюдаемое нами повышение уровня серотонина к 28-м суткам инсульта у больных со средними и большими размерами очага инфаркта мозга является следствием активного воспалительного процесса, сопровождающегося постепенным снижением Т-клеточного иммунитета (ТН1), ведущего к снижению продукции γ-интерферона, и как следствие к повышению содержания серотонина в тромбоцитах. Дополнительным свидетельством активного воспаления в этой группе больных явилось наблюдаемое нами значительное повышение относительно нормы уровня α1-ПИ (один из маркеров острой фазы воспаления) в 1—3-и сутки инсульта. Для всей группы больных с ишемическим инсультом была выявлена позитивная корреляция между размером очага ин-
фаркта и содержанием в сыворотке крови α1-ПИ на 1—3-и сутки инсульта (r=0,40; p=0,023).
Убольных с малыми очагами церебрального поражения не наблюдалось достоверных изменений в содержании ТС между 1—3-ми и 28-ми сутками инсульта. В этой группе также не наблюдалось достоверного повышения
уровня α1-ПИ в 1—3-и сутки инсульта, что свидетельствует об отсутствии заметного воспалительного процесса в очаге инфаркта.
Также была выявлена достоверная взаимосвязь между тяжестью состояния больных в 1-е сутки заболевания и содержанием ТС в этот период. У больных с низким содержанием ТС (достоверно ниже нормы) отмечалось более тяжелое состояние, чем у больных с достоверно повышенными относительно нормы значениями ТС (t=–2,07; р=0,04).
Полученные результаты согласуются с исследованиями, показавшими, что у больных в острейшем периоде ишемического инсульта в ответ на гипоксию и некроз клеток головного мозга наблюдается резкая активация секреции провоспалительных интерлейкинов, комплемента, фактора некроза опухолей-α (ФНО-α), что ведет к активации ферментов метаболизма триптофана (индоламин-2,3- диоксигеназы (IDO) в микроглии и триптофан-2,3- диоксигеназы (TDO) в астроглии мозга) и как следствие к запуску альтернативного пути метаболизма триптофана до кинуреновой кислоты [24, 31]. Кинуреновая кислота по своему действию является антагонистом серотонина.
Этот альтернативный путь, в норме не имеющий важного значения в метаболизме триптофана, становится определяющим у больных с ишемическим инсультом [21]. При этом резко снижается скорость превращения триптофана в серотонин. Его концентрация в мозге (и тромбоцитах) снижается в зависимости от тяжести состояния больных.
При ишемическом инсульте активация синтеза в ЦНС ряда соединений, имеющих выраженное психотропное действие (кинуреновой кислоты, кинуренина, хинолиновой и пиколиновой кислот), а также снижение содержания серотонина и мелатонина являются биохимическим основанием для формирования различных постинсультных психических расстройств (депрессия, тревожные расстройства, различные фобические состояния, когнитивные нарушения).
Убольных с аффективными расстройствами отмечались колебания уровня серотонина в отличие от больных без аффективных нарушений и с псевдопостинсультной депрессией. Мы провели анализ динамики концентрации ТС у больных с развитием аффективных нарушений в остром периоде инсульта и отсроченно (табл. 1). При исследовании уровня ТС у больных с аффективными нарушениями, развившимися в остром периоде инсульта, была выявлена взаимосвязь с локализацией очага поражения головного мозга. Так, у больных с депрессивными расстройствами отмечалось достоверное снижение ТС относительно нормы (р<0,05), с дальнейшим выраженным (в 2—3 раза) его повышением при локализации очага в левом полушарии головного мозга и структурах вертебробазилярной системы, что статистически отличалось от больных без аффективных расстройств и больных с псевдопостинсультной депрессией (р=0,03) (рис. 1). У больных с тревожными и тревожно-депрессивными расстройствами также отмечалось достоверное снижение ТС с последую-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
37 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
Таблица 1. Средний уровень тромбоцитарного серотонина (в нмоль/109 тромбоцитов) у больных с аффективными нарушениями и без таковых при различной локализации очага поражения
|
Локализация |
|
Период инсульта |
|
|
Психическое состояние |
|
1-е сутки |
|
28-е сутки |
|
очага поражения |
|
|
|||
|
ОП |
РВП+ПВП |
ОП |
РВП+ПВП |
|
|
|
||||
Депрессивные расстройства |
ЛСМА |
5 |
3,4 |
13,1 |
9,8 |
|
ПСМА |
6,7 |
3,5 |
11,2 |
7,1 |
|
ВБС |
4,5 |
5,1 |
9,6 |
7,2 |
Тревожные расстройства |
ЛСМА |
5 |
6,7 |
7,2 |
9,8 |
|
ПСМА |
8,6 |
3,8 |
11,6 |
7,2 |
|
ВБС |
4,2 |
5,2 |
10,3 |
10,1 |
Тревожно-депрессивные рас- |
ЛСМА |
5,7 |
5,4 |
8,1 |
8 |
стройства |
ПСМА |
7 |
5,4 |
10,6 |
7 |
|
ВБС |
3,7 |
6,5 |
10,3 |
10 |
Без аффективных нарушений |
ЛСМА |
6,2 |
|
6,8 |
|
|
ПСМА |
6,3 |
|
5,7 |
|
|
ВБС |
6 |
|
6,2 |
|
ППИД |
ЛСМА |
6 |
|
7,2 |
|
|
ПСМА |
6,1 |
|
7,5 |
|
|
ВБС |
5,8 |
|
7,4 |
|
Примечание. ОП — острый период инсульта; РВП — ранний восстановительный период инсульта; ПВП — поздний восстановительный период инсульта; ППИД — псевдопостинсультная депрессия; ЛСМА — бассейн левой средней мозговой артерии; ПСМА — бассейн правой средней мозговой артерии; ВБС — вертебральнобазилярная система.
Таблица 2. Взаимосвязь между концентрацией тромбоцитарного серотонина в 1—3-и сутки инсульта и отсроченным развитием аффективных расстройств
Длительность депрессии |
Уровни ТС, нмоль/109 |
тромбоцитов |
|
группа с депрессией (M±σ) |
группа без депресии (M±σ) |
||
|
|||
3 мес |
4,438±2,42* |
9,194±4,54* |
|
6 мес |
4,215±2,85* |
8,642±4,35* |
|
12 мес |
6,588±3,67 |
8,305±4,01 |
|
ППИД |
5,92±1,96 |
6,72±4,45 |
Примечание. * — p<0,05 — различия в уровнях ТС между группами достоверны; ППИД — псевдопостинсультная депрессия.
щим его повышением при локализации очага в вертебробазилярной системе (р=0,04) (см. рис. 1).
Кроме того, было обнаружено, что низким значениям ТС в 1-е сутки инсульта соответствует достоверно более выраженная депрессия на 7-е сутки заболевания (p<0,05)
— 12,2 и 3,7 балла по шкале Гамильтона соответственно. Таким образом, развитие аффективных расстройств в
остром периоде инсульта, вероятно, обусловлено поражением определенных областей мозга, связанных с серотониновой трансмиссией. Наши результаты согласуются с некоторыми данными литературы [33, 40] о преимущественном развитии постинсультной депрессии при поражении левой лобной доли и базальных ганглиев.
Кроме того, у больных с аффективными нарушениями, развившимися в остром периоде инсульта, по сравнению с группой больных без психических расстройств отмечается выраженный прирост уровня ТС к 28-м суткам инсульта. При изучении взаимосвязи прироста уровня тромбоцитарного серотонина с тяжестью депрессивных расстройств была выявлена прямая корреляция между его повышением и степенью тяжести депрессии (r=0,6; p=0,045).
У больных с тревожными расстройствами была выявлена прямая корреляция между высоким уровнем тромбоцитарного серотонина на 28-е сутки инсульта и степенью
тяжести ГТР (r=0,86; р=0,01). По данным некоторых авторов [10], у части больных с эндогенными тревожными расстройствами отмечается гиперфункция серотониновой системы.
При анализе группы больных с развитием аффективных нарушений в раннем и позднем восстановительных периодах связи с локализацией очага поражения обнаружено не было. Однако отмечалась достоверная взаимосвязь между исходно низким уровнем ТС (значительно ниже нормы) и отсроченным развитием депрессивных расстройств (t=–2,97; р<0,05) (табл. 2).
При сопоставлении ТС в 1-е сутки инсульта и степени тяжести депрессии была обнаружена обратная корреляция между уровнем серотонина и тяжестью депрессивных расстройств, развившихся в раннем и позднем восстановительных периодах инсульта (р=0,045). Низкий уровень ТС был связан с большей тяжестью развившейся в дальнейшем депрессии, что, вероятно, свидетельствует о гипофункции или слабости серотониновой системы у этих пациентов.
Таким образом, низкий уровень ТС (значительно ниже нормы) в 1-е сутки заболевания может служить фактором риска развития депрессии в последующие периоды инсульта.
Поскольку известна гипотеза о существовании ЭЭГмаркеров состояния нейромедиаторных систем [1, 2, 12],
38 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
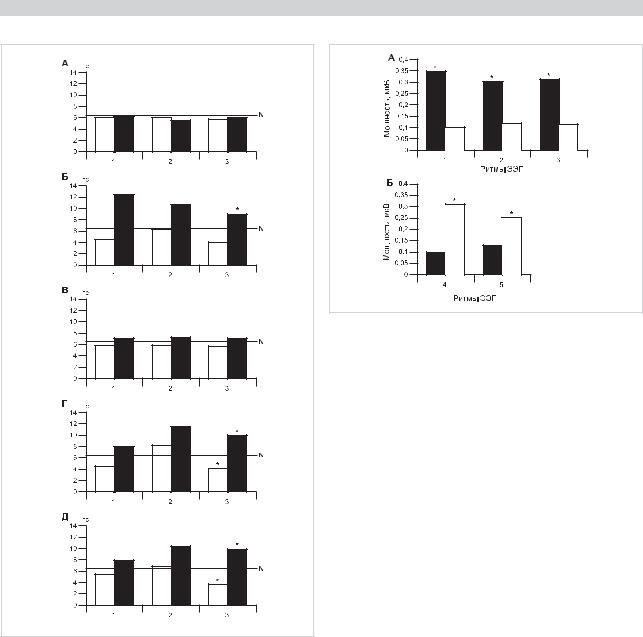
ПОСТИНСУЛЬТНЫЕ АФФЕКТИВНЫЕ РАССТРОЙСТВА
Рис. 1. Уровень тромбоцитарного серотонина у больных с аффективными нарушениями, развивающимися в остром периоде инсульта, при различной локализации очага поражения головного мозга.
А — группа сравнения; Б — больные с депрессией; В — больные с псевдопостинсультной депрессией; Г — больные с тревогой; Д — больные с тревожно-депрессивными расстройствами.
Локализация очага поражения: 1 — бассейн левой средней мозговой артерии; 2 — бассейн правой средней мозговой артерии; 3 — вертебробазилярная система.
Время проведения исследования: светлые столбцы — 1-е сутки инсульта; темные — 28-е сутки инсульта.
* — р<0,05.
интересным представляется изучение связи биохимических показателей с функциональным состоянием головного мозга.
При анализе показателей ЭЭГ было установлено, что в группе с аффективными расстройствами при низких значениях ТС на 1-е сутки в картине ЭЭГ отмечалась более выраженная межполушарная асимметрия в α- и θ-диапазоне частот по сравнению с группой больных с высоким или средним уровнем ТС.
Рис. 2. Динамика параметров ЭЭГ у пациентов с низким и высоким уровнем тромбоцитарного серотонина.
А — 1—3-и сутки от начала инсульта. Б — 6 мес от начала инсульта. Коэффициент межполушарной асимметрии (МПА): 1 — коэффициент МПА α1-активности; 2 — коэффициент МПА α2-активности; 3 — коэффициент МПА θ-активности; 4 — индекс мощности α1-активности; 5 — индекс мощности α2-активности.
Уровень тромбоцитарного серотонина: темные столбцы — низкий; светлые — высокий.
* — р<0,05.
Через 6 мес от начала инсульта в группе с низким ТС происходило снижение индекса и мощности α1- и α2- ритмов ЭЭГ (р<0,05) и отмечалось нарушение зонального распределения α-ритма (рис. 2).
Известно, что психофизиологические процессы находятся в прямой зависимости от степени среднечастотного α-ритма [3, 38]. В литературе имеются данные о снижении и значимом нарушении зонального градиента α-ритма при эндогенных тревожно-депрессивных расстройствах [30, 41].
Таким образом, у больных с низким уровнем ТС уже в острейшем периоде инсульта выявляются изменения преимущественно в α-диапазоне ЭЭГ, значимо нарастающие в восстановительном периоде, что соответствует клиническим данным о большей тяжести у них развившейся в дальнейшем депрессии.
Заключение
Проведенное исследование показало значимость изменения уровня ТС в развитии аффективных расстройств у больных с церебральным инсультом. Полученные данные указывают на единый патофизиологический механизм возникновения аффективных нарушений в остром периоде инсульта, по-видимому, связанный с дисфункцией определенных структур мозга и сопутствующими нейрохимическими изменениями, прежде всего нарушением серотониновой трансмиссии. Отсроченное развитие аффективных нарушений может быть связано с исходно низким уровнем ТС у больных с инсультом, независимо от его локализации, что, вероятно, свидетельствует о гипофункции или слабости серотониновой системы у этих пациентов.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
39 |
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ |
|
Дальнейшие исследования различных аспектов про- |
новые возможности более дифференцированной помощи |
блемы постинсультных психических нарушений откроют |
пациентам, перенесшим церебральный инсульт. |
ЛИТЕРАТУРА
1.Ашмарин И.П. Биохимия мозга. М 1999.
2.Бочкарев В.К., Панюшкина С.В. Электроэнцефалографические исследования при пограничных состояниях. Пограничные психические расстройства. Под ред. Ю.А. Александровского. М 2000; 120—133.
3.Изнак А.Ф., Чаянов Н.В. Модуляция сенсомоторной деятельности человека на фоне α-ритма. Проблемы развития научных исследований в области психического здоровья, 1989; 3—24.
4.Концевой В.А., Скворцова В.И., Савина М.А. и др. Депрессия и коморбидные им расстройства в остром периоде инсульта. Вертеброневрология 2004; 11: 3—4: 19—20.
5.Концевой В.А., Скворцова В.И., Петрова Е.А., Савина М.А. О нозологической гетерогенности постинсультной депрессии. Качество жизни. M: Медицина 2006; 2: 13: 58—61.
6.Концевой В.А., Скворцова В.И., Петрова Е.А., Савина М.А. Депрессия и парадепрессивные расстройства: эпидемиология, патогенез и факторы риска. Журн неврол и психиат 2009; 109: 8: 4—10.
24.Klehnet J., Harms H., Richter M. et al. Stroke-induced immunodepression and post-stroke infections: Lessons from the preventive antibacterial therapy in stroke trial. Neuroscience 2009; 158: 3: 1184—1193.
25.Maes M., Meltzer H. The serotonin hypothesis of major depression. In: Psychopharmacology. F. Bloom, D. Kupfer (eds.). New York: Raven Press 1995; 933—944.
26.Maletic V., Robinson M., Oakes T. et al. Neurobiology of depression: an integrated view of key findings. J Int J Clin Pract 2007; 61: 2030—2040.
27.Mega M.S., Cummings J.L., Salloway S. et al. The limbic system: anatomic, phylogenetic, and clinical perspective. J Neuropsychiat Clin Neurosci 1997; 9: 315—330.
28.Mehlman P.T., Higley J.D., Faucher I. et al. Low CSF 5-HIAA concentrations and severe aggression and impaired impulse control in nonhuman primates. Am J Psychiat 1994; 151: 10: 1485—1491.
29.Nestler E.J., Barrot M., DiLeone R.J. et al. Neurobiology of depression. Neuron 2002; 34: 13—25.
7.Петрова Е.А., Концевой В.А., Савина М.А. и др. Депрессивные рас30. Рassynkova N.R., Volf N.V. Seasonal affective disorder: spatial organization
стройства у больных с церебральным инсультом. Журн неврол и психиат 2009; 109: 2: 4—9.
8.Скворцова В.И., Концевой В.А., Петрова Е.А., Савина М.А. Депрессия
ипарадепрессивные расстройства при церебральном инсульте: вопросы клинической оценки, диагностики и коррекции. Журн неврол
ипсихиат 2009; 109: 9: 4—11.
9.Berg A., Palomaki H., Lehtihalmes M. et al. Poststroke Depression. An 18-Month Follow-Up. Stroke 2003; 34: 1: 138—143.
10.Boyer E.W., Shannon M. The serotonin syndrome. N Engl J Med 2005; 352: 11: 1112—1120. Erratum in: N Engl J Med 2005; 356: 23: 2437.
11.Burvill P.W., Johnson G.A., Jamozik K.D., Anderson C.S. Anxiety disorders after stroke: results from the Perth Community Stroke Study. Br J Psychiat 1995; 166: 328—332.
12.Camus V., Kraehenbuhl H., Preisig M. et al. Geriatric depression and vascular diseases: what are the links? J Affect Disord 2004; 81: 1: 1—16.
13.Castillo C.S., Schultz S.K., Robinson R.G. Clinical correlates of early-onset
and late-onset poststroke |
generalized anxiety. Am J Psychiat 1995; |
152: 1174—1179.
14.Chemerinski E., Robinson R.G., Arndt S., Kosier J.T. The effect of remission of poststroke depression on activities of daily living in a double-blind randomized treatment study. J Nerv Ment Dis 2001; 189: 7: 421—425.
15.Coppen A. The biochemistry of affective disorders. Br J Psychiat 1967; 113: 1237—1264.
16.Dmitriev A.D., Factor M.I., Segal O.L. et al. Western blot analysis of human and rat serotonin transporter in platelets and brain using site-specific antibodies: evidence that transporter undergoes endoproteolytic cleavage. Clin Chim Acta 2005; 356: 76—94.
17.Emerski E., Robinson R. The Neuropsychiatry of Stroke. Psychosomatics 2000; 41: 5—14.
of EEG power and coherence in the depressive state and in light-induced and summer remission. Psychiat Rec 2001; 108: 3: 169—185.
31.Pletscher A. Platelets as peripheral models for neuropsychiatry. Biol Psychiat 1991; 2: 354—356.
32.Robinson R.G., Starr L.B., Kubos K.L., Price T.R. A two-year longitudinal study of post-stroke mood disorders: findings during the initial evaluation. Stroke 1983;14: 736—41.
33.Robinson R.G., Starkstein S.E. Current research in affective disorders following stroke. J Neuropsychiat Clin Neurosci 1990; 2: 1—14.
34.Robinson R.G., Starr L.B., Lipsey J.R. et al. A two-year longitudinal study of poststroke mood disorders. In-hospital prognostic factors associated with six-month outcome. J Nerv Mental Dis 1995; 173: 221—226.
35.Robinson R.G. Poststroke depression: prevalence, diagnosis, treatment, and disease progression. Biol Psychiat 2003; 54: 3: 376—387.
36.Shcherbakova I., Neshkova E., Dotsenko V. et al. The possible role of plasma kallikrein-kinin system and leukocyte elastase in pathogenesis of schizophrenia. Immunopharmacology 1999; 43: 273—279.
37.Schildkraut J.J. The catecholamine hypothesis of affective disorders: A review of supporting evidence. J Neuropsychiat Clin Neurosci 1965; 7: 524— 533.
38.Seki T., Awata S., Koizumi Y. et al. Association between depressive symptoms and cerebrovascular lesions on MRI in community-dwelling elderly individuals. Nippon Ronen Igakkai Zasshi 2006; 43: 1: 102—107.
39.Sturm J.W., Donnan G.A., Dewey H.M. et al. Quality of Life after Stroke: the North East Melbourne Stroke Incidence Study (NEMESIS). Stroke 2004; 35: 2340—2345.
40.Terroni L. de M., Leite C.C., Tinone G., Fráguas Jr.R. Poststroke depression: risk factors and antidepressant treatment. Rev Assoc Med Bras 2003; 49: 4: 450—459.
18.Foley K.F., Pantano C., Ciolino A. et al. INF-gamma and TNF-alpha de41. Yamada M., Kimura M., Mori T., Endo S. EEG power and coherence in
crease serotonin transporter function and expression in Caco2 cells. Am J Physiol Gastrointest Physiol 2007; 292: G779—G784.
19.Frattini P., Cucchi M.L., Santagostino G. et al. A sensitive fluorimetric method for determination of platelet-bound and plasma free serotonin. Clin Chim Acta 1979; 92: 353—360.
presenile and senile depression. Characteristic findings related to differences between anxiety type and retardation type. Nippon Ika Daigaku Zasshi 1995; 62: 2: 176—185.
42.Yilmaz G., Arumugam T.V., Stokes K.Y. et al. Role of T lymphocytes and in- terferon-gamma in ischemic stroke. Circulation 2006; 113: 2105—2112.
20.Gainotti G., Azzoni A., Marra C. Frequency, phenomenology and anatomi43. Van Praag H.M. Neurotransmitters and CNS disease. Depression. Lancet
cal-clinical correlates of major post-stroke depression. Br J Psychiat 1999;
175: 163—167.
21.Grohmann U., Fallarino F., Bianchi R. et al. Tryptophan catabolism in nonobese diabetic mice. Adv Exp Med Biol 2003; 527: 47—54.
1982; 2: 1259—1269.
44.Verdelho A., Hénon H., Lebert F. et al. Depressive symptoms after stroke and relationship with dementia. A three-year follow-up study. Neurology 2004; 62: 905—911.
22.Hermann W.M. Advances in Pharmaco-EEG. Eds F. Krijzer, W.M. Herr45. Wade D.T., Legh-Smith J., Hewer R.A. Depressed mood after stroke. Br J
mann. 1998; 85—106. |
Psychiat 1987; 151: 200—205. |
23.House A., Knapp P., Bamford J., Vail A. Mortality at 12 and 24 months after stroke may be associated with depressive symptoms at 1 month. Stroke 2001; 32: 696—701.
40 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
