
Журнал неврологии и психиатрии / 2010 / NEV_2010_07_024
.pdf
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Влияние сульфата амантадина на когнитивные нарушения у пациентов с болезнью Паркинсона
Асп. А.Ю. ЯБЛОНСКАЯ1, д.м.н., проф. Н.В. ФЕДОРОВА1,2, асп. М.Э. БЕЛЬГУШЕВА1
The effect of amantadine sulfate on cognitive disorders in patients with Parkinson’s disease
A.YU. YABLONSKAYA, N.V. FEDOROVA, M.E. BELGUSHEVA
1Кафедра неврологии Российской медицинской академии последипломного образования; 2Центр экстрапирамидных заболеваний,
Москва
Когнитивные нарушения при болезни Паркинсона (БП) приводят к профессиональной, социально-бытовой и психологической дезадаптации больных и их родственников. В статье представлены эпидемиология, структура, характер когнитивных нарушений при БП, рассмотрены основные патогенетические факторы развития умеренных когнитивных расстройств и деменции при БП, методы диагностики и оценки когнитивных нарушений, а также подходы к коррекции нарушений памяти и интеллекта. Представлены результаты собственного исследования влияния терапии сульфатом амантадина, назначенным в дозе 300 мг на протяжении 6 мес, на динамику когнитивных нарушений у 25 больных БП. Результаты терапии оценивались с помощью нейропсихологических вопросников и шкал (краткая шкала оценки психического статуса, батарея тестов для оценки лобной дисфункции, шкала деменции Матисса). У больных БП с умеренными когнитивными нарушениями на фоне 6-месячного приема сульфата амантадина отмечалось достоверное улучшение показателей нейропсихологического тестирования.
Ключевые слова: болезнь Паркинсона, когнитивные нарушения, лечение, сульфат амантадина.
Cognitive disorders in Parkinson’s disease (PD) lead to occupational, social, everyday and psychological maladaptation in patients and their relatives. The paper addresses the epidemiology, structure and character of cognitive disorders in PD. The main pathogenetic factors of the development of moderate cognitive disorders and dementia in PD, methods of diagnosis and assessment of cognitive disorders and approaches to treatment of memory and intellect impairment are considered. We present the results of our own study on the effect of amantadine sulfate, prescribed in the dosage of 300 mg during 6 months, on cognitive disorders in 25 PD patients. Results of the therapy were assessed using neuropsychological tests and scales (MMSE, the Frontal Assessment battery, the Mattis dementia rating scale). The significant improvement in neuropsychological performance was seen in patients with moderate cognitive disorders treated with amantadine sulfate during 6 months.
Key words: Parkinson’s disease, cognitive disorders, treatment, amantadine sulfate.
Когнитивные расстройства, т.е. нарушения высших корковых функций, связанных с процессами получения, переработки и анализа информации, в структуре болезни Паркинсона (БП) занимают большое место, уступая по распространенности лишь двигательным и вегетативным расстройствам. При расширенном нейропсихологическом тестировании когнитивные нарушения при этом заболевании выявляются в 90—95% случаев [4, 5, 16]. На поздних стадиях заболевания у 24—31% больных БП тяжесть когнитивных нарушений достигает уровня деменции, тогда как в сходной возрастной группе общей популяции доля лиц с деменцией почти в 10 раз ниже (3—4%). По данным некоторых исследователей [36], у пациентов с дебютом БП до 70 лет деменция развивается в 17% случаев, тогда как при развитии заболевания после 70 лет — в 83% случаев.
Снижение когнитивной функции приводит к возникновению профессиональной, социально-бытовой и психологической дезадаптации больных. Деменция повышает смертность пациентов с БП, ухудшает качество жизни не только самих больных, но и их родственников. Свое-
временная диагностика и лечение когнитивных нарушений у пациентов с БП снижает процент инвалидизации и уменьшает финансовые затраты по уходу, улучшает прогноз.
На начальных стадиях БП чаще встречаются когнитивные нарушения, связанные с замедлением психических процессов (брадифрения), снижением внимания, ограничением способности к запоминанию; мышление и интеллект больных остаются относительно сохранными, однако способность к решению сложных задач может снижаться из-за ограничения ресурсов внимания. Указанные нарушения не приводят к нарушению социальной адаптации больных, но могут неблагоприятно влиять на их качество жизни. Познавательные расстройства преимущественно нейродинамического характера, характеризующиеся снижением внимания и скорости психомоторных реакций, определяются как легкие когнитивные нарушения (ЛКН) [14, 26]. По мере прогрессирования БП когнитивный дефицит может нарастать, чему способствует достижение более пожилого возраста пациентами и наличие сопутствующей патологии (артериальная гипертония,
© Коллектив авторов, 2010 |
1Тел.: 8 (495) 728-8363 |
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:7:24
24 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |

гиперхолестеринемия, сахарный диабет). Интересные данные получены рядом авторов [13, 37] при динамическом наблюдении в течение 5 лет за пациентами с БП с ЛКН: у 45,4% из них ЛКН трансформировались в умеренные когнитивные расстройства (УКР), тогда как у 3% пациентов диагностировалась деменция.
УКР проявляются более грубым снижением памяти, внимания, мышления и ориентации, но не приводят к утрате независимости и самостоятельности в повседневной жизни [7, 9, 40, 41]. На ранних стадиях БП УКР диагностируются в 20,5% случаев, тогда как на более поздних стадиях БП — в 42,3% случаев [33]. Критериями УКР по МКБ-10 [10] являются: жалобы на когнитивные проблемы со стороны родственников или самого пациента; указания на тенденцию к снижению когнитивных функций по отношению к предшествующему уровню; выявляемое при клиническом и нейропсихологическом исследовании нарушение когнитивных функций (в одной или нескольких когнитивных сферах); отсутствие влияния когнитивных нарушений на повседневную активность.
На основании нейропсихологического профиля УКР подразделяют на 2 типа [8, 38, 40]: амнестический тип с дефектом эпизодической памяти, связанный с нарушением запоминания (выявляется в тестах на опосредованное запоминание и узнавание); дизрегуляторный тип с преобладанием регуляторных нарушений, связанных с первичной или вторичной дисфункцией лобных долей.
По мере прогрессирования заболевания нейропсихологические нарушения имеют тенденцию к нарастанию; появляются регуляторные и операционные расстройства, которые постепенно приводят к развитию деменции. На ранних стадиях заболевания БП деменция диагностируется лишь у 4,5% пациентов, тогда как на более поздних — у 20—40% пациентов с БП [27]. Трансформации УКР в деменцию способствуют более пожилой возраст пациентов, мужской пол, грубый двигательный дефицит и нарушение регуляторных, зрительно-пространственных функций по данным нейропсихологического тестирования [30].
Ранними признаками деменции являются снижение инициативы, социальной, физической и интеллектуальной активности, усиление зависимости от окружающих, повышение сонливости, угнетенное настроение, повышение тревожности, тенденция к самоизоляции, сужение круга общения.
Деменция при БП определяется в том случае, если оценка по краткой шкале психического статуса MMSE (Mini-Mental State Examination) составляет менее 25 баллов, а когнитивные нарушения затрагивают несколько познавательных функций (память, внимание, зрительнопространственные и исполнительные функции), и выражены настолько, что затрудняют повседневную активность пациента [23].
По данным нейропсихологического профиля выделяют 3 типа деменции [8, 19, 24]: деменция 1-го типа характеризуется преимущественно подкорково-лобным когнитивным дефицитом, развивается более медленно, часто проявляется спустя 10 лет и более от появления первых симптомов паркинсонизма; деменция 2-го типа характеризуется комбинированным подкорково-корковым когнитивным дефицитом, включающим более выраженные зрительно-пространственные, речевые и мнестические нарушения, раннее развитие депрессии, психотических и поведенческих нарушений, нарушений сна, флюктуаций
психического статуса. Этот вид деменции развивается более быстро, чем деменция 1-го типа, и клинически сходен с деменцией с тельцами Леви, но проявляется позднее чем через год после появления симптомов паркинсонизма; деменция 3-го типа проявляется когнитивным дефицитом, сходным с болезнью Альцгеймера с низким уровнем семантической речевой активности, ранним нарушением узнавания и опосредованного запоминания, более частыми психотическими нарушениями по сравнению с деменцией 2-го типа.
Выделяют [20] 3 степени тяжести деменции: легкую деменцию, при которой утрачивается трудоспособность и частично способность к выполнению более сложных, инструментальных действий, но при этом в быту больной может обслуживать себя сам и нуждается лишь в эпизодической помощи; деменцию средней степени тяжести, при которой больной нуждается, хотя и частично, в регулярной (ежедневной) помощи; деменция тяжелой степени, при которой больной не способен обслуживать себя самостоятельно и нуждается в постоянном уходе.
Многие исследователи акцентируют внимание на зависимость темпа прогрессирования когнитивных нарушений у больных БП от ряда факторов: возраста, уровня образования, длительности заболевания, выраженности двигательных нарушений, характера проводимой терапии, наличия и выраженности психотических нарушений, наличия сосудистых факторов риска [27, 36].
Характеристика когнитивных нарушений при БП
Когнитивные нарушения при БП развиваются на фоне поражения подкорково-корковых систем и характеризуются зрительно-пространственными, регуляторными, мнестическими, речевыми и поведенческими нарушениями [2, 3, 12].
У пациентов отмечается замедленность мышления (брадифрения), что приводит к увеличению времени выполнения нейропсихологических тестов и снижению скорости реагирования на предъявляемый стимул. Отмечается снижение способности к запоминанию, извлечению информации, тогда как прочность хранения информации не страдает. Кроме того, мышление пациентов с БП характеризуется значительной инертностью: они склонны принимать то решение, которое было успешным в прошлом, стараются как можно реже менять стратегию своего поведения. Поэтому они недоверчивы ко всему новому
имогут быть не вполне критичными к себе и актуальной жизненной ситуации. В связи со снижением внимания нарушается инициация реакций, затрудняется выполнение многокомпонентных заданий. Нарушение регуляторной функции снижает скорость переключения, анализа и планирования действий. Дисфункция памяти характеризуется нарушением извлечения информации вследствие дефекта исполнительных функций.
Зрительно-пространственные нарушения выражаются ограничением способности копировать и воспроизводить по памяти рисунки и фигуры, определять дистанцию
инаправление линий в пространстве. В повседневной жизни зрительно-пространственные нарушения могут приводить к трудностям ориентации на местности.
Патогенез когнитивных нарушений при БП
Патогенез когнитивных нарушений при БП в большой мере определяется патоморфологическими измене-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
25 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
ниями в головном мозге и нарушениями функции нейромедиаторных систем.
Нейроморфологической особенностью БП является наличие нейродегенеративного процесса в коре головного мозга. Установлена зависимость между выраженностью когнитивных нарушений и такими проявлениями указанного процесса, как количество телец Леви. На поздних стадиях БП выявляются сенильные бляшки и нейрофибриллярные клубки в нейронах переднего мозга и гиппокампа, что характерно для деменции альцгеймеровского типа [21]. Субкортикальные нарушения характеризуются поражением холинергического базального ядра Мейнерта, а также дофаминергической вентральной покрышечной области [3].
Нейрохимические нарушения при БП связаны с дисбалансом дофамина, ацетилхолина, норадреналина, серотонина и других медиаторов. Ведущую патогенетическую роль в развитии когнитивных нарушений играет нарастание холинергической недостаточности при прогрессировании заболевания. Данный факт подтверждается снижением уровня ацетилхолинтрансферазы в больших полушариях головного мозга, гиппокампе и утратой холинергических нейронов в базальных ганглиях у пациентов с БП с деменцией. При использовании функциональной нейровизуализации установлена связь развития когнитивных нарушений и дефицита ацетилхолина в височных долях и участках архикортекса у пациентов с БП [17, 40].
Некоторые исследователи выявили диффузное снижение метаболизма в коре головного мозга у пациентов с БП уже на начальных стадиях заболевания [39]. Дефицит дофамина участвует в возникновении когнитивных нарушений в основном лобного типа и затрагивает преимущественно исполнительные функции у больных БП. Нарушение реципрокных связей между дофаминергической и ацетилхолинергической системами в структурах лимбического комплекса может приводить к возникновению галлюцинаций. Кроме того, причиной психотических нарушений может быть избыточное образование дофамина при неадекватной терапии препаратами леводопы и денервационная гиперчувствительность дофаминергических нейронов.
Дегенерация нейронов и снижение количества норадреналина в голубом пятне, в новой коре и гиппокампе объясняют нарушение внимания и кратковременной памяти, а также депрессию у пациентов с БП, усугубляющую выраженность когнитивного дефицита [6, 17].
В последнее время обсуждается вопрос о влиянии глутамата на когнитивные функции при БП. Дисбаланс в системе дофамин—глутамат приводит к преобладанию возбуждающего действия последнего на нейроны головного мозга. Глутамат активирует NMDA-рецепторы, регулирующие приток ионов кальция внутрь клетки. Массивный вход и повышение концентрации кальция в нигростриарных дофаминергических нейронах приводят к запуску окислительного стресса. Существуют экспериментальные данные, свидетельствующие об избирательной чувствительности нейронов черного вещества к окислительному стрессу, что может быть обусловлено двумя факторами: повышенным содержанием ионов железа, усиливающих окислительные процессы, и меньшим по сравнению с другими областями мозга уровнем глутатиона, который обладает антиоксидантной активностью. Другим немаловажным фактором прогрессирования нейродегенератив-
ных процессов в головном мозге является гиперчувствительность NMDA-рецепторов, за счет чего даже незначительная концентрация глутамата может вызвать гиперстимуляцию NMDA-рецепторов и привести к еще большему образованию свободных радикалов [44].
Таким образом, высокая чувствительность и глутаматергическая гиперстимуляция NMDA-рецепторов, а также цитотоксическая концентрация ионов кальция, запускающая каскад эксайтотоксичности, ускоряют дегенеративный процесс нейронов и приводят к нарушению работы сигнальных путей, участвующих в формировании памяти.
Методы оценки когнитивных нарушений при БП
Разработано большое количество методик оценки когнитивных нарушений при БП: рейтинговая шкала оценки деменции Маттиса [37], краткая шкала оценки психического статуса (MMSE) [23], тест рисования часов, тест пяти слов, батарея тестов для оценки лобной дисфункции [19], бостонский тест названия [31], тест ориентации линий [15], тест вербальных ассоциаций [34].
В исследованиях с использованием более подробных методик нейропсихологического обследования было установлено, что доля дементных пациентов среди больных БП значительно выше, чем в исследованиях с использованием скрининговых опросников [30].
Адекватная диагностика когнитивных нарушений и динамическое наблюдение обеспечивают более качественное лечение пациентов с БП.
Лечение когнитивных нарушений при БП
Оптимального результата в лечении когнитивных нарушений можно добиться при раннем их выявлении, определении их характера и степени тяжести, своевременном назначении патогенетической терапии. При выявлении когнитивных нарушений у пациентов с БП необходимо проводить коррекцию противопаркинсонической терапии (отмена холинолитиков, седативных препаратов). Препараты леводопы на ранних стадиях БП могут оказывать положительное влияние на ЛКН и УКН, восстанавливая дефицит дофамина.
Применение специфической терапии зависит от выраженности когнитивных нарушений. У больных с ЛКН положительный эффект может быть достигнут при использовании немедикаментозных методов коррекции (снижение стрессовой нагрузки, умеренная физическая активность, коррекция гипертонии, гиперлипидемии, гликемии). Для лечения ЛКН применяют препараты метаболического действия, однако их эффективность подтверждена лишь в единичных исследованиях [26]. Целью коррекции УКН является замедление и предотвращение прогрессирования когнитивного дефицита. Краткосрочное улучшение когнитивных функций у пациентов с УКН показали препараты с нейрометаболическим и нейротрофическим действием [32].
В отдельных исследованиях показано положительное влияние агонистов дофаминовых рецепторов (пирибедила) при лечении ЛКН и УКН [7]. Пирибедил обладает одновременно норадренергическим и дофаминергическим действием, влияя на основные патофизиологические механизмы возникновения когнитивных нарушений. Выявлено, что пирибедил улучшает мышление, кратковременную и долговременную память, повышает внимание, нор-
26 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |

мализует регуляторную функцию у больных БП, влияя на активность психических процессов и нейродинамические нарушения [11].
В ряде исследований [18, 42] были получены данные о положительном влиянии ингибиторов центральной ацетилхолинэстеразы на когнитивную сферу, повседневную активность, а также на поведенческие и психические расстройства у пациентов с БП с УКН и с деменцией.
Получены интересные данные о влиянии сульфата амантадина на степень выраженности деменции у пациентов с БП. Вероятно, его влияние на когнитивную сферу у пациентов с БП связано с его нейрохимическими свойствами. P. von Voigtlander и K. Moore [43] описали пресинаптический механизм действия препарата, основанный на увеличении высвобождения запасов дофамина и блокировании обратного захвата катехоламинов пресинаптическими терминалями. Несколькими годами позже G. Gianutsos [25] описал постсинаптические механизмы действия сульфата амантадина, основанные на непосредственном стимулировании дофаминовых рецепторов и изменении структуры дофаминовых рецепторов с повышением сродства к медиатору.
Влияние сульфата амантадина на когнитивные функции было показано в крупном двойном слепом контролируемом рандомизированном исследовании, проведенном R. Inzelberg и соавт. [29]. Диагноз БП устанавливался на основании стандартных критериев. В исследование вошли пациенты с БП, у которых деменция развивалась более чем через год от начала заболевания. Деменция диагностировалась на основании критериев руководства по диагностике и статистической оценки психических заболеваний. Общее число больных БП, участвовавших в этом исследовании, составило 593. Они были разделены на 2 группы: первая группа — 263 больных получали лечение сульфатом амантадина; вторая группа — 330 пациентов такого лечения не получали. Обе исследуемые группы были сопоставимы по полу, возрасту, продолжительности и степени тяжести заболевания. За время наблюдения в группе пациентов с БП, получающих сульфат амантадина, были выявлены 57 пациентов с деменцией. В группе пациентов с БП, которые не получали сульфат амантадина, у 59 больных была диагностирована деменция. Динамика нейропсихологического статуса у дементных пациентов с БП, получавших сульфат амантадина, была более благоприятной (показатели шкалы MMSE составили 21±5 баллов) по сравнению с пациентами с БП, которые не получали этот препарат (MMSE — 18±5 баллов). Интересные результаты были получены о влиянии сульфата амантадина на сроки возникновения деменции у пациентов с БП. Было выявлено, что длительность заболевания без деменции у пациентов с БП, получающих сульфат амантадина, составила 9,1±2,7 года, тогда как у пациентов с БП, не получавших его, деменция развилась в среднем уже через 5,9±2,6 года. Возможно, влияние терапии сульфатом амантадина на когнитивные функции у пациентов с БП связано со снижением патологического преобладания глутамата и опосредованного уменьшения концентрации ионов кальция в нигростриарных нейронах, а также с замедлением дегенеративного процесса в головном мозге.
Относительно недавно были получены данные о влиянии сульфата амантадина на функциональную активность головного мозга у пациентов с БП. В соответствующем исследовании [1] лечили 32 пациентов с акинетико-
ригидной и смешанной формами БП. После курсового применения сульфата амантадина было отмечено увеличение мощности спектра ЭЭГ в диапазоне α-, β- и θ-частот. Достоверные различия были получены в диапазоне β2-активности в височно-теменно-затылочных отведениях левого полушария. Согласно результатам когерентного анализа ЭЭГ, курсовое применение сульфата амантадина нормализует пространственную организацию биопотенциалов мозга за счет снижения патологически высоких показателей когерентности для большинства внутри- и межполушарных пар отведений в диапазоне указанных выше частот. По данным M. Malone [35], сульфат амантадина оказывает влияние на биоэлектрическую активность левого полушария. Препарат вызывает перестройку функциональных взаимоотношений срединностволовых дофаминергических структур мозга, участвующих в контроле последовательности действий и планировании движений.
Недостаточность сведений о влиянии сульфата амантадина на динамику когнитивных нарушений у больных БП послужила основой для проведения данного исследования.
Цель исследования состояла в выявлении влияния сульфата амантадина на динамику когнитивных нарушений у пациентов с БП.
Материал и методы
Наблюдали 25 больных БП с когнитивными нарушениями. В их числе были 13 мужчин и 12 женщин.
Диагноз БП устанавливался в соответствии с критериями Банка головного мозга Великобритании.
Средний возраст больных составил 60,8±10,9 года; средняя длительность заболевания — 9,7±5,1 года; средняя оценка степени тяжести БП по шкале Хен—Яра составила 3,5±0,5, по шкале UPDRS – 59,6±16,2 балла. Распределение по формам заболевания было следующее: акинетико-ригидная форма была диагностирована у 10 пациентов с БП, смешанная — у 15.
Анализ когнитивных нарушений проводился с использованием критериев Н.Н. Яхно [14], МКБ-10 [10] и модифицированных критериев R. Petersen [40].
Для определения степени выраженности когнитивных нарушений использовались следующие шкалы и опросники: Краткая шкала оценки психического статуса (MMSE), результаты которой имели следующие значения: ЛКН соответствуют 30—28 баллам; УКН — 27—25 баллам; деменция — 24 баллам и ниже; Батарея тестов для оценки лобной дисфункции (БТЛТ), по результатам использования которой когнитивные нарушения интерпретировались следующим образом: ЛКН соответствуют 16—18 баллам; УКН — 12—15 баллам; деменция — 11 баллам и ниже; Шкала деменции Маттиса (ШДМ), по которой ЛКН соответствуют 124 баллам и выше; УКН — 115—123 баллам; деменция — 115 баллам. Двигательные нарушения и оценка их степени тяжести проводилась по шкалам Хен—Яра
[28]и UPDRS [22].
При диагностировании любых когнитивных наруше-
ний у пациентов с БП к лечению добавлялся сульфат амантадина (ПК-Мерц) в дозе 300 мг в сутки в таблетках в течение 6 мес.
Длительность наблюдения составила 6 мес, клиническое и нейропсихологическое обследование проводилось
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
27 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
при первом визите для диагностики когнитивных нарушений, далее через 3 и 6 мес после начала лечения сульфатом амантадина.
Статистический анализ проводился с помощью программы Statistica 6 с применением непараметрических методов (критерий знаков и парный критерий Вилкоксона).
Результаты и обсуждение
УКН были выявлены у 15 пациентов с БП, у 10 пациентов была диагностирована деменция. По данным нейропсихологического обследования были обнаружены дизрегуляторные расстройства в виде снижения активности, трудности переключения с одного задания на другое, нарушение контроля результата деятельности (субтест «концептуализация» БТЛТ и ШДМ, динамический праксис БТЛТ), повышение тормозимости следа памяти интерференцией (субтесты «память» MMSE и ШДМ), снижение внимания (субтесты «внимание» MMSE и ШДМ), а также нарушение зрительно-пространственной функции (субтест «конструктивный праксис» MMSE).
Выраженность двигательных нарушений и степень тяжести заболевания были больше у дементных пациентов по сравнению с пациентами с УКН (табл. 1).
При анализе двигательных симптомов у пациентов с БП на фоне терапии сульфатом амантадина через 6 мес терапии отмечалась тенденция к уменьшению выраженности симптомов паркинсонизма и балльной оценки по шкале UPDRS (табл. 2).
Обращает на себя внимание постепенная трансформация на фоне лечения УКН в ЛКН (см. рисунок).
У пациентов с БП с УКН отмечалась положительная динамика нейропсихологического статуса через 6 мес от начала лечения сульфатом амантадина (табл. 3).
Таким образом, на фоне приема сульфата амантадина у пациентов с БП с УКН отмечалось достоверное повышение общего балла по шкале MMSE, БТЛТ и ШДМ, в том числе в субтестах «память» (MMSE), «внимание» (ШДМ) и «тормозной контроль» (БТЛТ). Было выявлено уменьшение выраженности дизрегуляторных нарушений к 6-му месяцу наблюдения. Об этом свидетельствует тенденция повышения балльной оценки в субтестах «иници-
Таблица 1. Общая характеристика пациентов с БП с когнитивными нарушениями
Показатель (M±δ) |
Пациенты с БП с УКН (n=15) Пациенты с БП с деменцией (n=10) |
|
Возраст, годы |
53,3±8,6 |
65,6±9,0 |
Длительность заболевания, годы |
8,3±3,5 |
10,7±6,7 |
Степень тяжести по шкале Хен—Яра, баллы |
3,5±0,5 |
3,9±0,2* |
Общая оценка по шкале UPDRS, баллы |
57,8±19,5 |
62,3±13,2* |
MMSE, баллы |
25,8±0,9 |
23,1±1,1* |
БТЛТ, баллы |
120,6±6,3 |
121,0±3,6 |
ШДМ, баллы |
115,8±1,1 |
111,0±0,4* |
Примечание. * — различия между группами пациентов статистически достоверны, p<0,05.
Таблица 2. Динамика двигательных симптомов у пациентов с БП на фоне приема сульфата амантадина в дозе 300 мг в сутки
Показатель (M±δ) |
До лечения |
Через 3 мес терапии |
Через 6 мес терапии |
Стадия заболевания по шкале Хен—Яра, баллы |
3,6±0,5 |
3,2±0,7* |
3,2±0,6* |
Общая оценка по шкале UPDRS, баллы |
60,6±10,2 |
58,4±14,3* |
58,9±12,2* |
Примечание. Здесь и в табл.3 и 4: * — достоверность различий по сравнению с уровнем до лечения р<0,05.
Таблица 3. Динамика показателей нейропсихологического тестирования у пациентов с БП с УКН на фоне лечения сульфатом амантадина
Нейропсихологические функции и соответствующие |
До лечения |
Через 3 мес терапии |
Через 6 мес терапии |
|
им тесты |
||||
|
|
|
||
MMSE |
25,8±0,9 |
26,3±1,3 |
27,4±1,4* |
|
БТЛТ |
13,8±2,1 |
15,1±2,3 |
15,6±2,3 |
|
ШДМ |
120,0±6,3 |
122,1±1,6 |
123,9±8,3* |
|
Инициация (ШДМ) |
20,4±1,5 |
20,3±1,7 |
21,0±2,2 |
|
Концептуализация (ШДМ) |
38,9±2,4 |
37,1±2,2 |
34,9±5,2 |
|
Концептуализация (БТЛТ) |
2,9±0,3 |
3,0±0,1 |
3,0±0,1 |
|
Тормозной контроль (БТЛТ) |
1,8±0,9 |
2,3±0,8 |
2,5±0,8* |
|
Динамический праксис (БТЛТ) |
1,8±1,0 |
1,9±0,8 |
2,0±0,8 |
|
Конструктивный праксис (MMSE) |
0,6±0,3 |
0,7±0,3 |
1,0±0,1 |
|
Конструктивный праксис (ШДМ) |
5,9±0,4 |
5,9±0,4 |
5,8±0,7 |
|
Память (MMSE) |
1,5±0,8 |
2,0±0,5 |
2,1±0,8* |
|
Память (ШДМ) |
23,6±2,6 |
24,4±4,0 |
24,4±2,7 |
|
Внимание (MMSE) |
4,1±0,9 |
4,1±0,9 |
4,5±0,7 |
|
Внимание (ШДМ) |
35,5±2,4 |
35,9±0,9 |
39,8±3,2* |
|
Речевая активность (БЛТ) |
2,7±0,6 |
2,7±0,9 |
2,7±0,6 |
28 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
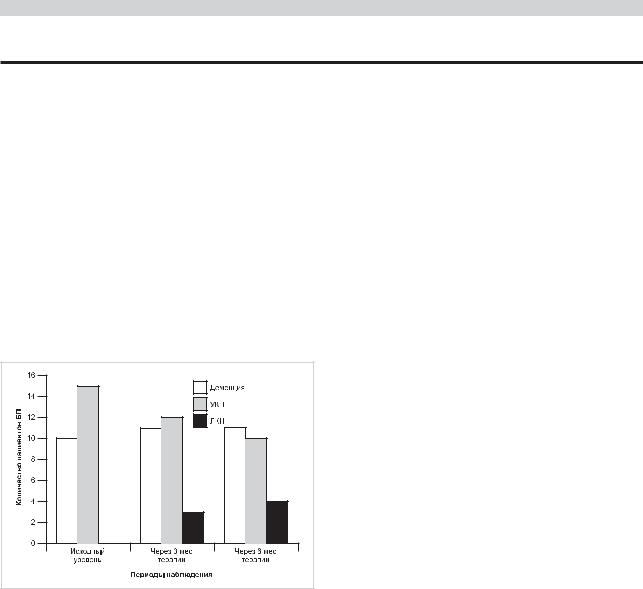
Таблица 4. Динамика показателей нейропсихологического тестирования у пациентов с БП с деменцией на фоне лечения
Нейропсихологические функции и соответствующие |
До лечения |
Через 3 мес терапии |
Через 6 мес терапии |
|
им тесты |
||||
|
|
|
||
MMSE |
22,6±0,5 |
22,8±0,5 |
23,8±0,4 |
|
БТЛТ |
11,0±1,0 |
13,2±1,3 |
14,8±2,2* |
|
ШДМ |
111,0±3,9 |
110,0±0,9 |
110,2±0,8 |
|
Инициация (ШДМ) |
19,0±0,3 |
21,8±2,3 |
20,0±4,5 |
|
Концептуализация (ШДМ) |
36,4±0,9 |
36,0±0,3 |
31,0±1,1 |
|
Концептуализация (БТЛТ) |
2,7±0,3 |
2,9±0,1 |
2,9±0,1 |
|
Тормозной контроль (БТЛТ) |
1,6±0,9 |
1,8±0,3 |
1,9±0,2* |
|
Динамический праксис (БТЛТ) |
1,7±1,0 |
1,7±0,8 |
1,7±0,8 |
|
Конструктивный праксис (MMSE) |
0,6±0,3 |
0,7±0,3 |
1,0±0,1 |
|
Конструктивный праксис (ШДМ) |
5,9±0,4 |
5,9±0,4 |
5,8±0,7 |
|
Память (MMSE) |
1,5±0,8 |
1,8±0,5 |
1,7±0,8 |
|
Память (ШДМ) |
22,0±1,4 |
20,8±5,8 |
21,6±4,4 |
|
Внимание (MMSE) |
3,5±0,9 |
3,7±0,9 |
3,9±0,7 |
|
Внимание (ШДМ) |
31,8±3,8 |
30,8±4,1 |
30,0±5,4 |
|
Речевая активность (БТЛТ) |
2,5±0,3 |
2,5±0,4 |
2,5±0,6 |
Динамика когнитивных нарушений у пациентов с БП на фоне |
лечения сульфатом амантадина. |
ация», «концептуализация», «конструктивный праксис» и «динамический праксис».
Динамика когнитивных нарушений у пациентов с БП с деменцией через 6 мес от начала лечения была менее четкой (табл. 4).
Таким образом, у пациентов с БП с деменцией на фоне лечения сульфатом амантадина отмечалось улучшение показателей нейропсихологического статуса по шкалам MMSE и БТЛТ, в том числе по субшкале БТЛТ «тормозный контроль». При использовании ШДМ положительной динамики познавательных функций выявлено не было, что, вероятно, связано с меньшей чувствительностью методики по сравнению с БТЛТ. Результат можно объяснить преобладанием подкорково-лобных нарушений в структуре когнитивного дефицита у больных БП.
Сульфат амантадина в дозе 300 мг в сутки замедляет трансформацию умеренного когнитивного расстройства в деменцию. Прием препарата сопровождается достоверным улучшением памяти (MMSE), внимания (ШДМ) и регуляторной функции (БТЛТ) у больных БП с УКН. У больных с деменцией отмечается достоверное улучшение общей оценки по шкалам MMSE и БТЛТ. Статистически значимые различия между оценками по субшкалам отмечены только при оценке «тормозного контроля» с использованием БТЛТ.
Уменьшение выраженности когнитивных расстройств у пациентов с БП при адекватном лечении способствует снижению уровня экономических затрат на обеспечение данной группы пациентов и приводит к повышению качества жизни и повседневной активности больных.
ЛИТЕРАТУРА
1.Аракелян Р.К., Неробкова Е.А., Катунина Е.А. Функциональная активность головного мозга у пациента с болезнью Паркинсона при лечении сульфатом амантадина. Журн неврол и психиат 2005; 4.
2.Артемьев Д.В., Глозман Ж.М. Нарушения высших психических функций при болезни Паркинсона. В сб.: Достижения в нейрогериатрии. Под ред. Н.Н. Яхно, И.В. Дамулина. М 1995; 1: 46—58.
3.Дамулин И.В. Деменция при болезни Паркинсона. Метод. пособие для врачей. M 2005.
4.Захаров В.В. Деменция при болезни Паркинсона. Неврол журн (приложение 1) 2006; 11:13—18.
5.Захаров В.В. Нарушение когнитивных функций при болезни Паркинсона и симптоматическом паркинсонизме: Дис. … д-ра мед. наук. М 2003; 36—40.
6.Захаров В.В., Ярославцева П.В., Яхно Н.Н. Когнитивные нарушения при болезни Паркинсона. Неврол журн 2003; 2: 11—15.
7.Захаров В.В., Яхно Н.Н. Синдром умеренных когнитивных расстройств в пожилом возрасте: диагностика и лечение. Рус мед журн 2004; 10: 573—576.
8.Левин О.С., Батукаева Л.А., Смоленцева И.Г. Диагностика и лечение деменции при болезни Паркинсона. Журн неврол и психиат 2008; 6: 91—97.
9.Левин О.С., Голубева Л.В. Гетерогенность умеренного когнитивного расстройства: диагностические и терапевтические аспекты. Консилиум 2006; 12: 106—110.
10.МКБ 10. Международная статистическая классификация болезней и проблем, связанных со здоровьем, 10-й пересмотр. Том 1. Женева: ВОЗ 1995.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
29 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
11.Пилипович А.А., Голубев В.Л. Влияние пронорана на когнитивные и 28. Hoehn M., Yahr M.D. Parkinsonism: onset, progression and mortality.
аффективные нарушения при болезни Паркинсона. Журн неврол и психиат 2005; 4: 41—47.
12.Садикова А.Н. Коррекция клинических, нейропсихологических, компьютерно-томографических данных при болезни Паркинсона: Дис… канд. мед. наук. М 1997.
13.Степкина А.Д., Захаров В.В., Яхно Н.Н. Когнитивные нарушения при прогрессировании болезни Паркинсона. Журн неврол и психиат 2005;10: 13-19.
Neurology 1967; 17: 5: 427—442.
29.Inzelberg R., Bonuccelli U. et al. Association Between Amantadine and the Onset of dementia in Parkinson‘s disease. Mov Dis 2006; 2: 9: 1375—1379.
30.Jacobs D.M., Marder K., Cote L. et al. Neuropsychological characteristics of preclinical dementia in Parkinson’s disease. Neurology 1995; 45: 1691— 1696.
31.Kaplan J., Goodglass H., Weintraub S. The Boston Naming test. Boston 1978.
14.Яхно Н.Н. Когнитивные расстройства в неврологической клинике. 32. Le Bars P.L., Katz M.M., Berman N. A Placebo-controlled, double-blind,
Неврол журн (приложение 1) 2006; 11: 4—12.
15.Benton A.L., Varney N.R., Hamsher K. Visuospatial judjement: a clinical test. Arch Neurol 1978; 35: 364—367.
16.Bronnick K., Emre M., Lane R. et al. Profile of cognitive impairment in dementia associated with Parkinson’s disease compared with Alzheimer’s disease. J Neurol Neurosurg Psychiat 2007; 78: 1064—1068.
17.Caspar P., Duyckaens et al. Alterations of dopaminergic and noradrenergic innervations in motor cortex in Parkinson‘s disease. Ann Neurol 1991; 30: 365—374.
18.Cummings J.L. Cholinesterase inhibitors for treatment of dementia associated with Parkinson’s disease. J Neurol Neurosurg Psychiat 2005; 76: 903—904.
19.Dubois B., Slachevsky A., Litvan I., Pillon B. The FAB: a frontal assessment battery at bedside. Neurology 2000; 55: 1621—1626.
20.Emre M., Aarsland D., Brown R. et al. Clinical diagnostic criteria for dementia associated with Parkinson disease. Mov Dis 2007; 22: 1689— 1707.
21.Erme M. Dementia associated with Parkinson’s disease. Lancet Neurol 2003; 2: 229—237.
22.Fahn S., Eiton R. Unified Parkinson’s disease rating scale. Recent developments in Parkinson’s disearse. S.Fahn, C. Marsden, D. Calne et al. (eds). McMillan Healthcare Information 1987; 5: 153—163.
23.Folstein M.F., Folstein S.E., McHugh P.R. Mini-Mental State: a practical guide for grading the mental state of patients for the clinician. J Psychiat Res 1975; 12: 189—198.
24.Galvin J.E., Pollack J., Morris J.C. Clinical phenotype of Parkinson disease dementia. Neurology 2006; 67: 1605—1611.
25.Gianutsos G., Chute S., Dunne J.P. Pharmacological changes in dopaminergic systems induced by long-term administration of amantadine. Eur J Pharmacol 1985; 110: 357—361.
26.Golomb J., Kluger A., Ferris S.H. Cllinican’s Manual on Mild Cognitive Impairment. London: Science Press 2001.
27.Hobson P., Meara J. Risk and incidence of dementia in a cohort of older subjects with Parkinson’s disease in the United Kingdom. Mov Dis 2004; 19: 1043—1049.
randomized trial of an extract of Gingo Biloba for dementia. JAMA 1997;
278: 1327—1332.
33.Lewy G., Jacobs D.M. Memory and executive function impairment predict dementia in Parkinson’s disease. Mov Dis 2002; 17: 6: 1221—1226.
34.Lezak M.D. Neuropsychology Assessment New York. NY: University Press 1983; 768.
35.Malone M.A., Kerchner J., Swanson J.M. Hemispheric processing and methylphenidate effects in attention deficit hyperactivity disorder. J Child Neurol 1997; 9: 2: 181.
36.Marder K., Tang M.X., Cote L., Stern Y. The frequency and associated risk factors for dementia in patients with Parkinson’s disease. Arch Neurol 1995; 52:695—701.
37.Mattis S. Mental state examination for organic mental syndrome in the elderly patients. Ger Psychiaty. L. Bellack, T. B. Karasu (eds). New York 1976.
38.Palmer K., Jelic V., Winblad B. Preface: mild cognitive impairment. Acta Neurol Scand 2003; 107 (Suppl 179): 5—6.
39.Peppard R.F., Martin W.R., Carr G.D. et al. Cerebral glucose metabolism in Parkinson’s disease with and without dementia. Arch Neurol 1992; 49: 1262—1268.
40.Petersen R.S., Smith G.E., Waring S.C. et al. Mild cognitive impairment: clinical characterization and outcome. Arch Neurol 1999; 56: 303—308.
41.Petersen R.S., Touchon J. Consensus on mild cognitive impairment. Res Pract Alzheimer’s Dis 2005; 10: 24—32.
42.Poewe W., Wolters E., Emre M. et al. Long-term benefits of rivastigmine in dementia associated with Parkinson’s disease: an active treatment extension study. Mov Dis 2006; 21: 4: 456—461.
43.von Voigtlander P. R., Moore K.E. Dopamine release from the brain in vivo by amantadine. Science 1937; 174: 408—410.
44.Young A.B. et al. In excitatory amino acids and synaptic transmission. New York: Academic Press—Harccourt—Brace and Co. 29—40.
30 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 7, 2010 |
