
Журнал неврологии и психиатрии / 2010 / NEV_2010_10_072
.pdf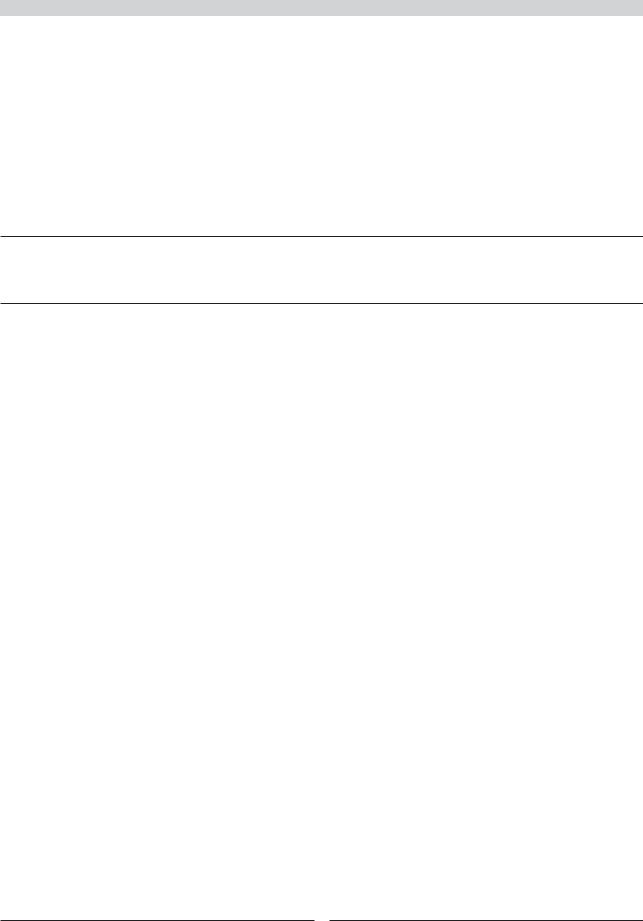
ОБЗОРЫ
Противоэпилептический препарат лакосамид (вимпат)
Гл.н.с. Л.Р. ЗЕНКОВ
Antiepileptic drug lacosamide (vimpat)
L.R. ZENKOV
Клиника нервных болезней им. А.Я. Кожевникова; лаборатория клинико-электрофизиологических исследований Первого МГМУ
им. И.М. Сеченова
Ключевые слова: лакосамид, фокальная эпилепсия.
Key words: lacosamid, focal epilepsy.
Несмотря на значительные успехи, достигнутые в лечении эпилепсии, приблизительно 20—30% больных не поддаются фармакотерапии. Большинство фармакорезистентных случаев эпилепсии относятся к фокальным формам, которые в свою очередь составляют около 70—85% всех форм эпилепсии и эпилептических синдромов [1, 2]. Поэтому основным направлением развития фармакотерапии эпилепсии в настоящее время является разработка препаратов, эффективных именно в лечении фокальных припадков.
Современная эпилептологическая фармакохимия характеризуется новой парадигмой разработки препаратов, основанной на формировании потенциальных лечебных свойств путем целенаправленной модификации структуры известных химических соединений. Замещая различными группами атомов ключевые зоны в органических молекулах, выявляют значимые для целевой функции компоненты. Таким подходом получают не отдельное вещество, а целые группы сходных по функциональной структуре потенциально эффективных соединений, последующее экспериментальное тестирование которых позволяет выявить оптимальное по соотношению эффективность/безопасность вещество в качестве будущего лекарственного препарата [36]. Таким путем была получена группа аминокислот, функционализированных в области N- и C-терминалий, с выраженной противосудорожной активностью. Свойства подавлять эпилептическую активность были выявлены в стандартных процедурах тестирования противоэпилептических препаратов (ПЭП): подавлением судорожного ответа на максимальный электрошок и подкожное введение пентилентетразола у мышей и крыс [3, 8, 33]. Последующее тестирование показало, что из этих аминокислот наибольшей эффективностью и относительно мало выраженным побочным действием обладает правый стереоизомер (R)-2-ацетамидо-N-бензил- 3-метокси-пропионамид, получивший международное название лакосамид (коммерческое название — вимпат).
Лакосамид (вимпат) представляет собой часть аминокислоты серина, функционализированную ацетамидной единицей (C(O)CH3) [8, 36]. Дальнейшие исследования на микронейрофизиологическом уровне позволили установить особые свойства лакосамида, которым посвящен настоящий обзор.
Механизм действия
Экспериментальные исследования показали, что лакосамиду не свойственен ни один из известных механизмов действия, характерных для ПЭП. Он не влияет на транспорт нейротрансмиттеров — норэпинефрина, дофамина, серотонина (5-гидрокситриптамина), ГАМК, не блокирует ГАМК-трансаминазу. В отличие от фенитоина (ФТ) лакосамид не блокирует короткие поддерживающиеся разряды нейронов, не влияет на потенциалзависимые кальциевые каналы и K+ каналы. Он также не влияет на потенциал покоя мембраны нейрона и ее пассивные свойства, не связывается с известными мишенями ПЭП, такими как AMPA-, каинатные, NMDA-, GABAA- и GABABрецепторы [8, 20, 36].
Было установлено, что эффективность лакосамида обусловлена его влиянием на Na+-каналы мембраны нейрона, но посредством механизма, существенно отличного от известных блокаторов Na+-каналов, обладающих противоэпилептическим действием — ФТ и карбамазепина (КБЗ). Эпилептический нейрон характеризуется сниженной поляризацией мембраны и ее нестабильностью. Вследствие фоновой деполяризации и нестабильности нейрон генерирует пароксизмальные деполяризационные сдвиги (ПДС). Они представляют собой длительные высокоамплитудные смещения потенциала мембраны в сторону деполяризации, на гребнях которых генерируются высокочастотные повторяющиеся разряды потенциалов действия, которые, бомбардируя следующие каскады нейронов, ведут к лавинообразному вовлечению мозга в эпилептическую активность (рис. 1). Основным механизмом фоновой деполяризации и ПДС эпилептического нейро-
© Л.Р. Зенков, 2010 |
e-mail: zenkov@mmascience.ru |
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:10:72
72 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |
ЛЕЧЕНИЕ ЭПИЛЕПСИИ
Рис. 1. Патофизиология эпилептического нейрона.
В покое мембранный потенциал в абсолютном отношении ниже, чем в норме (в данном случае — 50 мВ). Уменьшение уровня потенциала мембраны делает ее нестабильной и повышает готовность к реакции под влиянием синаптического возбуждения или спонтанных колебаний внутриклеточного потенциала. При значительных деполяризационных сдвигах за пороговый уровень деполяризации (в данном случае — 30 мВ) на их гребнях генерируются высокочастотные потенциалы действия, бомбардирующие по синаптическим связям другие нейроны, вовлекая их в гиперсинхронную эпилептическую активность. Заброс потенциалов действия в область позитивности (выше 0 мВ) ведет к массивному открытию Na+-каналов и самоподдержанию длительного ПДС и высокочастотного возбуждающего разряда потенциалов действия нейрона.
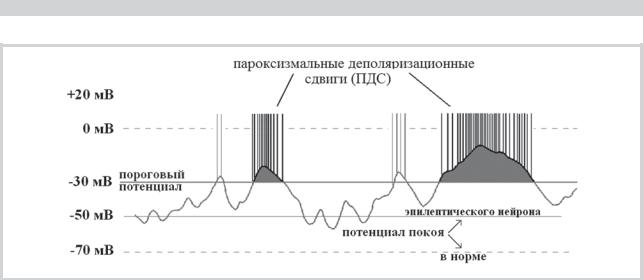
на является избыточная активность Na+-каналов, пропускающих внутрь нейрона избыточное количество положительных Na+-ионов. ФТ и КБЗ реализуют противосудорожный эффект, блокируя регулируемые напряжением Na+-каналы зависящим от потенциала мембраны образом. Регулируемые напряжением Na+-каналы могут находиться в разном функциональном состоянии в зависимости от потенциала мембраны (рис. 2). При деполяризации мембраны из состояния покоя они активируются, открывая приток Na+-ионов внутрь клетки и запуская генерацию потенциала действия. После деполяризации регулируемые напряжением Na+-каналы переходят в инактивированное состояние и затем возвращаются в состояние покоя, из которого могут вновь открыться. Регулируемые напряжением Na+-каналы, находящиеся в инактивированном состоянии, не могут раскрыться прежде возвращения в состояние покоя. Инактивация, возникающая в течение миллисекунд после потенциала действия, называется быстрой инактивацией. Такие традиционные блокаторы натриевых каналов, как ФТ, КБЗ и ламотриджин (ЛТГ) усиливают в основном быструю инактивацию натриевых каналов [8, 9, 10, 20, 36]. За быстрой инактивацией следует медленная инактивация Na+-каналов, продолжающаяся секунды и минуты. Она связана с временным структурным изменением Na+-каналов, что препятствует возбуждающей деполяризации мембраны и реализует длительное снижение способности нейрона генерировать потенциалы действия [17, 20, 29, 30]. Лакосамид избирательно усиливает медленную инактивацию, уменьшая на длительное время пул активных натриевых каналов и реализуя тем самым длительную блокаду возможности генерации нейроном ПДС, лежащих в основе эпилептических разрядов в мозге [20]. Причем лакосамид увеличивает вероятность вхождения мембраны в медленную инактивацию при любом уровне потенциала нейрона [20] (рис. 3).
В экспериментах с культурой ткани мозга обнаружено влияние лакосамида на белок-медиатор ответа коллапси- на-2 (collapsin response mediator protein-2 — CRMP-2).
Белки медиатора ответа коллапсина представляют собой семейство фосфопротеинов, участвующих в макро- и микроструктурном формировании нервной системы, спрутинге, росте аксонов и апоптозе. Экспрессия CRMP-2 подвергается значительным изменениям в поврежденных нейронах медиальной височной коры при фармакорезистентной эпилепсии с мезиальным склерозом. Показано, что лакосамид взаимодействует с CRMP-2, однако возможная роль этого взаимодействия в противоэпилептической активности подлежит исследованию [49].
Действие лакосамида на экспериментальные модели эпилепсии
Исследования лечебных свойств лакосамида в стандартных моделях эпилепсии на мышах и крысах показали его эффективность, проявляющуюся в подавлении развития эпилептического припадка в ответ на максимальный электрошок, наносимый на роговицу (60 Гц, 0,2 с). Этот тест отражает способность препарата не только подавлять фокальный припадок, но и предотвращать его генерализацию [11].
Лакосамид достоверно повышает порог и время появления первых судорог в модели эпилепсии с внутривенным введением пентилентетразола [43]. В модели судорог, вызванных N-метил-D-аспартатом, лакосамид частично предотвращает клонические и полностью тонические судороги, а также гибель животных [43].
Моделью одной из наиболее тяжелых и труднокурабельной лимбической эпилепсии человека является киндлинговая гиппокампальная модель. Киндлинг — создание эпилептического фокуса повторными электростимуляциями мозга животного. В двух вариантах киндлинговой гиппокампальной эпилепсии лакосамид оказался эффективным не только в снижении числа припадков, но и эффективнее ФТ, КБЗ, вальпроевой кислоты (ВПК) и этосуксимида в подавлении электроэнцефалографического эпилептического послеразряда [4, 9, 11, 19]. Вводимый до начала киндлинговой стимуляции гиппокампа или мин-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |
73 |
ОБЗОРЫ
Рис. 2. Потенциал действия нейрона (А), активность потенциал-зависимых Na+-каналов и влияние на них ПЭП (Б).
На фрагменте А: потенциал действия начинается с быстрой деполяризации, которая по достижении уровня порога потенциала действия нейрона принимает самоподдерживающийся характер и, продолжаясь дальше, переходит нулевой уровень в зону позитивности («заброс»), затем быстро падает до уровня потенциала покоя и далее, переходя в низкоамплитудные потенциалы гиперполяризации и деполяризации, возвращается к потенциалу покоя.
По оси абсцисс — время (мс).
На фрагменте Б показана динамика активности натриевых каналов. Вплоть до максимума потенциала действия активность каналов возрастает, избыточные ионы Na+ забрасываются внутрь нейрона, за счет чего и развивается потенциал действия с «забросом». С момента максимума потенциала действия начинается усиливающаяся инактивация Na+-каналов, за счет чего потенциал мембраны возвращается к потенциалу покоя, и далее следует резко выраженная в начальном периоде (3—10 мс — быстрая инактивация), а затем менее выраженная, длящаяся до минут, медленная инактивация. В период быстрой инактивации нейрон находится в стадии абсолютной рефрактерности и не способен генерировать потенциалы действия. В период медленной инактивации вероятность генерации нейроном потенциалов действия снижена, но не заблокирована полностью. Лакосамид избирательно усиливает медленную инактивацию, сдвигая кривую активности Na+-каналов вниз (↓↓↓↓), независимо от потенциала мембраны, резко удлиняя тем самым период невозможности генерировать высокочастотные эпилептические потенциалы действия (см. рис. 1).
далины мозга, лакосамид предотвращал развитие кинд- |
ных различий его негативного действия на когнитивные |
линговой эпилепсии [9, 11, 40]. Эти данные говорят о воз- |
функции от ФТ, ВПК и прегабалина [28]. |
можной роли лакосамида не только в предотвращении |
Было также выявлено его выраженное анксиолитиче- |
припадков, но и в приостановке эпилептогенеза и эпи- |
ское действие у мышей [27]. Последний эффект представ- |
лептического процесса. |
ляет клинический интерес, учитывая частую коморбид- |
На моделях эпилептического статуса была показана |
ность эпилепсии и тревожных расстройств. T. Stohr и со- |
способность лакосамида блокировать статус генерализо- |
авт. было показано подавление лакосамидом эксперимен- |
ванных тонико-клонических припадков, уменьшать его |
тального тремора [44]. Поскольку тремор является частым |
длительность и предотвращать развитие структурных на- |
побочным эффектом других ПЭП, этот эффект лакосами- |
рушений в гиппокампе [9, 37, 43, 48]. Этот нейропротек- |
да может быть клинически полезным, особенно при труд- |
торный эффект лакосамида был подтвержден в модели с |
нокурабельной эпилепсии, при которой обычно исполь- |
окклюзией средней мозговой артерии. Была также пока- |
зуются максимальные дозы вызывающих тремор препара- |
зана возможность предотвращения лакосамидом экспе- |
тов. В экспериментах на животных был выявлен антино- |
риментального апоптоза нейронов [17]. |
цицептивный эффект лакосамида [6, 9, 24, 41, 42], кото- |
Лакосамид, однако, не эффективен в WAG/Rij моде- |
рый сейчас изучается в соответствующих клинических |
ли генетически обусловленной абсансной эпилепсии у |
исследованиях [40]. |
крыс [8]. |
Приведенные данные показывают, что лакосамид об- |
Экспериментальные исследования показали хоро- |
ладает свойством подавления фокальных эпилептических |
шую переносимость лакосамида и отсутствие достовер- |
припадков и соответствующих им эпилептических разря- |
|
дов в мозге. Эффективность в тесте максимального элек- |
74 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |

ЛЕЧЕНИЕ ЭПИЛЕПСИИ
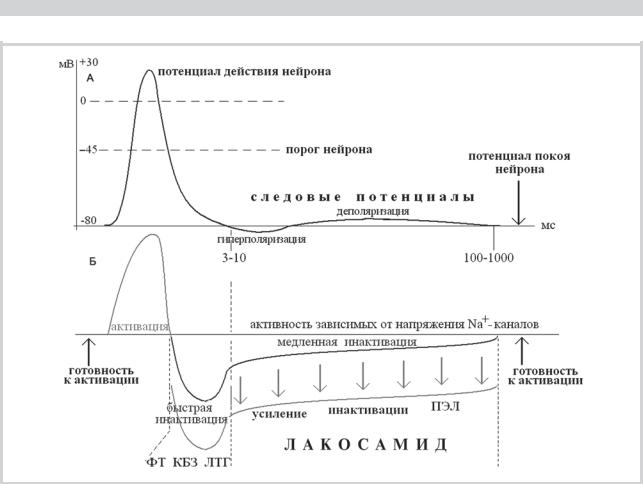
Рис. 3. Влияние лакосамида на высокочастотный разряд нейрона, вызванный экспериментальным 10-секундным деполяризационным сдвигом, моделирующим эпилептический ПДС.
«RMP: — 70 mV» — уровень потенциала покоя мембраны. Верхняя запись сделана в отсутствие лакосамида. Виден высокочастотный разряд потенциалов действия на протяжении всех 10 с деполяризационного сдвига. На последовательных регистрациях, сделанных на увеличивающихся концентрациях лакосамида, продемонстрирована нарастающая блокада разряда в зоне медленной инактивации Na+-каналов. Видна независимость инактивации от уровня потенциала мембраны и ее действие на протяжении всего деполяризационного сдвига за исключением самой ранней части, соответствующей быстрой инактивации, где эффективны КБЗ и ФТ, но не лакосамид. (Из: Errington Adam C., Stöhr Thomas, Heers Cara, Lees George., 2008 [20] с изменениями с разрешения авторов).
трошока говорит о его возможностях в лечении не только простых фокальных, но и вторично-генерализованных эпилептических припадков. Особый интерес представляет эффективность в модели гиппокампальной киндлинговой эпилепсии, что открывает возможность его применения в лечении наиболее труднокурабельных мезиальных височных эпилепсий у человека. Лакосамид может оказаться эффективным в лечении эпилептического статуса и, наконец, есть основания предполагать его нейропротекторные возможности и потенциал влияния не только на припадки, но и на сам эпилептический процесс. Спектр дополнительных эффектов, помимо противоэпилептического, позволяет ожидать возможности его влияния и на сопровождающие заболевание перманентные коморбидные расстройства.
Клиническая эффективность и безопасность лакосамида
Основные данные о клинической эффективности и безопасности лакосамида мы излагаем на основе результатов трех масштабных тщательно спланированных слепых плацебо-контролированных мультицентровых исследований [7, 14, 15, 23]. Остановимся на второй фазе пер-
вого исследования [23] и третьей фазе двух других работ [14, 15]. Все три исследования были построены по единому дизайну.
Висследовании, которое нашло отражение в статье P. Halasz и соавт. [23], принимали участие и российские специалисты. Для испытания эффективности препарата пациентам в возрасте 16 и более лет с продолжающимися, несмотря на применение не менее двух ПЭП, эпилептическими фокальными приступами с вторичной или без таковой генерализацией, назначали лакосамид в качестве дополнительной терапии в дозах 200, 400 и 600* мг в сутки. Начальная суточная доза была 50 мг в сутки с последующим увеличением по 100 мг в неделю до целевой дозы. По завершении фазы титрации следовала фаза удержания на целевой дозе в течение 12 нед с перспективой дальнейшего продолжения в открытом исследовании. Пациентам с непереносимыми побочными эффектами, возникшими на целевой дозе, разрешалось снижение суточной дозы на 100 мг в конце периода титрации. Всего в исследованиях участвовали 1294 пациентов, рандомизированных в три группы со средним возрастом в группах 38,6 года. Непосредственно до и вместе с лакосамидом 2 и более ПЭП получали 84,4% пациентов. ПЭП, к которым добавлялся лакосамид, включали «традиционные» — КБЗ, ВПК, ФТ, фенобарбитал и «новые» — леветирацетам (ЛЕВ), ЛТГ, топирамат (ТПМ), окскарбазепин. Дополнительно получали лечение стимуляцией блуждающего нерва 17% больных. Около половины пациентов в прошлом безуспешно пробовали лечение 7 и более ПЭП [14]. Первичная оценка эффективности проводилась по изменению частоты припадков двумя способами: 1) изменение от частоты припадков за 28 дней, непосредственно предшествовавших лечению лакоcамидом, до частоты в период удержания на целевой дозе лакосамида; 2) пропорция пациентов с 50% и более снижением частоты приступов в период удержания на препарате (рейтинг респондеров).
Во второй фазе рассматриваемого исследования число респондеров было 32,7% при дозе 200 мг в сутки (p=0,090), 41,1% — при дозе 400 мг в сутки (p=0,004) и 38,1% — при дозе 600* мг в сутки (p=0,014), в сравнении с 21,9% при приеме больными плацебо [7]. Снижение частоты припадков по отношению к 28 дням базового периода составило 14,6% при дозе 200 мг в сутки (р=0,10), 28,4% (p=0,002) — при дозе 400 мг в сутки и 21,3%, (p=0,008) — при дозе 600* мг в сутки, достоверно отличаясь от плацебо на двух последних дозах [8].
Втретьей фазе исследования, проведенного в странах Европы и Австралии [23], сравнивали дозы 200 и 400 мг в сутки с плацебо у 485 рандомизированных пациентов. Среднее снижение частоты припадков при приеме плацебо составило 20,5%, при дозе лакосамида 200 мг в сутки
— 35,3% (p=0,02), при дозе 400 мг в сутки — 36,4% (p=0,03). Число респондеров при дозе лакосамида 400 мг в сутки составило 40,5%, достоверно превышая плацебо (p=0,01).
Втретьей фазе исследования, проведенной в США [14, 15], сравнивались дозы лакосамида 400 и 600* мг в сутки и плацебо у 405 рандомизированных пациентов. Достоверные различия (p<0,001) в сравнении с плацебо по числу респондеров составили 38,3% — при дозе 400 мг в сутки и 41,2% — при 600* мг в сутки лакосамида; при назначении плацебо — 18,3%. Медиана уменьшения числа
Здесь и далее по тексту: * — дозировки 600 и 800 мг не являются зарегистрированными.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |
75 |

ОБЗОРЫ
приступов составила 37,3% для лакосамида в дозе 400 мг в сутки и 37,8% для дозы 600* мг в сутки.
Обобщенные результаты приведенных исследований показывают, что лечение лакосамидом статистически значимо уменьшает частоту приступов сравнительно с исходной на 33,3, 36,8 и 39,4% у пациентов, получавших лакосамид в дозе 200, 400 и 600* мг в сутки соответственно в сравнении с 18,4% в группе плацебо. Число респондеров при лечении лакосамидом было значимо выше, чем при назначении плацебо, и составляло 34,1, 39,7 и 41,0% у пациентов, получавших 200, 400 и 600* мг в сутки лакосамида, в сравнении с 22,6% у получавших плацебо [14, 15]. Дополнительный статистический анализ [22] данных этих трех исследований показал также, что использование лакосамида дает 42,3 дополнительных дней без припадков при дозе 400 мг в сутки и 53,7 дополнительных дня без припадков при дозе 600* мг в сутки. Кроме того, число респондеров с уменьшением числа припадков на 75% и более составило 22 и 24% при дозах 400 и 600* мг в сутки соответственно.
Таким образом, результаты трех приведенных исследований позволяют сделать вывод, что лакосамид в дозах от 200 до 600* мг в сутки эффективен в качестве дополнительной терапии парциальной эпилепсии у взрослых. В период лечения лакосамидом ремиссия была достигнута у 2,7, 3,3 и 4,8% пациентов при дозах 200, 400 и 600* мг в сутки соответственно против 0,9% на плацебо. Лакосамид в дозах от 200 до 400 мг в сутки эффективен в качестве дополнительной терапии парциальной эпилепсии у взрослых. Суточные дозы в 400 и 600* мг были близки по эффективности. При статистическом анализе не было установлено зависимости результатов терапии лакосамидом от исходной и сопутствующей противоэпилептической терапии. Улучшение при терапии лакосамидом наступало достаточно быстро: уже в период титрации при дозе 100 мг в сутки отмечалось достоверное снижение частоты припадков на 33% (p<0,01) сравнительно с плацебо — 19,4%. Если лечение продолжалось в течение 12 мес, то число припадков снижалось на 77% [7, 14, 15, 23]. Уменьшение числа припадков сопровождалось статистически значимым улучшением показателей качества жизни пациентов [18].
В рассмотренных выше трех исследованиях отмечена хорошая переносимость лакосамида. Наблюдавшиеся неблагоприятные явления были выражены в легкой или умеренной степени. Наиболее часто наблюдались головокружение, головная боль, тошнота и диплопия. Все неблагоприятные побочные эффекты (кроме головной боли) были дозозависимыми и наблюдались в большинстве случаев в фазу начального титрования дозы. При лабораторных и инструментальных исследованиях не было выявлено каких-либо изменений, с которыми можно было бы связать рассматриваемое действие лакосамида [15, 25].
Результаты других исследований
Выводы приведенных выше трех исследований, выполненных с соблюдением требований доказательной медицины, полностью совпадают с результатами ряда работ, построенных по другому дизайну.
В одном из открытых мультицентровых исследований лакосамид [21] давали пациентам с рефрактерной эпилепсией в качестве дополнительного препарата к уже принимаемым ими двум другим ПЭП. Доза постепенно наращи-
валась до 600* мг в сутки и затем снижалась вплоть до отмены в течение 1 недели. Количество припадков снижалось пропорционально дозе на 14% — при начальной дозе 100 мг в сутки, 34% — при средней и на 47% — при максимальной дозе. В другом открытом мультицентровом исследовании [39] при 4-недельном наблюдении при средней дозе 300 мг в сутки медианное снижение частоты приступов составило 31,8%, у 7,8% отмечено полное прекращение приступов; число респондеров было 33%. В постмаркетинговом открытом наблюдательном исследовании
[47]число респондеров составило 32%.
При лабораторных и инструментальных исследова-
ниях при перечисленных выше дозах изменений, которые можно было бы связать с действием лакосамида, выявлено не было [16].
При передозировке лакосамида (прием препарата в дозе 1200 мг в сутки) клиническая симптоматика побочных эффектов была в основном представлена со стороны ЦНС и желудочно-кишечного тракта (головокружение, тошнота), и она исчезала после снижения дозы. Своеобразным эффектом лакосамида, обнаруженным при исследованиях передозировки и фармакокинетики препарата в норме в дозах 300—800* мг в сутки, была эйфория, похожая на эффект альпрозалама (но более кратковременная), отмечавшаяся в разных исследованиях [12, 13, 15] у 6—25% испытуемых. В простмаркетинговых исследованиях были получены некоторые дополнительные данные о побочных эффектах и переносимости препарата. При приеме лакосамида была показана возможность снижения массы тела. Было описано [5] наблюдение попытки суицида (пациентка приняла сразу 12 г лакосамида, 56 г габапентина (ГБП), 2 г топирамата (ТПМ) и 2,8 г зонизамида), но после нескольких дней соответствующей симптоматической терапии наблюдалось полное восстановление исходного уровня здоровья. В целом в литературе была подтверждена хорошая переносимость и безопасность препарата.
Лакосамид существует в форме для внутривенного введения. В двухдневном рандомизированном двойном слепом контролированном исследовании [10] пациенты, ранее перорально лечившиеся лакосамидом, переводились на лечение внутривенным лакосамидом или плацебо (при продолжении орального приема лакосамида в случае плацебо и оральном приеме плацебо в случае внутривенного введения прежней оральной дозы лакосамида). Побочные эффекты были слабыми или умеренными и включали головокружение, головную боль, боль в спине и сонливость. Боль в месте венепункции не наблюдалась при 60-минутной инфузии, при 30-минутной инфузии у 11% отмечалась кратковременная слабая или умеренная боль.
В открытом исследовании [25] с быстрым введением лакосамида (10, 15 и 30 мин) в течение 2—5 дней (200— 800* мг в сутки) головная боль отмечалась у 5, 7 и 8%, головокружение у 5, 6 и 8% соответственно скорости введения.
Приведенные исследования наметили путь к практическому применению инъекционного лакосамида. Препарат для внутривенного введения в 1 мл готового раствора содержит 10 мг лакосамида, может использоваться в случаях, когда временно невозможна пероральная терапия, в первую очередь, при эпилептическом статусе** [31,
** Препарат не зарегистрирован для лечения эпилептического статуса, см. инструкцию по медицинскому применению препарата.
76 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |
|
ЛЕЧЕНИЕ ЭПИЛЕПСИИ |
Краткая информация о лакосамиде |
|
|
|
Международное название |
Лакосамид |
Коммерческое название |
Вимпат |
Лекарственная форма |
Таблетки 50 мг, 100 мг, 150 мг или 200 мг; сироп для приема внутрь, раствор для вну- |
|
тривенных инъекций |
Показания |
В составе комплексной терапии фокальных и вторично-генерализованных припадков |
|
у пациентов с эпилепсией в возрасте от 16 лет и старше |
Противопоказания |
Повышенная чувствительность к любому из компонентов препарата. Атриовентрику- |
|
лярная блокада II или III степени. Возраст до 16 лет |
Способ применения и дозы |
2 приема — утром и вечером. Стартовая доза 50 мг 2 раза в день. Через 1 нед дозу уве- |
|
личивают до 100 мг 2 раза в день. Поддерживающую дозу можно увеличить до 150 мг |
|
2 раза в день на 3-й неделе до максимальной суточной дозы 400 мг в сутки (200 мг |
|
2 раза в день) с 4-й недели. Отменять постепенно по 200 мг в неделю |
Побочные реакции |
Головокружение, головная боль, тошнота и диплопия. Выраженность некоторых по- |
|
бочных реакций зависит от дозы и уменьшается после ее снижения. Частота и тяжесть |
|
побочных реакций со стороны ЦНС и желудочно-кишечного тракта обычно умень- |
|
шается со временем. Применение лакосамида сопровождается дозозависимым удли- |
|
нением интервала PQ |
Фармакокинетика |
Биодоступность лакосамида в таблетках составляет примерно 100%. Максимальная |
|
концентрация (Cmax) достигается через 0,5—4 ч. Прямолинейная фармакокинетика. |
|
Связывание с белками плазмы — менее 15%. Время выравнивания концентрации в |
|
плазме — 3 дня; 95% дозы выводится через почки. Период полувыведения составляет |
|
примерно 13 ч. Взаимодействие с другими препаратами: несущественное |
Фармакодинамика |
Синергическое или аддитивное противосудорожное действие в комбинации с ЛЕВ, |
|
КБЗ, ФТ, ВПК, ЛТГ, ТПМ или ГБП |
Примечание. Более детально вопросы лечебного использования лакосамида изложены в «Инструкции по медицинскому применению препарата вимпат».
32, 37, 38, 45, 46]. Преимущество его применения в последнем случае определяется сравнительно незначительной местной реакцией, в то время как использование внутривенно фенитоина (ФТ) нередко приводит к выраженным местным реакциям вплоть до массивного некроза тканей [46]. Раствор лакосамида можно вводить без дополнительного разведения или разведенным [25].
Основные клинико-фармацевтические характеристики лакосамида
С учетом основных свойств лакосамида (см. таблицу) препарат рекомендуется применять с осторожностью у пациентов с тяжелой почечной недостаточностью (клиренс креатинина ≤30 мл/мин), с нарушениями сердечной проводимости, сердечной недостаточностью и инфарктом миокарда в анамнезе, у пожилых людей, у которых повышен риск заболеваний сердца, а также в комбинации с препаратами, которые вызывают удлинение интервала PQ.
При лечении больных с почечной недостаточностью с легким и умеренным нарушением функции почек (клиренс креатинина >30 мл/мин) коррекция дозы не требуется. У пациентов с тяжелой почечной недостаточностью (клиренс креатинина ≤30 мл/мин) максимальная доза составляет 300 мг в сутки. Титрование дозы у этих больных рекомендуется проводить с осторожностью, так как возможно накопление метаболита, не обладающего известной фармакологической активностью. Пациентам с легким и умеренным нарушением функции печени коррекция дозы не требуется. Титровать дозу таким пациентам следует с осторожностью, учитывая, что нарушению функции печени часто сопутствует нарушение функции почек. Пожилым людям снижение дозы не требуется, необходимо учитывать возможность возрастного снижения
почечного клиренса и, как следствие, повышения концентрации лакосамида в плазме крови.
Как уже указывалось, лакосамид в любой терапевтической дозе не оказывает влияния на концентрацию ЛЕВ, КБЗ, ЛТГ, ТПМ, окскарбазепина, ФТ, ВПК, ФБ, ГБП, клоназепама и зонизамида. Сопутствующая терапия ПЭП, индуцирующими ферменты (КБЗ, ФТ, ФБ), снижала общую системную экспозицию лакосамида на 25%.
Не выявлено признаков значимого взаимодействия между лакосамидом и пероральными контрацептивами этинилэстрадиолом и левоноргестрелом. Лакосамид не оказывает влияния на концентрацию прогестерона.
Таким образом, лакосамид является препаратом с новым механизмом действия, экспериментальные исследования которого предполагают его эффективность в лечении эпилептических припадков с фокальным началом, наиболее трудно курабельных мезиальных височных эпилепсий и эпилептического статуса. Доказательные и постмаркетинговые исследования на когорте людей показали оправданность этих ожиданий. Препарат эффективен в качестве дополнительного в лечении резистентных к другим препаратам эпилепсий со снижением частоты припадков на 26—40% в плацебо-контролируемых исследованиях и на 14—47% в постмаркетинговых исследованиях, с числом респондеров 32,7—41,2% [25]. Препарат хорошо переносится и имеет приемлемый профиль побочных эффектов. Незначительное фармакокинетическое взаимодействие делает его удобным в условиях дополнительной терапии противоэпилептическими и другими препаратами [13, 25, 30]. Оценивая перспективы его применения, есть основания предполагать его благоприятное влияние на настроение у пациентов (что следует из экспериментальных исследований и положительного действия на качество жизни больных). Подавление им эпилептических
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |
77 |

ОБЗОРЫ
разрядов в эксперименте [35] дает надежду на то, что характерная для традиционных блокаторов Na+-каналов аггравация эпилептической активности у части пациентов не будет существенно выражена у лакосамида, что может значительно расширить возможности его применения. Показанная в экспериментах способность лакосамида препятствовать развитию экспериментальной эпилепсии и нейропротекторные свойства предполагают его благоприятное влияние не только в отношении припадков, но
и в плане подавления самого эпилептогенеза. Принимая во внимание роль изменений метаболизма серина в дегенеративных процессах мозга [26], и то, что лакосамид является производным серина, а также его экспериментально показанную способность противодействовать эксайтотоксическим эффектам, рассматривается возможность его применения у пожилых пациентов с эпилепсией [34].
Статья подготовлена при участии компании «ЮСБ Фарма».
ЛИТЕРАТУРА
1.Гехт А.Б., Мильчакова Л.Е., Чурилин Ю.Ю. и др. Эпидемиология эпи20. Errington A.C., Stöhr T., Heers C., Lees G. The Investigational Anticonvul-
лепсии в России. Журн неврол и психиат (Приложение 1) 2006; 106: 3—7.
2.Зенков Л.Р. Выбор препарата в лечении фокальных эпилепсий: место вальпроатов. Рус мед журн 2009; 17: 20: 1334—1340.
3.Andurkar S.V., Beguin C., Stables J.P., Kohn H. Synthesis and structural studies of aza analogues of functionalized amino acids: new anticonvulsant agents. J Med Chem 2001; 44: 1475—1478.
4.Barton M.E., Klein B.D., Wolf H.H., White Brock M. Pharmacological characterization of 6 Hz psychomotor seizure model of partial epilepsy. Epilep Res 2001; 47: 217—227.
5.Bauer S., Rudd David G., Mylius V. et al. Lacosamide intoxication in attempted suicide. Epilep Behav 2010; 17: 549—551.
6.Bee L.A., Dickenson A.H. Effects of lacosamide, a novel sodium channel modulator, on dorsal horn neuronal responses in a rat model of neuropathy. Neuropharmacology 2009; 57: 472—479.
7.Ben-Menachem E. Lacosamide: an investigational drug for adjunctive treatment of partial-onset seizures. Drugs Today (Barc) 2008; 44: 35—40.
8.Beydoun A., D’Souza J., Hebert D., Doty P. Lacosamide: pharmacology, mechanisms of action and pooled efficacy and safety data in partial-onset seizures. Expert Rev Neurother 2009; 9: 33—42.
9.Beyreuther B.K., Freitag J., Heers C. et al. Lacosamide: a review of preclinical properties. CNS Drug Rev 2007; 13: 21—42.
10.Biton V., Rosenfeld W.E., Whitesides J. et al. Intravenous lacosamide as replacement for oral lacosamide in patients with partial-onset seizures. Epilepsia 2008; 49: 418—424.
11.Brandt C., Heile A., Potschka H. et al. Effects of the novel antiepileptic drug lacosamide on the development of amygdala kindling in rats. Epilepsia 2006; 47: 1803—1809.
12.Cawello W., Keopeit D., Schiltmeyer B. et al. Food does not affect the pharmacokinetica of SPM 927. Epilepsia 2004; 45: Suppl 7: 307.
13.Cawello W., Nickel B., Eggert-Formella A. No Pharmacokinetic Interaction Between Lacosamide and Carbamazepine in Healthy Volunteers. J Clin Pharmacol 2010; 50: 459—471.
14.Chung S.S., Sperling M., Biton V. et al. Laсosamide: efficacy and safety as oral adjunctive treatment for partial-onset seizures. Epilepsia 2007; 48: Suppl 6: 321.
15.Chung S.S. New treatment option for partial-onset seizures: efficacy and safety of lacosamide. Ther Advanc Neurol Dis 2010; 3: 77—83.
16.Cross S.A., Curran M.P. Lacosamide: in partial-onset seizures. Drugs 2009; 69: 449—459.
17.Curia G., Biagini G., Perucca E., Avoli M. Lacosamide: a new approach to target voltage-gated sodium currents in epileptic disorders. CNS Drugs 2009; 23: 555—568.
18.de la Loge C., Cramer J., Borghs S. et al. Improvement in patient-reported outcomes in patients responding to lacosamide: pooled QOLIE-31, SSS and PGIC data from three phase II/III clinical trials. 28th International Epilepsy Congress, 29.06-02.07.09. Poster presentation 2009.
19.Duncan G.E., Kohn H. The novel antiepileptic drug lacosamide blocks behavioral and brain metabolic manifestations of seizure activity in the 6 Hz psychomotor seizure model. Epilep Res 2005; 67: 81—87.
sant Lacosamide Selectively Enhances Slow Inactivation of Voltage-Gated Sodium Channels. Mol Pharmacol 2008; 73: 157—169.
21.Fountain N.B., French J.A., Privitera M.D. Harkoseride: safety and tolerability of a new antiepileptic drug (AED) in patients with refractory partial seizures. Epilepsia 2000; 41: Suppl 7: 169—170.
22.French J., Brodie M., Hebert D. et al. Evaluation of seizure freedom and 75% responder rates with lacosamide in subjects with partial-onset seizures in phase II/III clinical trials. 28th International Epilepsy Congress, 29.0602.07.09. Poster presentation 2009.
23.Halasz P., Kalviainen R., Mazurkiewicz-Beldzinska M. et al. and SP755 Study Group. Adjunctive lacosamide for partial-onset seizures: Efficacy and safety results from a randomized controlled trial. Epilepsia 2009; 50: 443—453.
24.Hao J.X., Stohr T., Selve N. et al. A new anti-epileptic, alleviates neuropathic pain-like behaviors in rat models of spinal cord or trigeminal nerve injury. Eur J Pharmacol 2006; 553: Lacosamide 1—3: 135—140.
25.Harris J.A., Murphy J.A. Lacosamide: An adjunctive agent for partial-onset seizures and potential therapy for neuropathic pain. Ann Pharmacother 2009; 43: 1809—1817.
26.Hashimoto K., Fukushima T., Shimizu E. et al. Possible role of D-serine in the pathophysiology of Alzheimer’s disease. Prog Neuropsychopharmacol Biol Psychiat 2004; 28: 385—388.
27.Higgins G.A., Breysse N., Undzys E. et al. Comparative study of five antiepileptic drugs on a translational cognitive measure in the rat: relationship to antiepileptic property. Psychopharmacology (Berl) 2010; 207: 513—527.
28.Higgins G.A., Breysse N., Undzys E. et al. The anti-epileptic drug lacosamide (Vimpat) has anxiolytic property in rodents. Eur J Pharmacol 2009; 624: 1—9.
29.Kehne J.H., Kane J.M., Chaney S.F. et al. Preclinical characterization of MDL 27,192 as a potential broad spectrum anticonvulsant agent with neuroprotective properties. Epilep Res 1997; 27: 41—54.
30.Kellinghaus C. Lacosamide as treatment for partial epilepsy: mechanisms of action, pharmacology, effects, and safety. Ther Clin Risk Manag 2009; 5: 757—766.
31.Kellinghaus C., Berning S., Besselmann M. Intravenous lacosamide as successful treatment for nonconvulsive status epilepticus after failure of firstline therapy. Epilep Behav 2009; 14: 429—431.
32.Knake S., Hamer H.M., Rosenow F. Status epilepticus: a critical review. Epilep Behav 2009; 15: 10—14.
33.Kupferberg H. Animal models used in the screening of antiepileptic drugs. Epilepsia 2001; 42: Suppl 4: 7—12.
34.Larner A.J. Epileptic seizures in AD patients. Neuromolecular Med 2010; 12: 71—77.
35.Lees G., Stohr T., Errington A.C. Stereoselective effects of the novel anticonvulsant lacosamide against 4-AP induced epileptiform activity in rat visual cortex in vitro. Neuropharmacology; 2006: 50: 98—110.
36.Malawska B. New anticonvulsant agents. Curr Top Med Chem 2005; 5: 69—85.
37.Perucca E. What is the promise of new antiepileptic drugs in status epilepticus? Focus on brivaracetam, carisbamate, lacosamide, NS-1209, and topiramate. Epilepsia 2009; 50: Suppl 12: 49—50.
78 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |

ЛЕЧЕНИЕ ЭПИЛЕПСИИ
38.Rosenow F., Knake S. Review: Recent and future advances in the treatment of status epilepticus. Therapeutic Advances in Neurological Disorders 2008; 25: 32.
44.Stohr T., Lekieffre D., Freitag J. Lacosamide, the new anticonvulsant, effectively reduces harmaline-induced tremors in rats. Eur J Pharmacol 2008; 589: 114—116.
39.Sachdeo R., Montouris G., Beydoun A. et al. An open-label, maximum toler45. Tilz C., Resch R., Hofer T., Eggers C. Successful treatment for refractory
ated dose trial to evaluate oral SPM 927 as adjunctive therapy in patients with partial seizures. Neurology 2003; 60: Suppl 1: A433.
40.Shaibani A., Fares S., Selam J.L. et al. Lacosamide in painful diabetic neuropathy: an 18-week double-blind placebo-controlled trial. J Pain 2009; 10: 818—828.
41.Sheets P.L., Heers C., Stoehr T., Cummins T.R. Differential Block of Sensory Neuronal Voltage-Gated Sodium Channels by Lacosamide [(2R)-2- (Acetylamino)-N-benzyl-3-methoxypropanamide], Lidocaine, and Carbamazepine. J Pharmacol Exp Ther 2008; 326: 89—99.
42.Stohr T., Krause E., Selve N. Lacosamide displays potent antinociceptive effects in animal models for inflammatory pain. Eur J Pain 2006; 10: 241— 249.
convulsive status epilepticus by non-parenteral lacosamide. Epilepsia 2010;
51: 316—317.
46.Twardowschy C.A., De Paola L., Germiniani F.M.B. et al. Pearls & Oy-sters: Soft-tissue necrosis as a result of intravenous leakage of phenytoin. Neurology 2009; 73: e94—e95.
47.Wehner T., Bauer S., Hamer H.M. et al. Six months of postmarketing experience with adjunctive lacosamide in patients with pharmacoresistant focal epilepsy at a tertiary epilepsy center in Germany. Epilepsy Behav 2009; 16: 423—425.
48.White H.S., Johnson M., Wolf H.H., Kupferberg H.J. The early identification of anticonvulsant activity: role of the maximal electroshock and subcutaneous pentylenetetrazol seizure models. Ital J Neurol Sci 1995; 16: 73—77.
43.Stohr T., Kupferberg H.J., Stables J.P. et al. Lacosamide, a novel anti-con- 49. Wolff C., Errington A., Lees G., Stöhr T. The proposed mode of action of
vulsant drug, shows efficacy with a wide safety margin in rodent models for epilepsy. Epilepsy Res 2007; 74: 147—154.
lacosamide. the newly available antiepileptic drug for partial seizures. 28th International Epilepsy Congress, June 29-July 2. 2009.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2010 |
79 |
