
Журнал неврологии и психиатрии / 2008 / NEV_2008_11_12
.pdf
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
Церебролизин облегчает состояние больных с перинатальным поражением ЦНС через модуляцию аутоиммунитета и антиоксидантную защиту
Е.В. СЕРКИНА, О.А. ГРОМОВА, И.Ю. ТОРШИН, Н.Ю. CОТНИКОВА, А.А. НИКОНОВ
Cerebrolysin alleviates perinatal CNS disorders through the autoimmune modulation and antioxidant protection
E.V. SERKINA, O.A. GROMOVA, I. YU. TORSHIN, N.YU. SOTNIKOVA, A.A. NIKONOV
НИИ материнства и детства им. В.Н. Городкова, Иваново; Российский центр «Нейробиология» Института микроэлементов ЮНЕСКО; Московский государственный университет им. М.В. Ломоносова; Российский государственный медицинский университет, Москва
Исследовали действие церебролизина (0,1 мл на 1 кг массы тела, 10 инъекций через день) на ряд показателей аутоиммунитета (уровни FasL, Fas, металлотионеина-1) в группе из 20 новорожденных в возрасте 1 мес с ишемическими поражениями ЦНС и 20 здоровых детей. Применение церебролизина оказывало нормализующее действие на состояние Т-лимфоцитов (увеличение Fas, уменьшение FasL, p<0,001) и активировало антиоксидантную защиту через увеличение уровня мРНК металлотионеина-1. Установили, что нормализация аутоиммунитета способствует снятию отека и улучшению кровообращения в пораженных ишемией участках мозга.
Ключевые слова: перинатальные поражения ЦНС, апоптоз, лимфоциты, глиофибриллярный кислый белок, металотионеины, Fas, FasL.
We investigated the effects of the neuroprotective drug cerebrolysin on the autoimmune parameters (FasL, Fas and metallotionein-1) in 20 newborns with perinatal ischemic CNS damage and 20 healthy newborns. The treatment with cerebrolysin in dosage of 0,1 ml per 1 kg of body mass, 10 injections every other day, resulted in the normalization (p<0,001) of the T-lymphocyte apoptosis (the increase of Fas and decrease of FasL) and activation of antioxidant protection through the increase of metallotionein-1 expression. The normalization of the autoimmunity was found to reduce edema and improve the circulation of the brain sites affected with ischemia.
Keywords: perinatal CNS lesions, apoptosis, lymphocytes, GRAP, metallothioneins, Fas-receptor, Fas-ligand.
Известно, что между нервной, эндокринной и иммунной системами существуют множественные связи обеспечивающие физиологическую иммунорегуляцию. Нарушение их взаимодействия приводит к развитию целого ряда заболеваний [8]. Так, нарушения взаимной регуляции нервной и иммунной систем приводят к перинатальным поражениям ЦНС (ПП ЦНС) которые занимают одно из ведущих мест в структуре заболеваемости новорожденных и являются частой причиной детской инвалидности [2, 5].
Существует большое количество факторов, влияющих на возникновение перинатальных поражений ЦНС, включая неблагоприятную экологическую обстановку (в частности, ионизирующее излучение, токсические воздействия, в том числе при применении различных лекарственных веществ, загрязнение окружающей среды солями тяжелых металлов и промышленными отходами), осложнения беременности и т.д. При этом, одним из ведущих антенатальных факторов, вызывающих ПП ЦНС плода, является фетоплацентарная недостаточность [12]. Перинатальные повреждения ЦНС плода являются прямым след-
© Коллектив авторов, 2008
Zh Nevrol Psikhiatr Im SS Korsakova 2008;108:11:62—66
ствием активации ишемического каскада, который с одной стороны приводит к гибели нервных клеток путем апоптоза, а с другой — к изменениям церебрального кровотока плода [1]. Можно выделить несколько путей индукции запрограммированной гибели клетки, в конечном итоге приводящих к активации каспазы-3, ключевого эффекторного белка в каскаде апоптоза, расщеплению ядерных субстратов данным ферментом и фрагментации ДНК [10]. Один из основных путей включения апоптоза связан с так называемыми рецепторами смерти плазматической мембраны (англ. death receptors) [11].
В последние годы значительное количество работ, посвященных изучению нейронального апоптоза, было выполнено на животных [6, 17]. Исследования же, посвященные изучению апоптоза лимфоцитов у новорожденных детей с перинатальными гипоксическими поражениями ЦНС практически отсутствуют. Недостаточно изученными также остаются эндогенные факторы, направленные на ограничение и восстановление очагов поражения нервной ткани.
Целью настоящей работы было изучение нейропротекторного действия препарата церебролизин в иммунологическом аспекте с учетом состояния антиоксидантной защиты.
Церебролизин обладает нейротрофической активностью, сходной с активностью фактора роста нервов, нейро-
62 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 11, 2008 |

ИММУНОЛОГИЧЕСКИЙ АСПЕКТ ДЕЙСТВИЯ ЦЕРЕБРОЛИЗИНА
протективными свойствами, за счет антиапоптозного действия и повышения пластичности нейронов [3]. Эффективность применения церебролизина в лечении детей с минимальной мозговой дисфункцией, последствиями закрытой черепно-мозговой травмы, ночным энурезом, гипоакузией хорошо освещена в литературе. В то же время, данные о применении церебролизина в терапии новорожденных с тяжелыми перинатальными поражениями ЦНС в остром периоде заболевания отсутствуют, а об использовании его в раннем восстановительном периоде имеются лишь единич- ные публикации [25].
Изучение особенностей триггерных процессов включе- ния апоптоза, регулирующих его факторов, и влияния на них церебролизина позволит уточнить механизмы формирования ПП ЦНС у новорожденных и оптимизировать методы их лечения у новорожденных первого месяца жизни. В настоящей работе, мы исследовали влияние курса применения церебролизина на различные биомаркеры: экспрессию Fas и FasL на клеточной мембране лимфоцитов перифериче- ской крови, внутриклеточную экспрессию мРНК МТ-1, а также сывороточный уровень глиофибриллярного белка (GFAP).
Материалы и методы
Наблюдали 40 детей первого месяца жизни, 20 из которых составили группу пациентов и 20 здоровых доношенных новорожденных — контрольную группу.
Пациентами были дети с перинатальными гипок- сически-ишемическими поражениями ЦНС средней степени тяжести с оценкой по шкале Апгар на 1-й минуте жизни 6,83±0,4, на 5-й минуте — 8,0±0,26. Диагноз ставился на основании данных клинического обследования и результатов нейросонографии. Степень гипоксических поражений ЦНС оценивали согласно классификации перинатальных поражений нервной системы у новорожденных Российской ассоциации специалистов перинатальной медицины1.
Основными клиническими проявлениями патологии ЦНС были: гипертензивный синдром у 6 детей, гипертензивно-гидроцефальный синдром у 1 новорожденного, синдром угнетения — у 2 детей и внутрижелудочковые кровоизлияния 1 степени — у 1 новорожденного.
Церебролизин назначался по показаниям из рас- чета по 0,1 мл на кг/массы тела внутримышечно че- рез день, 10 инъекций на курс. Пациенты были обследованы дважды — до и после лечения препаратом церебролизин.
Получение сыворотки периферической крови. Материалом для исследования служила периферическая кровь из локтевой вены. Для исследования сывороточного содержания различных биологических продуктов кровь в количестве 1 мл отбирали в сухую центрифужную пробирку, оставляли на 10—15 мин до полного свертывания, сгусток крови осторожно обводили по стенке пробирки длинной иглой и центрифугировали при 1500 об/мин 10 мин. Отделившуюся от сгустка сыворотку аликвотами по 200 мкл разливали в пробирки типа Эппендорф и хранили до проведения исследования в холодильнике при температуре –20°С. При необходимости сыворотки хранили при –80°С и в дальнейшем использовали для оценки уровня GFAP.
1Классификация перинатальных поражений нервной системы и их последствий у детей первого года жизни. Методические рекомендации. М 2006.
Выделение мононуклеарных клеток. Кровь забирали в центрифужные пробирки, содержащие 2,7% раствор ЭДТА из расчета 3 мл крови на 1 мл раствора ЭДТА. Выделение мононуклеарных клеток из периферической крови осуществляли традиционным методом скоростного центрифугирования при 1500 об/мин в градиенте плотности фиколлурографина. Жизнеспособность мононуклеарных клеток, определяемая по окрашиванию трипановым синим, составляла не менее 95%. По данным световой микроскопии, кольцо клеток в интерфазе содержало 25—35% лимфоцитов и 60—70% макрофагов. Выход клеток в индивидуальных образцах варьировал от 0,1 до 0,25Ч106 кл/г ткани.
Проточная цитофлюориметрия. Для проточной цитометрии использовали общую фракцию мононуклеарных клеток. Количество клеток, экспрессирующих Fas и FasL, определяли с помощью моноклональных антител (мАТ) методом проточной цитофлюориметрии на приборе FACScan (Becton Dickinson, USA). В качестве флюорохромных меток использовали флюоресцеин изотиоционат (FITC) и фикоэритрин (РЕ). Фирма-производитель и клон используемых в исследовании мАТ указаны в табл. 1. Процедуру окрашивания и фиксации клеток проводили стандартным способом в соответствии с указаниями фирмы-разработчика. При проведении проточной цитометрии клетки использовали в конечной концентрации 1Ч106 кл/мл. К 50 мкл суспензии клеток в концентрации 1Ч106 кл/мл добавляли 20 мкл мАТ, меченных FITC или PE, инкубировали в темноте при комнатной температуре в течение 30 мин, затем клетки отмывали в 1 мл фосфатного буфера (PBS), содержащего 0,1% азид натрия, и фиксировали в соответствии со стандартной процедурой. Для анализа неспецифического окрашивания использовали Simultest Control (мышиные IgG1-FITC + IgG2a-PE, «Becton Dickinson», США). Для наложения оптимального окна дискриминации для лимфоцитов и моноцитов/макрофагов на точечном графике прямого и бокового светорассеяния клетки метили анти-CD45 и анти-CD14 антителами. При анализе лимфоцитарный гейт включал не менее 95—98% клеток с фенотипом CD45+CD14–. В каждом образце анализировали не менее 10 000 клеток. Анализ результатов проводили в программе LYSYS II.
Определение уровня мРНК металлонионенинов (МТ-1) методом RT-PCR. Процедуру выделения тотальной РНК из лимфоцитов проводили стандартным гуанидин-тиоцианат- фенол-хлороформным методом с использованием набора реагентов Онкоскрин (ООО «ГеноТехнология», Россия). В работе использовали следующие наборы ООО «Генотехнология» для проведения RT-PCR в реальном времени: для определения мРНК МТ-1 — Иммуноскрин-16Q, мРНК β2-микроглобулина — Онкоскрин-12Q. Полуколичественное определение экспрессии мРНК цитокинов проводили с использованием стандартных протоколов TagMan Cytokine Gene Expression Plate (I) (PE Applied Biosystems) и BIOSOURCE INTERNATIONAL. Для определения интенсивности флюоресцентного сигнала использовался прибор iCycler (BIO-RAD). В каждом образце одновременно определялся уровень экспрессии специфической мРНК МТ-1 и гена β2-микроглобулина, используемого в качестве внутреннего контроля. Затем, уровень экспрессии мРНК МТ-1 нормализовался относительно экспрессии мРНК внутреннего контроля β2-микроглобулина. Для этого рассчитывался показатель Ct по формуле: Ct=Ct (МТ-1) — Ct (β2м), где Ct (МТ-1) — цикл начала амплификации для гена МТ-1, а Ct (β2м) — цикл начала амплификации для гена β2-микрогло- булина. Для полуколичественной оценки результатов RT-PCR, уровень экспрессии мРНК МТ-1 в группе с ПП ЦНС нормализовали относительно соответствующих показателей в группе здоровых детей по стандартной формуле: RQ=2^(– Ct), где
Ct= Ct (Здоровые)– Ct (ПП ЦНС). Таким образом, все результаты представлены как n-кратные различия между соответствующими показателями группы здоровых детей и группы детей с ПП ЦНС.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 11, 2008 |
63 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
Таблица 1. Моноклональные антитела использованные в работе
Антитело |
Këîí |
Фирма-производитель |
Флюорохром |
|
|
|
|
|
|
CD95 (Fas/APO-1) |
DX2 |
CALTAG Laboratories, ÑØÀ |
PE |
|
CD45 |
ICO-46 |
НПЦ «МедБиоСпектр», Россия |
FITC |
|
CD14 |
ICO-174 |
НПЦ «МедБиоСпектр», Россия |
PE |
|
CD95L, FasL |
Alf-2.1 |
CALTAG Laboratories, ÑØÀ |
PE |
|
Мышиные IgG1 |
— |
Becton Dickinson, ÑØÀ |
FIFC |
|
Мышиные IgG2a |
— |
Becton Dickinson, ÑØÀ |
PE |
|
|
|
|||
Таблица 2. Экспрессия Fas и |
FasL лимфоцитами периферической крови и сывороточное содержание GFAP у детей |
|||
с перинатальными поражениями и здоровых |
|
|
||
|
|
|
|
|
Показатели |
Больные дети до лечения |
Больные дети после лечения |
Kонтрольная группа |
|
(n=20) |
(n=20) |
(n=20) |
||
|
||||
|
|
|
|
|
CD95+, % |
13,66±1,10 (p<0,001*) |
20,19±0,51 (p<0,001#) |
17,71±1,48 |
|
CD95L+, % |
18,3±1,25 (p<0,001*) |
11,77±0,55 (p<0,001#) |
12,02±0,80 |
|
GFAP, íã/ìë |
0,002±0,001 |
0,06±0,01 (p<0,01#) |
0 |
|
|
|
|
|
|
Примечание. * — относительно показателей группы здоровых детей; # — относительно показателей группы детей c ПП ЦНС до лечения церебролизином.
Определение содержания GFAP методом ELISA. Содержание глиофибриллярного белка (GFAP) в сыворотке крови оценивали методом ELISA на микропланшетном ридере Multiscan EX Labsystems (Финляндия) с использованием тестсистем BioVendor Laboratory Medicine, Inc, Чехия.
Статистическая обработка данных проводилась с использованием прикладных программ Statistica 6.0.
Результаты и обсуждение
Экспрессия Fas и FasL. Как видно из представленных в табл. 2 данных, в периферической крови новорожденных с перинатальными гипоксически-ишеми- ческими поражениями ЦНС уровень лимфоцитов, экспрессирующих Fas — антиген, был достоверно ниже, а содержание FasL-позитивных клеток достоверно выше, чем у детей контрольной группы (p<0,001 в обоих случаях). После лечения препаратом церебролизин у детей с ПП ЦНС анализируемые нами параметры периферической крови достоверно изменялись по сравнению с аналогичными показателями этих детей до лечения. Установлено, что после лечения препаратом церебролизин у новорожденных с ПП ЦНС в периферической крови повышалось содержание Fas-позитивных лимфоцитов на фоне снижения ими поверхностной экспрессии FasL (p<0,001 в обоих случаях). При этом оба показателя становились сопоставимыми с аналогичными параметрами новорожденных контрольной группы.
Определение содержания GFAP. Анализ сывороточ- ного содержания GFAP — основного структурного белка астроцитов, являющегося маркером повреждения нервной ткани показал, что у обследованных нами больных уровень GFAP в периферической крови практически не отличался от параметров детей контрольной группы (p>0,05, см. табл. 2). После проведенного лечения церебролизином наблюдалось достоверное повышение уровня GFAP в сыворотке кро-
ви больных детей, по сравнению с аналогичным показателем как у этих детей до лечения, так и здоровых новорожденных (p<0,01).
Оценка экспрессии мРНК МТ-1. Повреждение клеток, в частности при перенесенной гипоксии, сопровождается активацией защитных механизмов, одним из которых является внутриклеточный синтез белков металлотионеинов (МТ). Мы изучили экспрессию мРНК МТ-1 в лимфоцитах периферической крови у больных детей до и после лечения препаратом церебролизин. Как видно из представленных на рисунке данных, у детей с гипоксически-ишемическими ПП ЦНС экспрессия мРНК МТ-1 лимфоцитами периферической крови была минимальной. В то же время, сразу после курса лечения церебролизином, уровень экспрессии мРНК МТ-1 лимфоцитами у новорожденных с патологией был в несколько раз выше, чем у здоровых детей.
Экспрессия Fas, FasL и апоптоз Т-лимфоцитов. Согласно современным представлениям [4, 7, 9, 13— 16, 18—24, 26—33] апоптоз и оксидантный эффект играют важную роль в функционировании клеток нервной системы. В настоящее время, апоптоз при ишемических повреждениях мозга ишемия — реперфузия в экспериментах на моделях у крыс достаточ- но полно изучен [27]. Апоптоз, по всей видимости, играет схожую роль в развитии церебральной ишемии in vivo [19, 20]. Апоптоз, включаемый рецепторами плазматической мембраны, опосредуется специфическими взаимодействиями по типу рецептор-ли- ганд. Fas является одним из наиболее важных рецепторов инициирующих апоптоз: взаимодействие Fasлиганда с Fas-рецептором целевой клетки приводит к инициации апоптоза. Известно, что при различных поражениях мозга экспрессия системы Fas-FasL оказывается повышенной. Фетальные астроциты в культуре постоянно экспрессируют Fas и Fas-лиганд и их
64 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 11, 2008 |
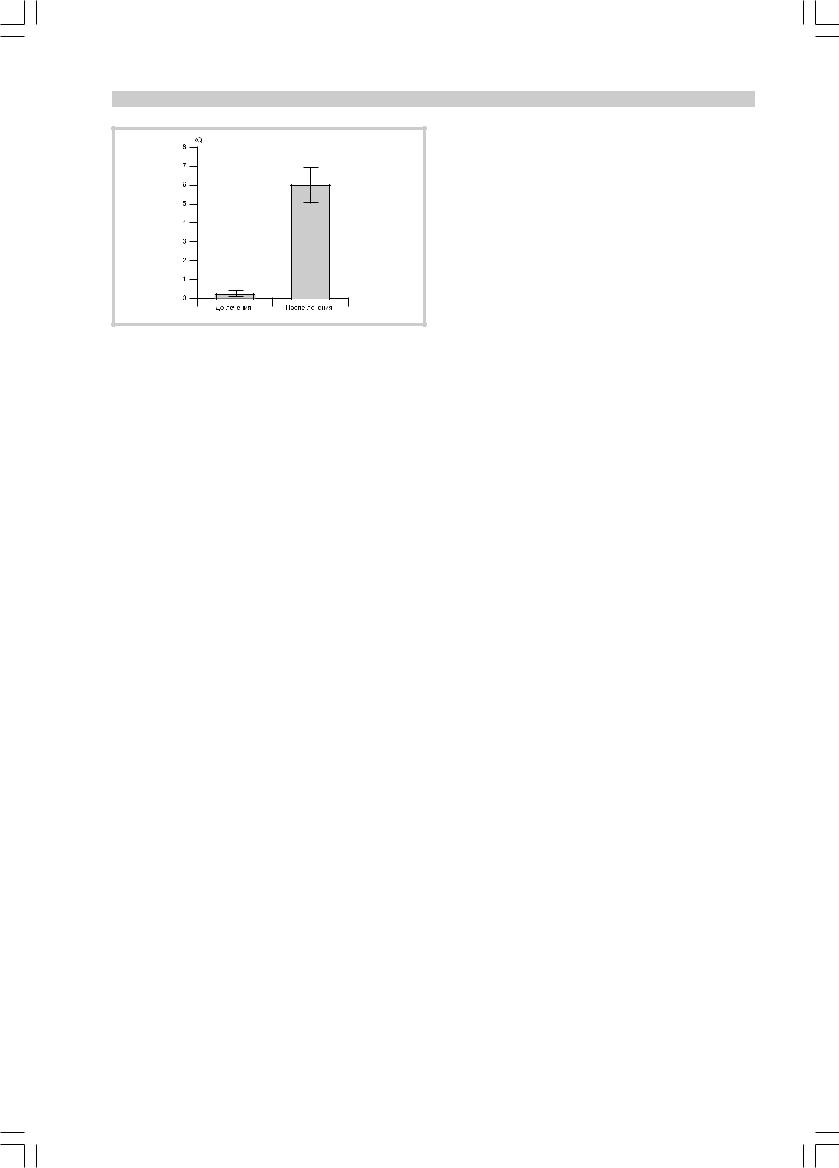
ИММУНОЛОГИЧЕСКИЙ АСПЕКТ ДЕЙСТВИЯ ЦЕРЕБРОЛИЗИНА
Уровень экспрессии мРНК МТ-1 периферическими лимфоцитами новорожденных с ПП ЦНС до и после применения церебролизина.
Уровень экспрессии мРНК МТ-1 нормализован относительно экспрессии мРНК β2-микроглобулина, результаты представлены как отношение транскрипционного уровня мРНК МТ-1 к соответствующим показателям лимфоцитов периферической крови здоровых новорожденных (RQ — cм. в тексте).
экспрессия повышается под воздействием целого ряда цитокинов — IL-1, IL-6, TNF-α или IFN-γ [6, 17]. Генетические дефекты в генах FAS и FASL приводят к аутоиммунным заболеваниям вследствие избыточ- ной пролиферации T-лимфоцитов [21, 33], а избыточная экспрессия белков Fas и FasL соответствует усиленному апоптозу T-лимфоцитов.
Мы исследовали экспрессию Fas и FasL на поверхности лимфоцитов у новорожденных с ишеми- ческими поражениями ЦНС. По сравнению с контролем, в лимфоцитах пациентов наблюдались повышенные уровни FasL и пониженные уровни Fasрецептора. Следует рассмотреть два основных последствия этих патологических изменений: влияние на пролиферацию/апоптоз лимфоцитов и влияние на апоптоз нейронов. Система Fas-FasL служит для регуляции численности колоний Т-лимфоцитов [20]. Известно, что активация лимфоцитов приводит к повышению экспрессии FasL и чем дольше активирован Т-лимфоцит, тем более чувствительным он становится к FasL-вызываемому апоптозу [15]. Таким образом, повышение FasL соответствует активации Т-лимфоцитов, а понижение уровня Fas-понижению апоптоза лимфоцитов. Оба этих фактора приводят к увеличению численности колоний активных Т-лим- фоцитов и, как следствие, к аутоиммунным эффектам у пациентов.
Лимфоциты являются одними из самых мобильных клеток организма которые взаимодействуют практически с любыми другими типами клеток и, в частности, с нейронами. Следовательно, взаимодействие лимфоцитов с повышенной экспрессией FasL будет приводить к усилению процессов апоптоза нейронов головного мозга. Мы установили, что применение церебролизина к нормализации уровней FasL и Fas. Таким образом, церебролизин способствует уменьшению апоптоза нейронов (вследствие уменьшения уровня экспрессии FasL), а также усилению апоптоза Т-лимфоцитов (увеличение экспрессии Fas-рецеп- тора) и, как следствие, уменьшению воспаления и снятию отека.
Уровни экспрессии генов металлотионеинов. В регуляции процессов апоптоза участвуют различные белки, в том числе металлотионеиновые белки (МТ). Токсичные металлы ассоциируются с окислительным стрессом и цитотоксичностью. Металлотионеины являются сборщиками токсических катионов (таких как медь, свинец или кадмий) и оказывают антивоспалительное воздействие. Металлотионеины богаты цистеиновыми сайтами, что позволяет этим белкам связывать большое количество катионов на одну молекулу белка (см. рисунок).
Индукция синтеза МТ клетками различного происхождения является универсальной реакцией на воздействие разнообразных стрессовых факторов, что в итоге приводит к защите клетки от оксидативного стресса и от запуска процесса запрограммированной клеточной гибели [32]. Антиапоптотическое действие МТ может реализовываться несколькими путями: уменьшением уровня p53 [14, 26], запуском митохондриального пути апоптоза через активацию каспазы-3 [22, 31], а также через поддержку целостности гематоэнцефалического барьера при гипоксии [30]. Следует отметить, что МТ-1 и МТ-2 активно экспрессируются в различных типах клеток, в том числе лимфоцитах и клетках нервной ткани [23, 29]. Кроме того, их уровень значительно повышен в быстро делящихся клетках, в частности в астроцитах.
Изучая экспрессию гена МТ-1 в лимфоцитах периферической крови мы установили, что у детей с ПП ЦНС уровень экспрессии мРНК МТ-1 лимфоцитами периферической крови был значительно ниже, чем у здоровых новорожденных. Таким образом, пациенты находились при большем риске оксидантных повреждений. После прохождения курса инъекций церебролизина, экспрессия мРНК МТ-1 в лимфоцитах пациентов усиливалась. Это свидетельствует о способности церебролизина оказывать нейропротективный эффект через повышенную продукцию МТ-1 клетками, что хорошо согласуется с полученными нами ранее данными [6, 7].
Уровни глиофибриллярного белка в сыворотке. Появление в крови нейроспецифических белков является маркером нарушения проницаемости гематоэнцефалического барьера [9, 13] при перинатальных гипоксически-ишемических поражениях центральной нервной системы. Повышение их концентрации в сыворотке по сравнению с базальным уровнем, как правило, отражает объем повреждения нервной ткани. Глиофибриллярный белок (GFAP) является одним из нейроспецифических белков [13, 28]. В зрелой нервной ткани иммунологическими методами GFAP обнаруживается внутри микрофиламентов протоплазматических астроцитов серого вещества [18]. Определение сывороточного содержания GFAP используется в диагностике опухолей ЦНС астроцитарного происхождения, болезни Альцгеймера, рассеянного склероза, ишемических и травматических поражений ЦНС, а также при других нервно-психических заболеваниях у взрослых и детей старшего возраста. У недоношенных детей с ПП ЦНС уровень GFAP в пуповинной крови коррелировал со степенью тяжести патологии нервной системы [9].
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 11, 2008 |
65 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
У обследованных нами новорожденных с ПП ЦНС уровень GFAP в периферической циркуляции практически не отличался от параметров детей контрольной группы (p>0,05). Однако после проведенного ле- чения препаратом церебролизин наблюдалось достоверное повышение сывороточного уровня GFAP у пациентов по сравнению со здоровыми новорожденными. При ишемических инфарктах, в зонах повреждения мозговой ткани отмечается резкое нарушение кровообращения, вследствие чего элиминация НСБ из этих участков мозга значительно затрудняется [13].
Таким образом при ПП ЦНС обострение аутоиммунных реакций (вследствие, например, неадекватного взаимодействия с иммунной системой мате-
ЛИТЕРАТУРА
1.Барашнев Ю.И. Перинатальные повреждения нервной системы у новорожденных. Руководство по безопасному материнству. M: Триада-X 1998; 373—432.
2.Барашнев Ю.И. Перинатальная неврология. M: Триада-Х 2001; 638.
3.Барашнев Ю.И. Гипоксическая энцефалопатия: гипотезы патогенеза церебральных расстройств и поиск методов лекарственной терапии. Рос вестн перинатол и педиат 2002; 1: 6—13.
4.Березин В.А., Белик Я.В. Специфические белки нервной ткани. Киев 1990; 264.
5.Володин Н.Н., Медведев М.И., Рогаткин С.О. Перинатальная энцефалопатия и ее последствия — дискуссионные вопросы семиотики и терапии. Рос педиат журн 2001; 1: 4—8.
6.Громова О.А., Сотникова Н.Ю. Нейроиммуномодулирующие свойства церебролизина. Цитокины и воспаление 2004; 3: 2: 34—39.
7.Громова О.А., Сотникова Н.Ю., Катаев С.И. и др. Протективная роль церебролизининдуцированной экспрессии генов метал- лотионеина-I и металлотионеина-II при церебральной очаговой ишемии у крыс. Цитокины и воспаление 2005; 4: 1: 42—45.
8.Крыжановский Г.Н., Магаева С.В., Макаров С.В. Нейроиммунопатология изд. Института общей патологии и патофизиологии РАМН. М 1997; 562.
9.Рогаткин С.О., Гурина О.И., Володин Н.Н. Перспективы иммунологического определения нейроспецифических белков для диагностики перинатальных поражений ЦНС у новорожденных. Педиатрия 2001; 4: 35—43.
10.Самуилов В.Д. Биохимия программируемой клеточной смерти (апоптоза) у животных. Соросовский образовательный журн 2001; 7: 10: 18—25.
11.Фильченков А.А., Степанов Ю.М., Липкин В.М., Кушлинский Н.Е.
Участие системы Fas/Fas-лиганд в регуляции гомеостаза и функционировании клеток иммунной системы. Аллергол и иммунол 2002; 3: 1: 24—35.
12.Черданцева Г.А., Севостьянова О.Ю., Ширяева Е.К. и др. Модель формирования повреждения центральной нервной системы у новорожденных детей в зависимости от клинической формы фетоплацентарной недостаточности у матери и профилактика ранней инвалидизации в младенческом возрасте. Пособие для научных работников. Екатеринбург 1999; 35.
13.Чехонин В.П., Лебедев С.В., Блинов Д.В. и др. Патогенетическая роль нарушения проницаемости гематоэнцефалического барьера для нейроспецифических белков при перинатальных ги- поксически-ишемических поражениях центральной нервной системы у новорожденных. Вопр гинекол акуш и перинатол 2004; 3: 2: 50—61.
14.Abdel-Mageed A., Agrawal K.C. Antisense down-regulation of metallothionein induces growth arrest and apoptosis in human breast carcinoma cells. Cancer Gene Ther 1997; 4: 3: 199—207.
15.Andersen M.H., Schrama D., Thor Straten P., Becker J.C. Cytotoxic T cells. J Invest Dermatol 2006; 126: 1: 32—41.
16.Berkelbach van der Sprenkel J.W., Tulleken K.A.F., Nicolay K. Dynamics of cerebral tissue injury and perfusion after hypoxia-ischemia in the rat. Stroke 1998; 29: 695—704.
ри) является одной из важных причин развития заболевания. При исследовании нейропротекторного действия церебролизина у новорожденных с перинатальными повреждениями было установлено, что применение церебролизина способствует уменьшению апоптоза нейронов (вследствие уменьшения уровня экспрессии FasL), усилению апоптоза Т-лимфоци- тов (увеличение экспрессии Fas-рецептора), усилению экспрессии металлотионенина имеющего антиоксидантный эффект. Применение этого препарата может способствовать уменьшению воспаления и снятию отека тканей головного мозга, что и подтверждается наблюдаемыми изменениями уровней глиофибриллярного белка.
17.Beyaert R., Van Loo G., Heyninck K., Vandenabeele P. Signaling to gene activation and cell death by tumor necrosis factor receptors and Fas. Int Rev Cytol 2002; 214: 225—272.
18.Bignami A., End L.F., Dahl D., Uyeda C.T. Localization of the glial fibrillary acidic protein in astrocytes by immunofluorescence. Brain Res 1972; 43: 429.
19.Chan P.H. Reactive oxygen radicals in signaling and damage in the ischemic brain. J Cereb Blood Flow Metab 2001; 21: 2—14.
20.Choi C., Benveniste E.N. Brain Res Rev 2004; 44: 65—81.
21.Fisher G.H., Rosenberg F.J., Straus S.E. et al. Dominant interfering Fas gene mutations impair apoptosis in a human autoimmune lymphoproliferative syndrome. Cell 1995; 81: 6: 935—946.
22.Kang Y.J., Li Y., Sun X. Antiapoptotic Effect and Inhibition of Ischemia/Reperfusion-Induced Myocardial Injury in Metal- lothionein-Overexpressing Transgenic Mice. Am J Pathol 2003; 163: 1579—1586.
23.Kohler L.B., Berezin V., Bock E., Penkowa M. The role metallothionein II in neuronal differentiation and survival. Brain Res 2003; 992: 1: 128—136.
24.Martin-Villalba A., Herr I., Jeremias I. et al. CD95 ligand (Fas-L/ APO-1L) and tumor necrosis factor-related apoptosis-inducing ligand mediate ischemia-induced apoptosis in neurons. J Neurosci 1999; 19: 10: 3809—3817.
25.Noshita N., Sugawara T., Hayashi T. et al. Copper/zinc superoxide dismutase attenuates neuronal cell death by preventing extracellular signal-regulated kinase activation after transient focal cerebral ischemia in mice. J Neurosci 2002; 22: 7923—7930.
26.Rongxian J., Chow V.T.-K., Tan P.-H. et al. Metallothionein 2A expression is associated with cell proliferation in breast cancer. Carcinogenesis 2002; 23: 1: 81—86.
27.Sullivan J.M., DeGracia D.J., O’Neil B.J. et al. Brain ischemia and reperfusion: molecular mechanisms of neuronal injury. J Neurol Sci 2000; 179: 1—33.
28.Uchida N., He D., Reitsma R. et al. J Neurosci 1999; 25: 1767.
29.Vandeghinste N., Proost P., De Ley M. Metallothionein isoform gene expression in zinc treated human peripheral blood lymphocytes.Cell Mol Biol 2000; 46: 419—433.
30.van Lookeren Campagne M., Thibodeaux H., van Bruggen N. et al.
Evidence for a protective role of metallothionein-1 in focal cerebral ischemia. Proc Natl Acad Sci USA 1999; 96: 22: 12870—12875.
31.Wang G.-W., Zhou Z., Klein J.B., Kang Y.J. Inhibition of hypoxia/ reoxygenation-induced apoptosis in metallothionein-overexpressing cardiomyocytes. Am J Physiol Heart Circ Physiol 2001; 280: 2292— 2299.
32.West A.K., Chuah M.I., Vickers J.C., Chung R.S. Protective role of metallothioneins in the injured mammalian brain. Rev Neurosci 2004; 15: 3: 157—166.
33.Wu J., Wilson J., He J. et al. Fas ligand mutation in a patient with systemic lupus erythematosus and lymphoproliferative disease. J Clin Invest 1996; 98: 5: 1107—1113.
66 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 11, 2008 |
