
- •Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
- •Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
- •Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
- •Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
- •Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
- •Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
- •Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
- •Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
- •Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
- •Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
- •Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
- •Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
- •Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
- •Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
- •Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
Вариант № 13
1. Вычислите двумя способами (с использованием стандартных энтальпий образования и стандартных энтальпий сгорания веществ)
∆Н0 гидрирования бензола(ж) до циклогексана(ж).
Данные для расчётов:
|
Вещество |
∆Н0обр., кДж/моль |
∆Н0сгор., кДж/моль |
|
бензол(ж) |
+49 |
-3268 |
|
H2(г) |
- |
-286 |
|
циклогексан(ж) |
-156 |
-3920 |
2. Может ли идти самопроизвольно (без внешних воздействий) процесс образования глюкозы из воды и углекислого газа при 250С? Ответ обоснуйте, используя следующие термодинамические данные:
|
Вещество |
∆G0, кДж/моль |
|
CO2 |
-394.4 |
|
H2O |
-238 |
|
C6H12O6 |
-910 |
3. Для некоторой реакции при 2270С ∆Н0 = -50 кДж/моль,
∆S0 = +100 Дж/моль • К. Вычислите константу равновесия реакции при указанной температуре.
Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
Вариант № 14
1. Вычислите ∆Н0 реакции:
C2H5OH(ж) + 3О2(г) → 2СО2(г) + 3Н2О(ж).
Проделайте то же самое для реакции:
C6H12O6(тв) + 6О2(г) → 6СО2(г) + 6Н2О(ж).
Сопоставьте удельные теплоты сгорания (в кДж/г) этанола и глюкозы. На основании этого расчёта укажите, что является лучшим источником
энергии – водка или конфета?
(Допустим, что водка содержит 40 массов. % этанола, а конфеты – 100 массов. % глюкозы).
Данные для расчётов:
|
Вещество |
∆Н0обр., кДж/моль |
|
C2H5ОН |
-277,63 |
|
СO2 |
-393,51 |
|
C6H12О6 |
-1260 |
|
H2O |
-285,84 |
2. Вычислите стандартную энтропию реакции:
C2H4(г) + Н2О(ж) ↔ C2H5ОН(ж).
Сделайте вывод о самопроизвольном протекании этой реакции. Для каких термодинамических систем можно использовать ∆S0 реакции, как критерий самопроизвольного протекания?
Данные для расчётов:
|
Вещество |
S0, Дж/моль • К |
|
C2H4(г) |
220 |
|
H2O(ж) |
70 |
|
C2H5ОН(ж) |
161 |
3. Рассчитайте величину ∆Н0 из констант равновесия, полученных
при 2-х температурах. Найдено, что константа равновесия ферментативного превращения:
L – аспартат – ↔ фумарат2- + NH4+
при 390С равна 1,60 • 10-2, а при 290С равна 0,74 • 10-2.
Контроль по теме «Элементы химической термодинамики. Определение энтальпии растворения соли» для специальности 060101 «Лечебное дело»
Вариант № 15
1. Глицерин ((CH2OH)2CHOH) образуется в организме в процессе расщепления жиров; в результате метаболизма он, в конце концов, превращается в CO2(г) и H2O(ж). Вычислите количество энергии, которое выделяется в результате полного метаболизма 10 г глицерина.
Данные для расчёта:
|
Вещество |
∆Н0обр., кДж/моль |
|
Глицерин |
-666,0 |
|
CO2 |
-393,51 |
|
H2O |
-285,84 |
2. Оцените роль энтропийного и энтальпийного факторов для реакции:
H2O2(ж) + О3(г) ↔ 2О2(г) + Н2О(ж).
Возможно ли самопроизвольное протекание этой реакции? Если да, то при каких (низких, высоких, любых) температурах?
Данные для расчётов:
|
Вещество |
∆Н0обр., кДж/моль |
S0, Дж/моль • К |
|
O2(г) |
- |
205 |
|
H2O2(ж) |
-188 |
110 |
|
О3(г) |
142 |
238 |
|
Н2О(ж) |
-286 |
70 |
3. При 1500 К константа равновесия реакции
2СН4(г) ↔ С2Н2(г) + 3Н2(г)
[∆Н0 = 376,5 кДж/моль] равна 1,5. Рассчитайте константу равновесия
при 1700 К.
Ответы к заданиям по темам «Элементы химической термодинамики. Определение энтальпии растворения соли»
|
Вопрос
Вариант |
1 |
2 |
3 |
|
1 |
∆Н0 = -1379,6 кДж/моль |
∆S0 = 7,12 кДж/моль • К, → |
∆ |
|
2 |
∆Н = -182,37 кДж |
∆G0 = -3,749 кДж/моль |
∆H = 60,84 кДж |
|
3 |
∆Н = -182 кДж, ∆S > 0 |
∆G0 < 0 при любых t0С |
∆G0 = 17,095 кДж/моль, эндэргонический процесс |
|
4 |
∆Н0 = -555 кДж/моль |
∆G0 = -61,97 ккал/моль |
Ка = 1,74 • 10-4 |
|
5 |
∆Н0 = -250,5 кДж/моль |
∆G0 = 3,58 ккал/моль |
К2 = 4,57 • 10-14 |
|
6 |
∆Н = -19,1 кДж |
∆G0 = 2884,4 кДж/моль |
а) ∆G = -23,80, → б) ∆G = -12,40, → |
|
7 |
∆Н = -1406,5 кДж |
∆G0 = -746,14 ккал/моль |
∆S0 = -19 Дж/моль • К |
|
8 |
∆Н01 = -626,93 кДж/моль ∆Н02 = -626,1 кДж/моль |
∆G0 < 0 при низких t |
∆G0 = 10,72 кДж/моль |
|
9 |
∆Н = -14,125 кДж |
∆G0 = -817,97 кДж/моль |
Ка = 1,74 • 10-5 |
|
10 |
∆Н = -19,1 кДж |
∆G0 = -38,33 кДж/моль, экзэргонический процесс |
∆Н0 = 64,06 (кДж/моль) ∆G0 = 12,30 (кДж/моль) ∆S0 = 170 Дж/моль • К |
|
11 |
∆Н0(а) = -4041,97 кДж/моль ∆Н0(б) = -1777,52 кДж/моль ∆Н0(в) = -2264,45 кДж/моль |
∆G0 = 1737,22 кДж/моль |
∆G = 0, ↔ |
|
12 |
∆Н = 14,125 кДж/моль |
∆G0 = -38,33 кДж/моль, экзэргонический процесс |
∆Н0 = -51,25 кДж/моль |
|
13 |
∆Н0обр. = -205 кДж/моль ∆Н0сгор. = -206 кДж/моль |
∆G0 = 2884,4 кДж/моль |
Кравн. = 2,88 • 1010 |
|
14 |
∆Нуд.: -11,89 кДж/г (спирт), -15,65 кДж/г (глюкоза) |
∆S0 = -129 Дж/моль • К |
∆Н = 65,02 кДж/моль |
|
15 |
∆Н = -182,37 кДж |
∆G0 < при любых t0С |
Кравн. = 52,5 |

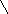 G
= 22,70 кДж, →
G
= 22,70 кДж, →