
- •Тема 1. Строение атома. Периодическая система. Химическая связь и строение вещества. Комплексные соединения
- •Тема 2. Основные типы химических равновесий и процессов в функционировании живых систем.
- •Тема 3. Элементы химической термодинамики, термодинамики растворов и химической кинетики
- •Тема 4. Сильные и слабые электролиты. Коллигативные свойства растворов.
- •Тема 5. Поверхностные явления.
- •Тема 6. Адсорбция на подвижной границе раздела фаз.
- •Тема 7. Адсорбция на неподвижной поверхности раздела фаз.
- •Тема 8. Применение адсорбентов в медицине, биологии и экологии
- •Тема 9. Классификация и методы получения дисперсных систем.
- •Тема 10. Свойства дисперсных систем.
- •Тема 11. Строение коллоидных частиц
- •Тема 12. Устойчивость дисперсных систем
- •Тема 13. Методы физико-химического анализа.
Тема 2. Основные типы химических равновесий и процессов в функционировании живых систем.
001. Изолированное гетерогенное равновесие характеризует
+а) процесс в насыщенном растворе малорастворимого вещества
б) процесс образования осадка
в) процесс растворения осадка
002. Термодинамической характеристикой гетерогенного равновесия является
а) Кн – константа нестойкости
+б) Ks – константа растворимости
в) φºох/red – стандартный редокс-потенциал
003. Возникновение условий для образования в крови малорастворимого СаС2О4 обусловлено соотношением
+а) ![]()
б) ![]()
в)![]()
004. Насыщенный раствор малорастворимого СаСО3 (Ks =3,8∙10–9) смешали с раствором BaCl2, что приведёт к
+а) растворению осадка СаСО3 и образованию осадка ВаСО3(Ks =4∙10–10)
б) выпадению осадка ВаСО3 без растворения СаСО3
в) отсутствию изменений в системе
005. К раствору, содержащему сульфит– и оксалат– ионы в равных концентрациях, добавляют по каплям раствор нитрата кальция. Первым выпадает осадок
а) СаSО3 (Ks =3,2∙10–7)
+б) СаС2О4 (Ks =2,3∙10–9)
в) образование осадков происходит одновременно
006. К раствору, содержащему ионы Са2+ и Sr2+ в равных концентрациях, добавляют по каплям раствор Na2SO4. В первую очередь образуется осадок
+а) SrSO4 (Ks =3,2∙10–7)
б) CaSO4 (Ks =2.5∙10–5)
в) образование осадков происходит одновременно
007. Добавление соляной кислоты к осадку BaSO4
а) приводит к его растворению
+) не приводит к его растворению
в) приводит к его растворению с последующим выпадением в осадок BaCl2
008. Добавление соляной кислоты к осадку СаСО3
+а) приводит к его растворению
б) не приводит к его растворению
в) приводит к его растворению с последующим выпадением в осадок СаCl2
009. «Стронциевый рахит» (болезнь Итай-Итай) – повышенная ломкость костей – возникает в результате
а) токсического действия стронция
+б) изоморфизма
в) снижения концентрации ионов кальция
010. Из перечисленных веществ: NH3, CH3COOH, HCl, KOH, NaH2PO4, NaCl, K2SO4, K2HPO4 – можно приготовить буферные системы
+а) аммонийную, фосфатную, ацетатную
б) фосфатную
в) фосфатную, ацетатную
011. Зона буферного действия гидрокарбонатной буферной системы (рКа = 6,37) составляет
а) 6,37
б) 6,37 – 7,37
+в) 5,37 – 7,37
012. Величину рН раствора необходимо поддерживать ≈ 6,9. Из буферных систем для этого можно использовать
а) ацетатную (рКа = 4,76)
+б) фосфатную (рКа = 7,21)
в) аммонийную (рКа = 9,24)
013. Для приготовления первого буферного раствора взяли 10 мл раствора с С(СН3СООН) = 0,1 моль/л и 20 мл раствора с С (СН3СООNa) = 0,05 моль/л. Для приготовления второго буферного раствора взяли 3 мл кислоты той же концентрации и 10 мл соли той же концентрации. Буферная ёмкость выше
+а) для первого буферного раствора
б) для второго буферного раствора
в) обоих растворов одинакова
014. Добавление раствора соляной кислоты к ацетатной буферной системе приведёт к
а) сильному понижению рН
+б) незначительному понижению рН
в) рН буфера не меняется
015. Ацетатная буферная система получена смешиванием 1 моль кислоты с 1 моль её натриевой соли. рКа (СН3СООН) = 4,76. рН буфера при добавлении 0,5 моль NaOH составил
а) 4,76
б) 4,28
+в) 5,24
016. В состав буферной системы входит
+а) слабый протолит и избыток сопряжённого с ним основания или кислоты
б) сильный протолит и его соль со слабым основанием или кислотой
в) слабый протолит и сопряжённое с ним основание или кислота
017. Наиболее эффективной буферной системой плазмы является
+а) бикарбонатный, так как количество СО2 в крови регулируется лёгкими, а концентрация НСО3– – почками
б) белковый из-за большой концентрации компонентов буфера
в) фосфатный, так как компонентами буфера являются разные анионы одной кислоты
018. Роль комплексообразователя в комплексных соединениях выполняет
+а) катион
б) анион
в) и катион, и анион
019. Роль лигандов в комплексных соединениях выполняют
а) катионы
б) анионы
+в) онионы и полярные молекулы
020. Дано изолированное лигандообменное равновесие
[Fe(CN)6]3– ↔ Fe3+ + 6CN– Прочность комплексного соединения характеризуется Кн, выражение для которой
+а) ![]()
б) ![]()
в) ![]()
021. Фермент карбоксипептидаза (КПА-Zn) имеет Кн ≈ 10–11. Попадание в организм ионов Hg2+ вызывает
а) повышение прочности фермента
б) повышение прочности фермента с одновременным образованием КПА-Hg
+в) разрушение КПА-Zn и образование КПА-Hg (Кн ≈ 10–21)
022. При одинаковых условиях лиганд ЭДТА (трилон Б) полнее связывает
а) Mg2+, так как Кн(MgT2–) = 7,6∙10–10
+б) Са2+, так как Кн(СаТ2–) = 2,6∙10–11
в) оба комплекса непрочные и легко разрушаются
023. Действие препарата «Унитиол», используемого для выведения Hg2+ из организма, основано на
а) образовании менее прочного комплекса, чем комплекс Hg2+ с биолигандом
б) образовании более прочного комплекса, чем комплекс Hg2+ с биолигандом
в) выпадении Hg2+ в осадок
024. Токсическое действие СО (угарный газ) основано на
+а) связывании Fe2+ Hb в более прочный комплекс, чем предусмотренный природой
б) окислительно-восстановительной реакции 4СО + СО2 → 5С + 3О2↑
в) взаимодействием СО с СО2 с образованием СО2
025. NO3– ионы не окисляют Fe(II) в растворе с рН=7, но окисляют в растворе с рН=1. Причина этого – соотношение потенциалов
+а) 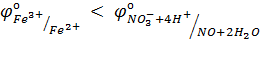
б) ![]()
в) 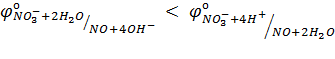
026. Уравнение происходящей реакции
MnO4– + 5Fe2+ + 8H+ → Mn2+ + 5Fe3+ + 4H2O Укажите сопряжённую окислительно-восстановительную пару, выполняющую роль окислителя
а) Mn2+ / MnO4–
+б) MnO4– / Mn2+
в) Fe3+ / Fe2+
027. Биолиганд образует прочный комплекс с восстановителем сопряжённой окислительно-восстановительной пары. Окислительно-восстановительный потенциал пары
а) понижается
б) остаётся неизменным
+в) повышается
028. Биолиганд образует прочный комплекс с окислителем сопряжённой окислительно-восстановительный потенциал пары
+а) понижается
б) повышается
в) остаётся неизменным
029. Расчёт потенциала сопряжённой окислительно-восстановительной пары MnO4– / Mn2+ проводится по уравнению
а) ![]()
б) ![]()
в) ![]()
030. Даны стандартные потенциалы двух сопряжённых окислительно-восстановительных пар: Cr2O72– / 2Cr3+ (φº=1,36В) и Fe3+ / Fe2+ (φº=0,77В). Направление окислительно-восстановительной реакции
+а) Cr2O72– + Fe2+ → 2Cr3+ +Fe3+
б) 2Cr3+ +Fe3+ → Cr2O72– + Fe2+
в) Cr2O72– + Fe3+ → 2Cr3+ +Fe2+
