
- •Тема 3. Альдегиды и кетоны 36
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование
- •Пропен пропан
- •2. Галогенирование
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •Заместители 2 рода ( -cooh, -so3h, -cho, -no2 и др.) – электроноакцепторы, уменьшают электронную плотность в кольце, затрудняют реакцию se и ориентируют электрофил в мета-положение.
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Химические свойства
- •Глоссарий
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •1. Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Глоссарий
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Содержание этапов занятия
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Высшие жирные кислоты (вжк)
- •Изомерия
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •Химические свойства
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Фосфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Глоссарий
Двухосновные карбоновые кислоты
|
Формула |
Тривиальное название |
ИЮПАК название |
|
НООС–СООН |
щавелевая (оксалат, оксалил) |
этандиовая |
|
НООС–СН2–СООН |
малоновая (малонат, малонил) |
пропандиовая |
|
НООС–СН2–СН2–СООН |
янтарная (сукцинат, сукцинил) |
бутандиовая |
|
НООС–(СН2)3–СООН |
глутаровая (глутарат, глутарил) |
пентандиовая |
Трехосновные кислоты
СООН
Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
(цитрат, цитрил) пентандиовая
ОН
Химические свойства.
Для многоосновных кислот характерны общие свойства карбоновых кислот, обусловленные наличием функциональной группы – СООН, и специфические – как следствие взаимного влияния карбоксильных групп.
О![]() бщие
свойства проявляются в способности
образовывать неполные и полные
функциональные производные – соли
(кислые и средние), эфиры (полные и
неполные) и т.д. Они отличаются физическими
свойствами. Так, кислая калиевая соль
щавелевой кислоты нерастворима, а
средняя – хорошо растворима в воде.
бщие
свойства проявляются в способности
образовывать неполные и полные
функциональные производные – соли
(кислые и средние), эфиры (полные и
неполные) и т.д. Они отличаются физическими
свойствами. Так, кислая калиевая соль
щавелевой кислоты нерастворима, а
средняя – хорошо растворима в воде.
![]()
кислая соль, средняя соль,
гидрооксалат калия оксалат калия
![]()
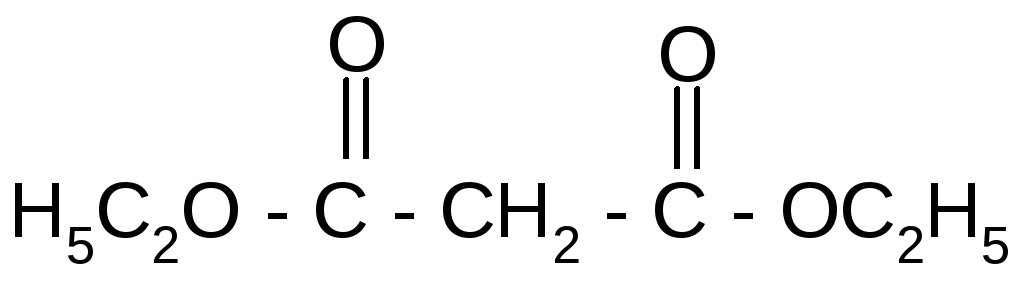
неполный этиловый полный диэтиловый эфир
эфир малоновой кис- малоновой кислоты, ди-
лоты, моноэтилмалонат этилмалонат
К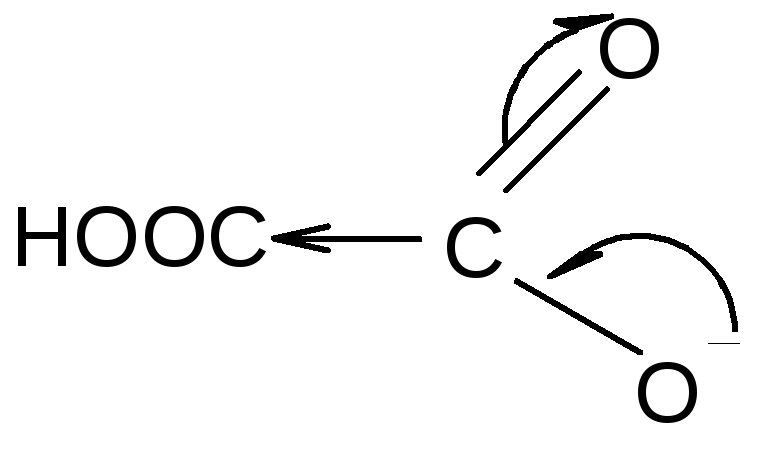 ислотные
свойства многоосновных карбоновых
кислот выражены сильнее по сравнению
с монокарбоновыми. Особенно это заметно
у первых членов гомологического ряда.
Высокая кислотность объясняется
электроноакцепторным действием второй
карбоксильной группы, которую можно
рассматривать как радикал по отношению
к первой, что способствует делокализации
отрицательного заряда в анионе,
образовавшемся после отрыва протона
на первой ступени диссоциации.
ислотные
свойства многоосновных карбоновых
кислот выражены сильнее по сравнению
с монокарбоновыми. Особенно это заметно
у первых членов гомологического ряда.
Высокая кислотность объясняется
электроноакцепторным действием второй
карбоксильной группы, которую можно
рассматривать как радикал по отношению
к первой, что способствует делокализации
отрицательного заряда в анионе,
образовавшемся после отрыва протона
на первой ступени диссоциации.
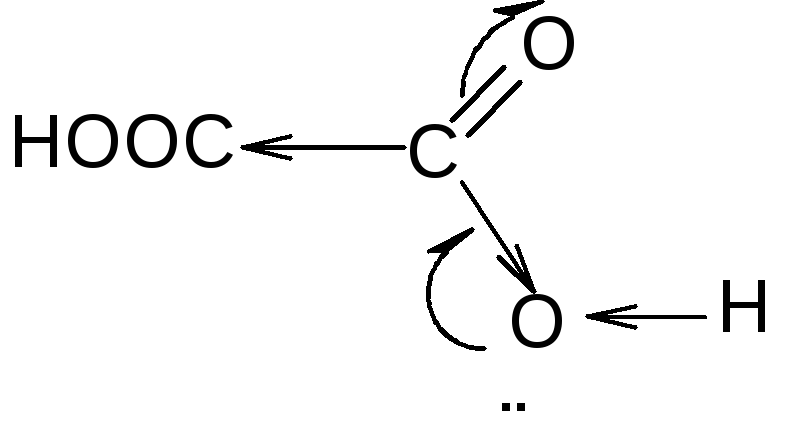
 + Н+
+ Н+

рКа 1,27
Специфические реакции двухосновных кислот
1. Способность к декарбоксилированиюпри нагревании первых гомологов – щавелевой и малоновой кислот:
t0
Н ООССООНН–СООН + СО2
t°
Н ООССН2СООНСН3–СООН + СО2
Декарбоксилирование двух и трехосновных кислот характерно для многих биохимических процессов.
2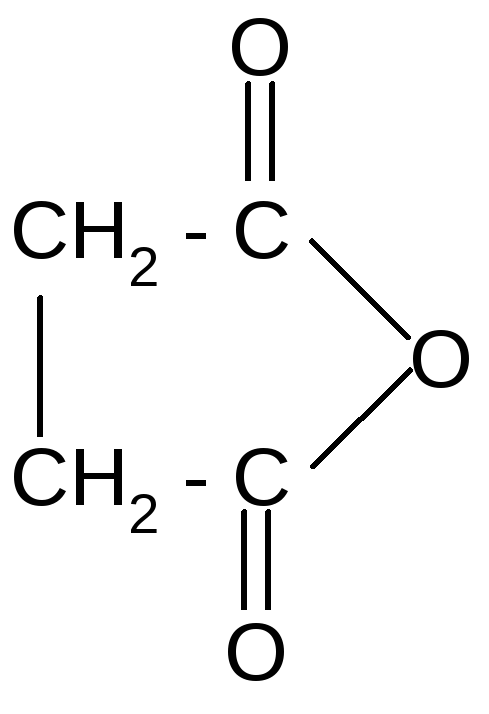 .
Образование
циклических ангидридов.
С увеличением длины цепи взаимное
влияние карбоксильных групп ослабевает,
и при нагревании янтарной и глутаровой
кислот происходит отщепление воды и
образуются циклические ангидриды. Это
обусловлено образованием устойчивого
5- или 6–членного цикла.
.
Образование
циклических ангидридов.
С увеличением длины цепи взаимное
влияние карбоксильных групп ослабевает,
и при нагревании янтарной и глутаровой
кислот происходит отщепление воды и
образуются циклические ангидриды. Это
обусловлено образованием устойчивого
5- или 6–членного цикла.
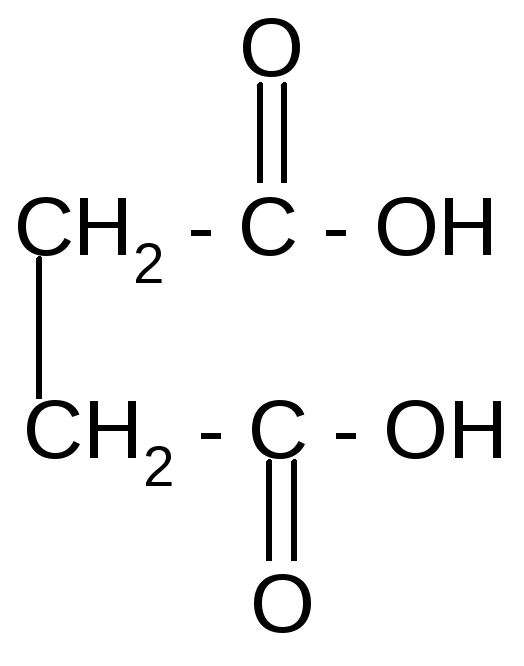
t° + Н2О

янтарная кислота янтарный
ангидрид
При дальнейшем увеличении длины цепи взаимное влияние карбоксильных групп прекращается.
3. С–Н – кислотность в малоновой кислоте.
В малоновой кислоте водородные атомы метиленовой группы –СН2– очень подвижны:
НООССН2СООН
В эфирах малоновой кислоты они легко замещаются атомами щелочных металлов действием, например, натрия или алкоголята натрия с образованием натрий – малонового эфира:



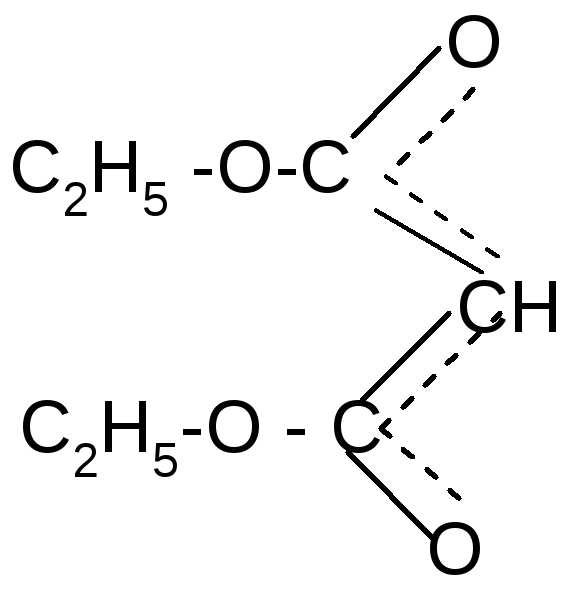 -
-
 +NaORNa+
+NaORNa+
-ROH
С помощью натрий-малонового эфира можно синтезировать одно- и многоосновные кислоты.
Например:


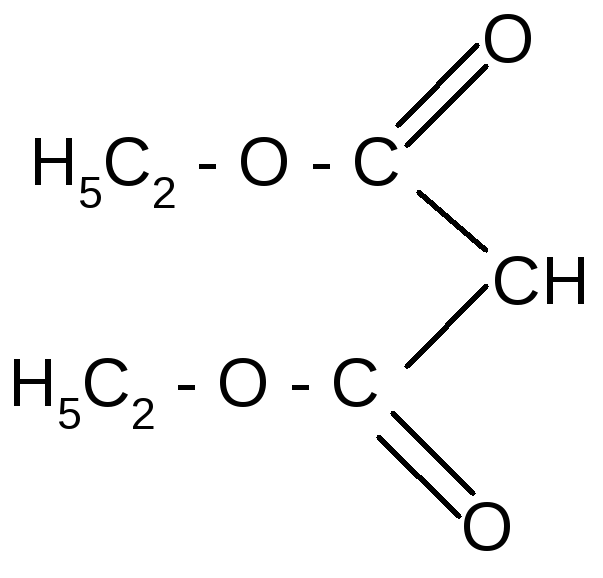
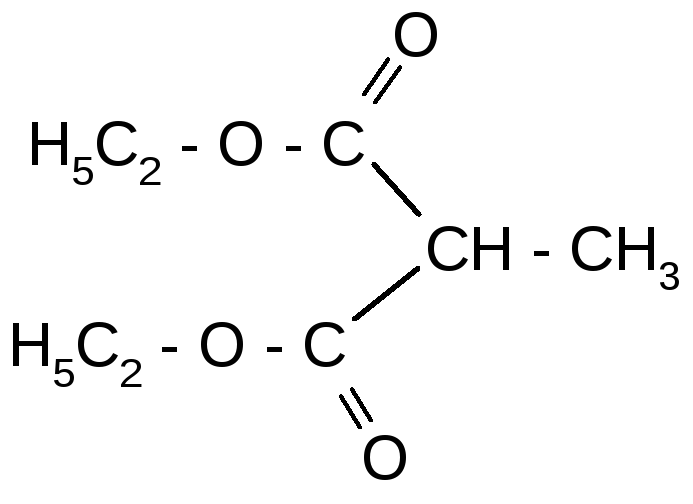
CH3I

 -
-
Na+ -NaI гидролиз

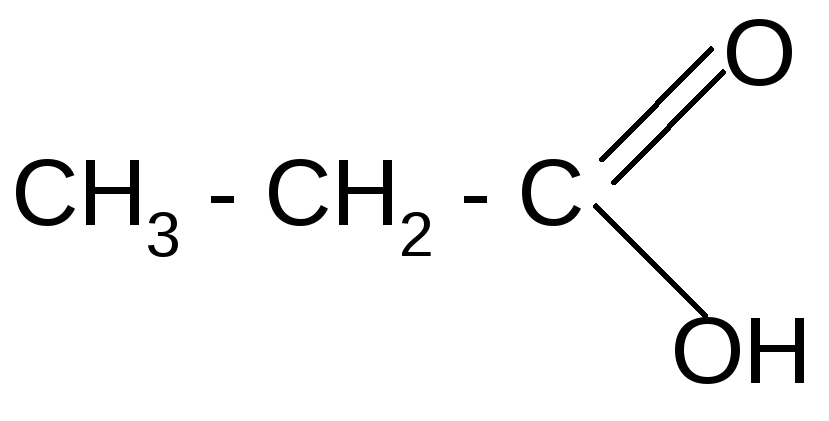
Н2О/Н+t° + СО2


- 2 С2Н5ОН декарбокси- пропановая
лирование кислота
метилмалоновая
кислота
Глоссарий
А![]() цилирование– введение ацильной группы в молекулу.
цилирование– введение ацильной группы в молекулу.
А![]() цетилирование– введение ацетильной группы
в молекулу.
цетилирование– введение ацетильной группы
в молекулу.
Гидролиз – это расщепление связи при участии молекулы воды.
Эйкозаноиды – кислородсодержащие производные эйкозаполиеновых кислот, то есть неразветвленных карбоновых кислот кислот С20с двумя и более двойными связями, разделенными метиленовой группой
Простаноиды (простангландины, простациклины, тромбоксаны) и лейкотриены – группы эйкозаноидов, обладающие высокой биологической активностью и широким спектром действия.
Реакция этерификации – взаимодействие карбоновых кислот со спиртами, приводящее к образованию сложных эфиров.
АмидыR-CONH2– это функциональные производные карбоновых кислот, в карбоксильной группе которых гидроксил заменен на аминогруппу.
Сложные эфирыR’-COOR– это функциональные производные карбоновых кислот, в карбоксильной группе которых гидроксил заменен остатком спирта или фенола (-OR).
Ангидриды карбоновых кислот(R-CO)2O– продукты отщепления воды от двух молекул кислоты.
Галогенангидриды карбоновых кислотR-COHal– это функциональные производные карбоновых кислот, в карбоксильной группе которых гидроксил заменен на галоген (Hal)
