
- •Тема 3. Альдегиды и кетоны 36
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование
- •Пропен пропан
- •2. Галогенирование
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •Заместители 2 рода ( -cooh, -so3h, -cho, -no2 и др.) – электроноакцепторы, уменьшают электронную плотность в кольце, затрудняют реакцию se и ориентируют электрофил в мета-положение.
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Химические свойства
- •Глоссарий
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •1. Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Глоссарий
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Содержание этапов занятия
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Высшие жирные кислоты (вжк)
- •Изомерия
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •Химические свойства
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Фосфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Глоссарий
Химические свойства
Кислотность тиоспиртов выше, чем у спиртов, поэтому они в отличие от последних образуют соли не только со свободными металлами, но и со щелочами; соли их гидролизуются водой.
СH3-CH2-SH
+ KOH ![]() CH3-CH2-SK
+ H2O
CH3-CH2-SK
+ H2O
этилмеркаптан этилмеркаптид
калия
С тяжелыми металлами (ртуть, мышьяк, свинец, кадмий, цинк) и их окислами тиолы образуют нерастворимые соли – меркаптиды
2 СН3-СН2-SH
+ HgO (CH3-CH2-S)2Hg
СН3-СН2-SH
+ HgO (CH3-CH2-S)2Hg
-H2Oэтилмеркаптид ртути
Способность тиолов связывать ионы тяжелых металлов позволяет использовать их как противоядия (антидоты) при отравлениях соединениями этих металлов. Одним из таких препаратов является отечественный препарат унитиол (димеркаптопропансульфонат натрия):

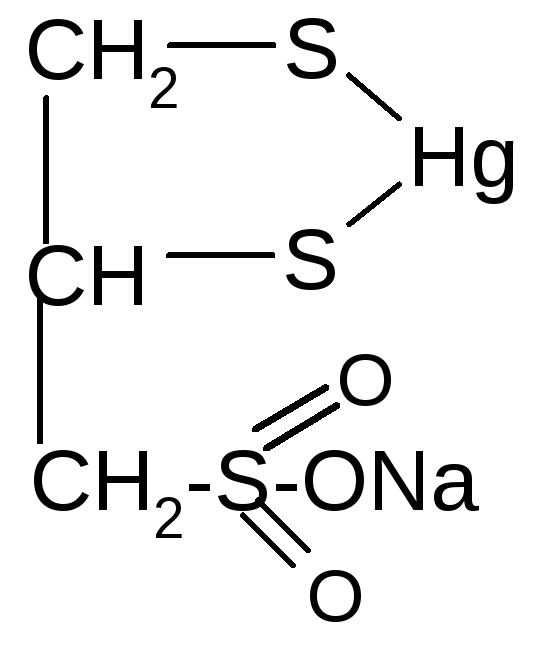
 +HgCl2+ 2HCl
+HgCl2+ 2HCl
Меркаптаны в отличие от спиртов окисляются даже на воздухе с образованием диалкилдисульфида:
O
H 3C-CH2-SH
+ CH3-CH2-SH
CH3-CH2-S-S-CH2-CH3
+ H2O
3C-CH2-SH
+ CH3-CH2-SH
CH3-CH2-S-S-CH2-CH3
+ H2O
диэтилдисульфид
Дисульфиды легко восстанавливаются в тиолы. Процесс окисления тиолов и восстановления дисульфидов играет важную роль в химии белков и пептидов. При жестком окислении тиолов (азотной кислотой) образуются сульфокислоты:
O
С H3SHCH3-SO3H
H3SHCH3-SO3H
метантиол метансульфокислота
Аналогично спиртам тиолы реагируют с хлористыми ацилами, образуя тиоаналоги сложных эфиров:
![]()

 +C2H5SH+HCl
+C2H5SH+HCl
этилтиоацетат
К классу сульфидов относится боевое отравляющее вещество кожно-нарывного действия иприт (, 1-дихлордиэтилсульфид). Это бесцветная жидкость с чесночным запахом. Для дегазации иприта используется хлорная известь или хлорамин. Дегазаторы превращают иприт в сульфоксид и другие вещества. Получают иприт при действии хлористой серы на этилен:
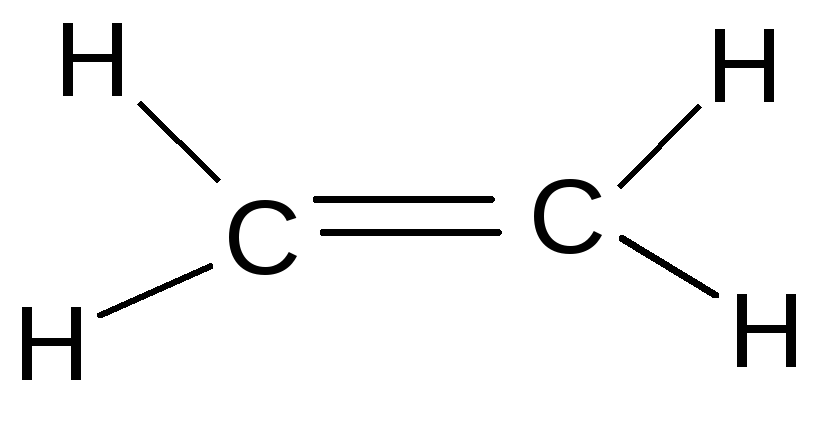
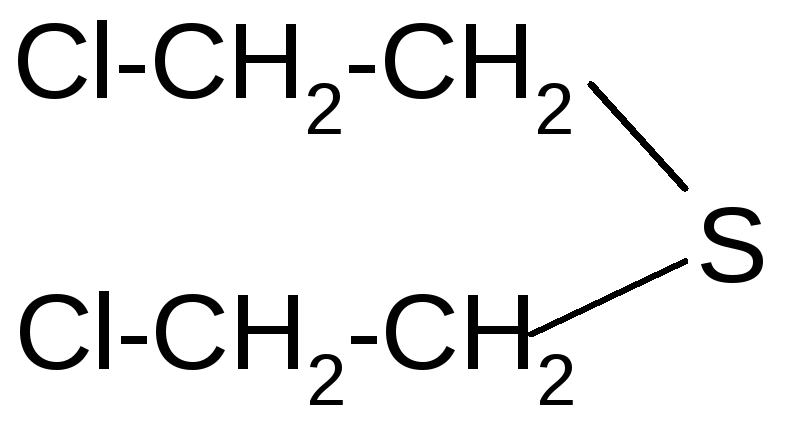
2 +S2Cl2S+
+S2Cl2S+
Глоссарий
Гидролиз- процесс расщепления молекулы с участием воды.
КислотыБренстеда– это нейтральные молекулы или йоны, способные отдавать протон (доноры протонов).
Основания Бренстеда- это нейтральные молекулы или йоны, способные присоединять протон (акцепторы протонов).
Кислоты Льюиса– это акцепторы электронной пары.
Основание Льюиса– это доноры электронной пары.
Реакции этерификации– образование сложного эфира при взаимодействии кислоты и спирта.
Комплексные соединения– это соединения, в которых есть хотя бы одна химическая связь, образованная по донорно-акцепторному механизму.
Лиганд– молекула - донор неподеленной электронной пары.
«Хелаты»- это комплексные соединения, в которых одна молекула лиганда образует с центральным атомом две химические связи, одна из которых донорно-акцепторная.
Электрофильные реагенты(электрофилы) – частицы с недостатком электронной плотности (нейтральные молекулы или катионы).
Нуклеофильные реагенты (нуклеофилы)– частицы с избытком электронной плотности (нейтральные молекулы или анионы).
Радикалы– это свободные атомы или частицы с неспаренным электроном (Cl,
HO,HOO,R,).
