
- •Методические рекомендации для студентов
- •3. Цели занятия.
- •3.2. Конкретные цели и задачи.
- •4. Вопросы, изученные на предшествующих дисциплинах и необходимые для освоения темы.
- •5. Задания для самостоятельной подготовки к лабораторному занятию:
- •7. Ориентировочная основа действия (одд) для проведения самостоятельной работы студентов в учебное время.
- •8. Задания для контроля уровня сформированности компетенций в учебное время.
- •9. Учебно-материальное обеспечение:
- •10. Материальное обеспечение:
7. Ориентировочная основа действия (одд) для проведения самостоятельной работы студентов в учебное время.
Определение молярной массы эквивалента металла проводится газометрическим методом, основанным на измерении объема выделившегося водорода в реакции металла с раствором соляной кислоты. Опыт проводится в приборе, изображенном на рис.1.
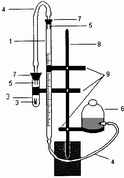
Рис. 1. Прибор для определения молярной массы эквивалента металла.
Последовательность проведения опыта:
Мерным цилиндром отмеряют 5 см3 разбавленной в отношении 1:3 соляной кислоты и осторожно выливают в большую пробирку (2).
Закрепляют пробирку (2) в штативе в положении, близком к горизонтальному.
Металл с точно известной массой помещают в небольшую пробирку с отверстиями на стенках.
Пробирку с металлом (3) помещают в пробирку с кислотой таким образом, чтобы не было контакта кислоты с металлом.
Плотно закрывают большую пробирку пробкой (7) с газоотводной трубкой (4) со стеклянным наконечником (5); газоотводную трубку опускают в измерительную бюретку (1), заполненную водой и закрепленную в штативе Бунзена (8) держателями (9).
Для проверки герметичности прибора уравнительную склянку (6) опускают вниз и в течение 1 минуты следят за уровнем воды в измерительной бюретке. Прибор считается герметичным, если после небольшого понижения уровень воды в измерительной бюретке остановится.
Если прибор герметичен, то, совместив уровни воды в измерительной бюретке и уравнительной склянке (давление внутри прибора должно быть равным атмосферному), отмечают уровень воды в измерительной бюретке (a1).
Переводят большую пробирку в вертикальное положение так, чтобы пробирка с металлом погрузилась в кислоту и началась реакция, сопровождающаяся выделением водорода и вытеснением воды из измерительной бюретки в уравнительную.
После прекращения реакции охлаждают большую пробирку и записывают уровень воды (a2) в измерительной бюретке.
Вычисляют объем выделившегося водорода: V(H2) = a1 - a2, дм3.
Регистрируют по термометру температуру (Т), по барометру давление(Р), в таблице 2 находят соответствующее значение парциального равления водяного пара (Рр).
Обработка экспериментальных данных.
Приводят объем водорода к нормальным условиям (Ро=1,013.105 Па; Т=273К):
![]() .
.
Вычисляют массу выделившегося водорода при нормальных условиях из формул:
![]() ;
;
![]() .
.
Из закона эквивалентов вычисляют молярную массу эквивалента металла:
![]()
![]() ,
,
отсюда
![]() ,г/моль.
,г/моль.
Рассчитывают теоретическое значение молярной массы эквивалента металла, исходя из молярной массы атома металла и его валентности:
![]() .
.
5. Сравнивают теоретическое и экспериментальное значение молярной массы эквивалента металла и вычисляют погрешность опыта.
8. Задания для контроля уровня сформированности компетенций в учебное время.
1. Вычислите массу фосфорной кислоты, необходимой для получения гидрофосфата натрия, если известно, что в ходе реакции прореагировало 20 г щелочи.
2. При разложении 2,88 г йодида двухвалентного металла масса выделившегося металла составила 0,88 г. Установите формулу йодида металла.
