
- •Методические рекомендации для студентов
- •3. Цели занятия.
- •3.2. Конкретные цели и задачи.
- •4. Вопросы, изученные на предшествующих дисциплинах и необходимые для освоения темы.
- •5. Задания для самостоятельной подготовки к лабораторному занятию:
- •7. Ориентировочная основа действия (одд) для проведения самостоятельной работы студентов в учебное время.
- •1. Определение теплоты нейтрализации.
- •2. Определение константы калориметра.
- •8. Задания для контроля сформированности компетенций в учебное время.
- •9. Учебно-материальное обеспечение:
- •10. Материальное обеспечение:
- •Приложение 1. Стандартные термодинамические величины
Государственное бюджетное образовательное учреждение
высшего профессионального образования
«Тихоокеанский государственный медицинский университет»
Министерства здравоохранения Российской Федерации
Кафедра химии
УТВЕРЖДЕНО
на заседании кафедры
протокол №___от___________20__г
Заведующий кафедрой Н.С. Иванова
_______________________________
Методические рекомендации для студентов
к лабораторным занятиям
Модуль №2 Основы теории химических процессов
учебной дисциплины Общая и неорганическая химия
для специальности 060301 «Фармация»
курс ____I___семестр _I___
Составитель: преподаватель Ситникова А.А.
Рецензент: к.х.н., доцент Задорожная А.Н.__
Владивосток – 2013 г.
1. Тема: Определение стандартной энтальпии реакции нейтрализации.
2. Мотивация: Данная тема является базой для усвоения следующих дисциплин:
- физическая и коллоидная химия: рассчитывать термодинамические функции состояния системы, тепловые эффекты химических процессов, прогнозировать поведение системы; физико-химические константы лекарственных веществ, изучать способы определения температуры плавления, угла вращения и других показателей лекарственных средств;
- биологическая химия: изучение метаболизма биологически активных веществ;
- фармакология: проведение анализа лекарственных средств, основных структурных фрагментов;
- фармацевтическая технология: изучение технологии изготовления лекарственных средств; методов оценки качества лекарственных средств;
- токсикологическая химия: изучение основных закономерностей распределения и превращения токсических веществ в организме человека, общую характеристику токсического действия.
3. Цели занятия.
3.1. Общая цель: изучение темы направлено на формирование компетенций по ФГОС специальности ПК-31, ПК-32, ПК-35.
3.2. Конкретные цели и задачи.
После изучения темы студент должен:
«Знать» - метрологические требования при работе с физической аппаратурой; правила техники безопасности работы в химической лаборатории и с физической аппаратурой; основные начала термодинамики, термохимия.
«Уметь» - собирать простейшие установки для проведения лабораторных исследований; пользоваться физическим, химическим оборудованием, компьютеризированными приборами; проводить лабораторные опыты, уметь табулировать данные и рассчитывать энтальпию реакции графически, оформлять отчетную документацию по экспериментальным данным; теоретически обосновывать химические основы фармакологического эффекта и токсичности; измерять физико-химические параметры растворов.
«Владеть» - методиками анализа физических и химических свойств веществ различной природы; техникой химических экспериментов, навыками работы с химической посудой и простейшими приборами; простейшими операциями при выполнении качественного и количественного анализа.
4. Вопросы, изученные на предшествующих дисциплинах и необходимые для освоения темы.
1. Типы химических реакций: экзотермические, эндотермические (общее среднее образование).
2. Основы термохимии, закон Гесса и его следствия (общее среднее образование).
5. Задания для самостоятельной подготовки к лабораторному занятию:
5.1. Перечень контрольных вопросов для самоконтроля знаний.
Основные термодинамические понятия.
Термодинамика как основа биоэнергетики.
Первый закон термодинамики.
Понятие об энтальпии. Стандартная энтальпия.
Способы определения тепловых эффектов процессов. Закон Гесса и его следствия.
Тепловые явления при растворении.
Применимость первого закона термодинамики к живым организмам.
Недостаток 1-го з-на термодинамики.
Тенденции системы – стремление к устойчивости и к наиболее вероятному существованию.
Энтропия, ее физический смысл, изменение при изотермических процессах и изменении температуры.
Формулировки второго закона термодинамики.
Изменение энергии Гиббса в самопроизвольных процессах.
13.Энергетическое сопряжение биохимических реакций.
5.2. Задания для СРС во внеучебное время.
Задача №1.
Вычислить
стандартную энтальпию реакции:
![]()
![]() ,
используя данные:
,
используя данные:![]() ,
ΔH0 =
–790 кДж/моль
,
ΔH0 =
–790 кДж/моль
![]() ,
ΔH0 =
–196 кДж/моль
,
ΔH0 =
–196 кДж/моль
Задача №2.
Вычислите стандартную энтропию реакции: CO2(г)+2NH3(г)(NH2)2CO(т)+H2O(ж)
Задача №3.
Вычислить стандартную энтальпию реакции, используя значения ΔH0 сгорания:
![]() .
.
Задача № 4 (расчётно - графическая работа)
На основании экспериментальных данных определите тепловой эффект растворения 4,28 г NН4Cl в 800 мл воды, если для нагрева системы было затрачено 60 кДж/моль.
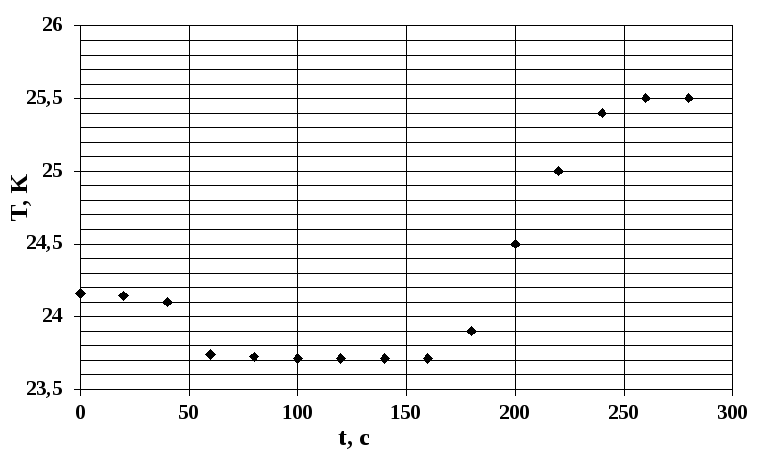
Задача № 5.
Ориентируясь на уравнение реакции: 2NO2(г)2NO(г)+O2(г)
вычислите направление
реакции в закрытой и открытой системах,
учитывая, что энтальпия реакции равна
113 кДж/моль, энтропии веществ
![]() равны:Sº(NO2)=240,45;
Sº(NO)=210,62;
Sº(O2)=205,03.
равны:Sº(NO2)=240,45;
Sº(NO)=210,62;
Sº(O2)=205,03.
5.3. Задания для самоконтроля подготовки к лабораторному занятию.
Вариант теста № 1.
Функцией состояния является:
а) давление;
б) энтальпия;
в) температура;
г) концентрация.
Вариант теста № 2.
Стандартная
энтальпия реакции
![]() составляет
составляет
–74 кДж/моль, на основании этого можно сделать вывод:
а) скорость реакции велика;
б) скорость реакции мала;
в) скорость реакции определить нельзя;
г) реакция не идет.
Вариант теста № 3.
Реакция
![]() относится
к экзотермическим. Реакция протекает:
относится
к экзотермическим. Реакция протекает:
а) только в прямом направлении;
б) реакция обратима;
в) направление реакции определить нельзя;
г) реакция не идет.
Вариант теста № 4.
Первый закон термодинамики выражает формула:
а) Q = ∆E + W;
б) W = Q + E;
в) ∆E = Q – W;
г) ∆G = ∆H - T∆S.
6. Этапы проведения лабораторного занятия.
|
№ |
Название этапа |
Цель этапа |
Время, мин |
|
1 |
2 |
3 |
4 |
|
|
I. Вводная часть занятия. |
10 | |
|
1. |
Организация занятия |
Проверка присутствующих, их внешнего вида, наличия рабочих тетрадей и лекций. |
5 |
|
2. |
Определение темы, мотивации, целей, задач занятия |
Формирование мотивации данного занятия, значимости его в подготовке провизора. |
5 |
|
|
II. Основная часть занятия. |
160 | |
|
3. |
Контроль исходных знаний, умений и навыков |
Выявление исходного уровня знаний, умений и навыков, обеспечение единого уровня. |
20 |
|
4. |
Общие и индивидуальные задания для СРС в учебное время. |
Дифференцированное ориентирование студентов к предстоящей работе. |
40 |
|
5. |
Демонстрация методики |
Показать ориентировочную основу действия (ООД) |
10 |
|
6. |
Управляемая СРС в учебное время |
Выполнение эксперимента. Овладение профессиональ-ными компетенциями Пк-31, ПК-32, ПК-35 |
40 |
|
7. |
Реализация планируемой формы занятия |
Контроль результатов обучения и оценка с помощью дескрипторов |
30 |
|
8. |
Итоговый контроль |
Закрепление приобретённых ЗУН, выявление ошибок и их корректировка |
20 |
|
|
III. Заключительная часть занятия. |
10 | |
|
9. |
Подведение итогов занятия. |
Оценка деятельности студентов, определение достижения цели занятия |
5 |
|
10. |
Общие и индивидуальные задания на СРС во внеучебное время. |
Указание по самоподготовке студентов к следующему занятию «Качественные опыты по химическому равновесию» |
5 |
