
методичка лаба термодинамика
.pdf
Министерство образования Республики Беларусь |
|||||
БЕЛОРУССКИЙ НАЦИОНАЛЬНЫЙ ТЕХНИЧЕСКИЙ |
|||||
|
|
|
УНИВЕРСИТЕТ |
|
|
Факультет технологий управления и гуманитаризации |
|||||
Кафедра ЮНЕСКО “Энергосбережение и возобновляемые |
|||||
|
|
|
источники энергии» |
|
|
ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО ТЕРМОДИНАМИКЕ |
|||||
|
|
МЕТОДИЧЕСКОЕ ПОСОБИЕ |
|||
|
|
для студентов специальностей |
|||
|
|
|
1 43 01 06 - |
|
|
"Энергоэффективные технологии и энергетический менеджмент", |
|||||
|
1 36 20 01 - «Низкотемпературная техника» |
||||
Р |
m |
2 |
2 |
2 |
|
Р2 |
|
||||
Р5 |
|
f |
|
e |
|
Р4 |
|
|
a |
||
|
|
|
b |
||
|
|
|
c |
||
Р3 |
|
|
|
||
|
|
|
d |
||
|
|
|
|
||
Р1 |
|
|
|
1 |
|
n |
|
|
|
||
|
|
|
|
|
V |
|
|
|
Минск 2011 |
|
|
1

УДК 621.1.016.7(075.8)
Пособие включает лабораторные работы по дисциплине "Термодинамика" для студентов специальности 1 43 01 06 "Энергоэффективные технологии и энергетический менеджмент" и 1 36 20 01 - «Низкотемпературная техника»
.
Лабораторный практикум составлен в соответствии с учебным планом кафедры ЮНЕСКО "Энергосбережение и возобновляемые источники энергии".
Рекомендовано методической комиссией факультета технологий управления и гуманитаризации.
Одобрено учебно-методическим управлением.
Составители:
Н.Г. Хутская, Г.И. Пальчёнок, Ю.К. Кривошеев
ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО ТЕРМОДИНАМИКЕ МЕТОДИЧЕСКОЕ ПОСОБИЕ
для студентов специальности1 43 01 06 "Энергоэффективные технологии и энергетический менеджмент"
1 36 20 01 - «Низкотемпературная техника»
Составители: ХУТСКАЯ Наталия Геннадьевна ПАЛЬЧЁНОК Геннадий Иванович КРИВОШЕЕВ Юрий Константинович
Формат 60х84 1/16. Бумага тип.№2. Офсет.печать Усл.печ.л. 4 Тираж 100. Зак.
Издатель:
2

Лабораторная работа №1
ОПРЕДЕЛЕНИЕ ГАЗОВОЙ ПОСТОЯННОЙ ВОЗДУХА
Цель работы: экспериментальное определение удельной газовой постоянной воздуха R, определение удельного объема воздуха при условиях эксперимента v и при нормальных условиях vнорм, определение объема моля идеального газа при нормальных условиях v и универсальной газовой постоянной R .
Общие сведения
Изучение свойств идеального газа начинают с упрощенной модели известной под названием идеального газа.
Идеальным называется газ, в котором отсутствуют силы взаимодействия между молекулами. а объем самих молекул равен нулю.
Допустим, что в цилиндре с подвижным поршнем находится 1 кг идеального газа, который характеризуется следующими
параметрами: давление р1, температура Т1 и удельный объем v1. Подведя к газу некоторое количество теплоты, переведем его во второе состояние с параметрами р2, Т2 и v2. Экспериментально установлено, что между параметрами начального и конечного состояния существует соотношение
p1v1 |
|
p2v2 |
(1) |
|
T1 |
T2 |
|||
|
|
Для любого другого состояния получается аналогичное равенство, благодаря чему можно записать
pv const T
(2)
Как следует из выражений (1) и (2), для любого состояния идеального газа произведение давления на удельный объем, поделенное на термодинамическую температуру, есть величина постоянная. В уравнении (2) она обозначается буквой R (Дж/кг К) и
3
называется удельной газовой постоянной. С учетом последнего выражение (2) примет вид
pv RT
(3)
Это выражение называется уравнением состояния идеального газа. Оно устанавливает зависимость между основными термодинамическими параметрами для идеального газа в равновесном состоянии.
Ввиду того, что в уравнение входит удельный объем v (м3/кг) газа, оно справедливо для 1 кг газа.
Если умножить обе части уравнения (3) на молекулярную массу (кг/кмоль) , получим
pv = RT |
(4) |
Произведение v выражает объем моля газа V (м3/кмоль) .
v = V |
(5) |
R = R . |
(6) |
Здесь R (Дж/кмоль К)- универсальная газовая постоянная. Таким образом для 1 моля (киломоля ) газа уравнение
состояния выглядит следующим образом
pV = R T. |
(7) |
Моль (киломоль)- количество вещества в граммах (килограммах), численно равное молекулярной массе .
Из уравнения (7) определяется универсальная газовая постоянная
R = pV /T |
(8) |
Продифференцировав последнюю зависимость для случая
4
p = const, получим
R |
|
pdV |
(9) |
||
|
dT |
|
|||
В соответствии |
с этим выражением |
универсальная газовая |
|||
постоянная представляет работу моля газа pdV при изменении
температуры на один градус в изобарном процессе.
Как известно, моли идеальных газов при одинаковых условиях занимают одинаковые объемы. При изменении температуры на один градус в изобарном процессе их объемы будут изменяться на одну и ту же величину и, следовательно, совершать одинаковую работу. Таким образом, постоянная R является универсальной физической величиной, не зависящей ни от рода газа, ни от его состояния. Она для всех газов одинакова и равна
R =8314 Дж/кмоль К |
(10) |
Из уравнения (6)
R= R / = 8314/ , Дж/кг К |
(11) |
Таким образом, удельная газовая постоянная определяется только молекулярной массой и, следовательно, имеет индивидуальное значение для каждого газа и равна работе, совершаемой 1 кг газа при повышении его температуры на один градус в изобарном процессе.
Если умножить обе части уравнения (3) на массу газа G, получим
pvG = GRT . |
(12) |
Произведение удельного объема на массу – это объем (м3)
vG =V. |
(13) |
Тогда уравнение состояния для массы G, кг
5
pV = GRT. |
(14) |
Уравнение (14) носит название уравнения Клапейрона.
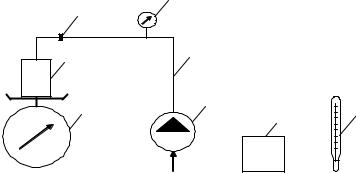
Экспериментальная установка
3
7
1 6
2 |
4 |
8 |
|
5 |
|||
|
|
1 – тонкостенный металлический сосуд объемом V; 2 – весы; 3 – манометр для измерения избыточного давления в сосуде; 4 – насос; 5 – барометр для измерения атмосферного давления; 6 – соединительные шланги; 7 – зажим; 8 – термометр.
Схема экспериментальной установки
Порядок проведения эксперимента
Сосуд 1 взвешивается на весах 2 вместе с зажимом 7 для определения массы G 1 цил. Барометром 5 измеряется атмосферное давление В, а термометром 8 - температура окружающей среды Т. Сосуд при помощи соединительных шлангов 6 присоединяется к насосу 4. Насосом поднимаем избыточное давление в сосуде примерно до 10 5 Па. Это давление регистрирует манометр 3. Поскольку процесс сжатия воздуха происходит в закрытом сосуде (изохорный процесс, в котором с ростом абсолютного давления растет и температура), температура воздуха в сосуде повышается и становится выше температуры окружающей среды. После сжатия воздуха должно произойти выравнивание температур воздуха
6
внутри сосуда и снаружи. При этом давление, показываемое манометром, несколько снизится, фиксируется это показание манометра ризб. Затем устанавливается зажим на шланге, сосуд отсоединяется от насоса и повторно взвешивается на весах. Таким образом определяется масса G 2 цил.
Таблица измерений
№ |
Т, К |
В,кПа. |
Р изб |
G1цил., |
G2цил., |
G, |
Р1 , |
Р2, |
пп |
|
|
Па |
кг |
кг |
кг |
Па |
Па |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Методика расчета
В основу экспериментального определения удельной газовой постоянной положено выражение (3), из которого следует
R = pv/ T |
(15) |
Можно записать для двух различных состояний газа
|
|
|
pv |
|
p v |
2 |
|
|
|
|
||||||
|
|
|
1 |
1 |
|
|
2 |
|
|
|
|
|
(16) |
|||
|
T1 |
|
|
T2 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Принимая во внимание, что T1 = T2 |
и |
|||||||||||||||
v |
V |
; v |
|
V |
, |
|
|
|
|
(17) |
||||||
|
|
|
|
|
|
|
||||||||||
1 |
G |
2 |
|
G |
|
|
|
|
|
|
|
|
||||
получим |
1 |
|
|
|
1 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p1 |
|
p2 |
, |
(18) |
||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
G1 |
|
|
G2 |
|
||||
7
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
p1 |
|
|
G1 |
|
|
|
(19) |
||||||
|
|
|
|
|
p2 |
G2 |
||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
С учетом того, что G2 =G1 + G |
|
|||||||||||||||||
|
p1 |
|
|
|
G1 |
|
|
|
|
|
|
|
|
|
|
(20) |
||
|
|
|
G1 G |
|
|
|
|
|
||||||||||
|
p2 |
|
|
|
|
|
|
|
||||||||||
Отсюда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
G |
|
|
p1 |
|
|
G |
(21) |
|||||||||||
|
|
|
|
|
|
|||||||||||||
1 |
|
p p |
|
|
|
|
|
|
||||||||||
|
|
|
2 |
|
|
1 |
|
|
|
|
|
|
|
|
|
|||
Определение удельного объема воздуха при нормальных |
||||||||||||||||||
условиях из соотношения |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
pv |
|
|
pнормvнорм |
|
|||||||||
|
|
|
|
|
1 1 |
|
|
|
|
|
(22) |
|||||||
|
|
|
|
|
|
|
|
|
Tнорм |
|||||||||
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|||||
p норм = 760 мм рт. ст., Tнорм = 273 К |
|
|||||||||||||||||
v |
v |
|
p1 |
|
|
273 |
; норм. м3/к |
(23) |
||||||||||
|
|
|
||||||||||||||||
|
норм |
1 760 |
|
|
|
T |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
||
Здесь p 1 = В, мм рт.ст.
Объем, занимаемый молем воздуха при нормальных условиях, определяется как произведение молекулярной массы на удельный объем воздуха при нормальных условиях
v = v норм, норм. м3/моль |
(24) |
8
Обработка результатов измерений
Изменение массы воздуха в сосуде определяется из соотношения
G= G 2 цил - G 1 цил |
(25) |
По формуле (21) определяется масса воздуха, находящегося в сосуде при атмосферном давлении. Из выражения (17) находим удельный объем воздуха, а из выражения (15) - удельную газовую постоянную. В последнюю формулу можно подставлять термодинамические параметры для начального или конечного состояния. Универсальная газовая постоянная определяется из выражения (8), удельный объем воздуха при нормальных условиях - из (23), объем моля - из (24).
Оценка точности измерений
Относительная ошибка при определении величины R может быть найдена из соотношения
(R) = ( V / V) + ( P / P) + ( T / T) + ( G / G),
где - V , P, T, G -абсолютные погрешности при измерении объема, давления, температуры и массы воздуха.
Лабораторная работа №2
ОПРЕДЕЛЕНИЕ СРЕДНЕЙ ОБЪЕМНОЙ ИЗОБАРНОЙ ТЕПЛОЕМКОСТИ ВОЗДУХА
Цель работы: Определение средней объемной изобарной теплоемкости воздуха С p m (Дж/норм. м 3 К) методом проточного калориметра
9
Общие сведения
Теплоемкость системы - производная от количества теплоты по температуре в термодинамическом процессе.
C x = (dq / dT) x (КДж/К) |
(1) |
Теплоемкость является экстенсивной величиной, т.е. зависящей от количества вещества в системе. В зависимости от количественной единицы теплоемкости подразделяются на массовую (удельную) с (кДж/кг К), объемную С (кДж/м3 К) и
мольную с (кДж/кмоль К).
Теплоемкость идеального газа не зависит ни от давления, ни от удельного объема, а зависит только от температуры.
Теплоемкость бывает истинная и средняя. Истинная теплоемкость - это теплоемкость при заданной температуре, она определяется
с = dq / dT |
(2) |
Здесь dq и dT -соответственно бесконечно малые количество подведенной теплоты и изменение температуры.
Средняя теплоемкость - это теплоемкость в рассматриваемом интервале температур.
сm = q 1-2 /(t 2 - t 1) |
(3) |
Здесь q 1-2 - количество теплоты, подведенное к единице массы тела в процессе 1-2, t 1 и t 2 - соответственно начальная и конечная температуры в процессе.
В связи с тем. что количество теплоты, подводимой к телу. зависит от термодинамического процесса, в котором эта теплота подводится, различают теплоемкости изобарную с р , изохорную сv, изотермическую сT, адиабатную сs и политропную сn. Поскольку в изотермическом процессе температура не изменяется,
теплоемкость изотермического процесса бесконечна (с T =+ при подводе теплоты к телу и с T =- при отводе теплоты).
10
