
- •Тема: «общие пути обмена аминокислот. Трансаминирование, дезаминирование и декарбоксилирование аминокислот»
- •Аминокислотный фонд организма
- •Азотистый баланс.
- •Белки пищи - главный источник аминокислот для организма
- •Трансаминирование аминокислот
- •Дезаминирование аминокислот.
- •Декарбоксилирование аминокислот.
- •23.6.2. Примеры реакций декарбоксилирования. Некоторые аминокислоты непосредственно подвергаются декарбоксилированию. Реакция декарбоксилирования гистидина :
- •Биосинтез аминокислот в тканях.
Декарбоксилирование аминокислот.
23.6.1. Декарбоксилирование аминокислот – отщепление карбоксильной группы от аминокислоты с образованием СО 2 . Продуктами реакций декарбоксилирования аминокислот являются биогенные амины , участвующие в регуляции обмена веществ и физиологических процессов в организме (см. таблицу 23.1).
Таблица 23.1
|
Аминокислота |
Биогенный амин |
|
Гистидин |
Гистамин |
|
Глутамат |
γ-аминомасляная кислота (ГАМК) |
|
Тирозин |
Дофамин |
|
Триптофан |
Триптамин |
|
Серотонин
|
|
|
Цистеин |
Таурин
|
|
Тиоэтиламин |
Биогенные амины и их предшественники.
Реакции декарбоксилирования аминокислот и их производных катализируют декарбоксилазы аминокислот. Кофермент – пиридоксальфосфат (производное витамина В 6 ). Реакции являются необратимыми.
23.6.2. Примеры реакций декарбоксилирования. Некоторые аминокислоты непосредственно подвергаются декарбоксилированию. Реакция декарбоксилирования гистидина :

Гистамин обладает мощным сосудорасширяющим действием, особенно капилляров в очаге воспаления; стимулирует желудочную секрецию как пепсина, так и соляной кислоты, и используется для исследования секреторной функции желудка.
Реакция декарбоксилирования глутамата :

ГАМК – тормозный медиатор в центральной нервной системе.
Ряд аминокислот подвергается декарбоксилированию после предварительного окисления. Продукт гидроксилирования триптофана превращается в серотонин:

Серотонин образуется главным образом в клетках центральной нервной системы, обладает сосудосуживающим действием. Участвует в регуляции артериального давления, температуры тела, дыхания, почечной фильтрации.
Продукт гидроксилирования тирозина переходит в дофамин:

Дофамин служит предшественником катехоламинов; является медиатором ингибирующего типа в центральной нервной системе.
Тиогруппа цистеина окисляется до
сульфогруппы, продукть этой реакции
декарбоксилируется с образованием
таурина:

Таурин образуется главным образом в печени; участвует в синтезе парных желчных кислот (таурохолевой кислоты).
21.5.3. Катаболизм биогенных аминов. В органах и тканях существуют специальные механизмы, предупреждающие накопление биогенных аминов. Основной путь инактивации биогенных аминов – окислительное дезаминирование с образованием аммиака – катализируется моно- и диаминооксидазами.
Моноаминооксидаза (МАО) - ФАД-содержащий фермент – осуществляет реакцию:

В клинике используются ингибиторы МАО (ниаламид, пиразидол) для лечения депрессивных состояний.
Биосинтез аминокислот в тканях.
23.7.1. В организме человека возможен синтез заменимых аминокислот, к которым относятся: аланин, аргинин, аспартат, гистидин, глицин, глутамат, глутамин, пролин, серин, тирозин, цистеин. Недостаток в пище любой из этих аминокислот не будет сопровождаться её дефицитом в организме. Основными путями образования заменимых аминокислот являются: 1) трансаминирование α-кетокислот , 2) восстановительное аминирование α-кетокислот , 3) синтез с участием незаменимых аминокислот .
23.7.2. Трансаминирование (см. тему 23.4). Источниками атомов углерода в этих реакциях служат метаболиты гликолиза и цикла Кребса, источниками атомов азота – другие аминокислоты, чаще всего – глутамат (см. рисунок 23.4).
23.7.3. Восстановительное аминирование (см. тему 24). Источником атома азота аминогруппы является молекула аммиака, источником углерода - α-кетокислоты, чаще всего - α-кетоглутарат (см. рисунок 23.4).

Рисунок 23.4. Биосинтез заменимых аминокислот в тканях с использованием углеродного скелета глюкозы (одной звёздочкой показаны реакции трансаминирования, двумя – восстановительного аминирования).
23.7.4. Синтез с участием незаменимых аминокислот. Заменимая аминокислота тирозин может образоваться из незаменимой аминокислоты фенилаланина:

Фенилаланингидроксилаза - типичная цитохром P 450 -зависимая гидроксилаза со смешанной функцией: один атом кислорода включается в воду и другой в гидроксильную группу тирозина. Восстановителем служит кофактор тетрагидробиоптерин , который поддерживается в восстановленном состоянии НАДФН-зависимым ферментом дигидробиоптерин-редуктазой.
Заменимая аминокислота цистеин синтезируется при участии незаменимой аминокислоты метионина, которая используется как источник атома серы. После отдачи метильной группы в реакциях трансметилирования метионин превращается в гомоцистеин. При его взаимодействии с заменимой аминокислотой серин образуется цистатионин:

Цистатионин подвергается расщеплению с образованием цистеина и гомосерина, который подвергается дезаминированию в α-кетобутират:
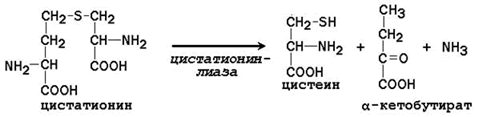
Таким образом, фенилаланин и метионин, поступающие с пищей, частично используются для синтеза заменимых аминокислот. Поэтому суточная потребность в фенилаланине и метионине может быть существенно снижена при поступлении в организм дополнительных количеств тирозина и цистеина соответственно.
