
- •Тема: «общие пути обмена аминокислот. Трансаминирование, дезаминирование и декарбоксилирование аминокислот»
- •Аминокислотный фонд организма
- •Азотистый баланс.
- •Белки пищи - главный источник аминокислот для организма
- •Трансаминирование аминокислот
- •Дезаминирование аминокислот.
- •Декарбоксилирование аминокислот.
- •23.6.2. Примеры реакций декарбоксилирования. Некоторые аминокислоты непосредственно подвергаются декарбоксилированию. Реакция декарбоксилирования гистидина :
- •Биосинтез аминокислот в тканях.
Белки пищи - главный источник аминокислот для организма
23.3.1. Пищевые белки, поступающие в организм, используются как источник аминокислот для синтеза собственных структурных, каталитических, транспортных, рецепторных и других белков, а также веществ небелковой природы.
23.3.2. Суточная потребность в белках для взрослого человека зависит от возраста, профессии, состояния здоровья, условий труда, климатических и иных факторов. Установлено, что взрослый человек при средних энергетических затратах должен получать 100 – 120 г белка в сутки.
23.3.3. Необходимо также учитывать биологическую ценность белков . Чем ближе аминокислотный состав пищевого белка к аминокислотному составу белков тела, тем лучше он усваивается и тем выше его биологическая ценность. Это тем более важно, что 8 аминокислот в организме взрослого человека синтезироваться не могут. Такие аминокислоты называются незаменимыми, к ним относятся: валин, лейцин, изолейцин, лизин, метионин, треонин, фенилаланин и триптофан. Остальные 12 аминокислот являются заменимыми, они способны синтезироваться в организме человека и недостаток их в пище может быть возмещён за счет других аминокислот.
Трансаминирование аминокислот
23.4.1. К общим путям метаболизма аминокислот относятся реакции трансаминирования, дезаминирования и декарбоксилирования.
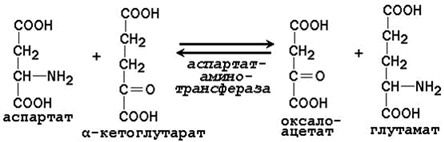
23.4.2. Трансаминирование аминокислот – перенос аминогруппы (NН 2 -) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Реакции трансаминирования катализируют ферменты – аминотрансферазы (или трансаминазы). Кофермент аминотрансфераз – пиридоксальфосфат (производное витамина В 6 ). В реакции принимает участие альдегидная группа кофермента. Реакция легко обратима. Механизм реакции трансаминирования представлен на рисунке 23.2.

Рисунок 23.2. Механизм переноса аминогруппы с аминокислоты на α-кетокислоту в реакции трансаминирования.
Примеры реакций трансаминирования:

23.4.3. Роль реакций трансаминирования в организме:
участие в непрямом дезаминировании аминокислот;
путь синтеза заменимых аминокислот;
образующиеся в реакции α-кетокислоты могут включаться в общий путь катаболизма и глюконеогенез.
Дезаминирование аминокислот.
23.5.1. Дезаминирование аминокислот – отщепление аминогруппы от аминокислоты с образованием аммиака (NН 3 ). В тканях человека преобладает окислительное дезаминирование, то есть сопряжённое с переносом водорода.
23.5.2. Большинство ферментов, участвующих в окислительном дезаминировании аминокислот, при физиологических значениях рН малоактивны. Поэтому основная роль в окислительном дезаминировании принадлежит глутаматдегидрогеназе, которая катализирует прямое окислительное дезаминирование глутамата. В качестве кофермента используются НАД + или НАДФ + (производные витамина РР). Реакция обратима.

Глутаматдегидрогеназа – аллостерический фермент, его аллостерическими активаторами являются АДФ и ГДФ, аллостерическими ингибиторами – АТФ, ГТФ и НАДН.
23.5.3. Непрямое дезаминирование характерно для большинства аминокислот. Оно называется непрямым, потому что происходит в 2 этапа:
на первом этапе аминокислота подвергается трансаминированию с образованием глутамата;
на втором этапе происходит окислительное дезаминирование глутамата (см. рисунок 21.3).

Рисунок 23.3. Схема непрямого дезаминирования аминокислот.
Участие аминотрансфераз в этом процессе позволяет собрать аминогруппы различных аминокислот в составе одной аминокислоты – глутамата, который затем подвергается окислению с образованием аммиака и α-кетоглутарата.
