
- •Лекция №12. -Аминокислоты. Пептиды. Белки
- •I. -Аминокислоты
- •1. Классификация и номенклатура аминокислот по строению радикалов
- •Классификация аминокислот по растворимости их радикалов в воде, полярности, наличию или отсутствию заряда
- •1.Ак с алифатическими углеводородными радикалами, гидрофобные, незаряженные
- •2. Ак в растворе. Кислотно-основные свойства ак
- •4. Биохимические реакции -аминокислот
- •2. Окислительное дезаминирование (in vivo)
- •3. Поликонденсация ак, образование полипептида.
- •II. Белки и пептиды Строение белков и полипептидов.
- •Свойства белков
4. Биохимические реакции -аминокислот
АК – мономеры белков, поэтому их превращения в организме связаны с метаболизмом белков.
Основной способ получения АК организмом – гидролиз белков. Существует 8 незаменимых АК, которые могут поступать в организм только с белковой пищей, это Валин, Лейцин, Изолейцин, Треонин, Лизин, Метионин, Фенилаланин, Триптофан, (Только Врач И Фармацевт Могут Лечить Людей Таблетками, кроме Тирозина).Для растущих организмов незаменимы также гистидин и аргинин.
Заменимые АК синтезируются в организме из других АК и кетокислот реакцией трансаминирования или переаминирования
Трансаминорование
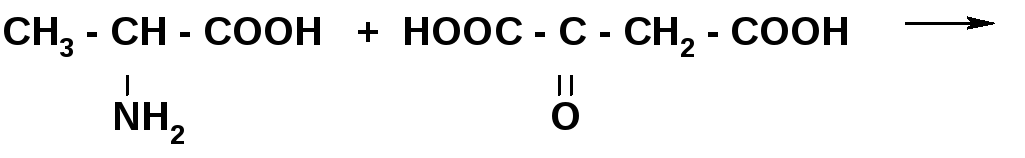
АЛАНИН ЩУК

ПВК АСПАРАГИНОВАЯ КИСЛОТА
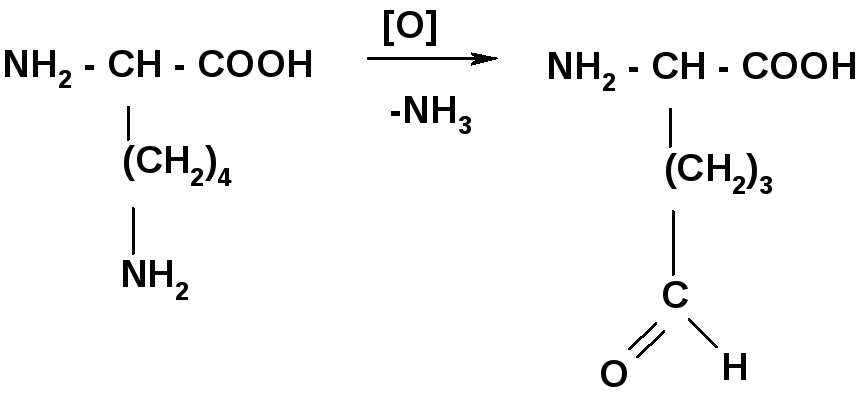
Под действием кофермента НАД+ или НАДФ+ идет окислительное дезаминирование АК in vivo, в отличие от in vitro с образуются оксогруппы кетокислот
2. Окислительное дезаминирование (in vivo)
НАД+ + Н2О

 NH2
– СН2
– СООН NН
= СН2
– СООН О = СН2
– СООН
NH2
– СН2
– СООН NН
= СН2
– СООН О = СН2
– СООН
-2Н - NH3
Для стомат. образование альдлизина:
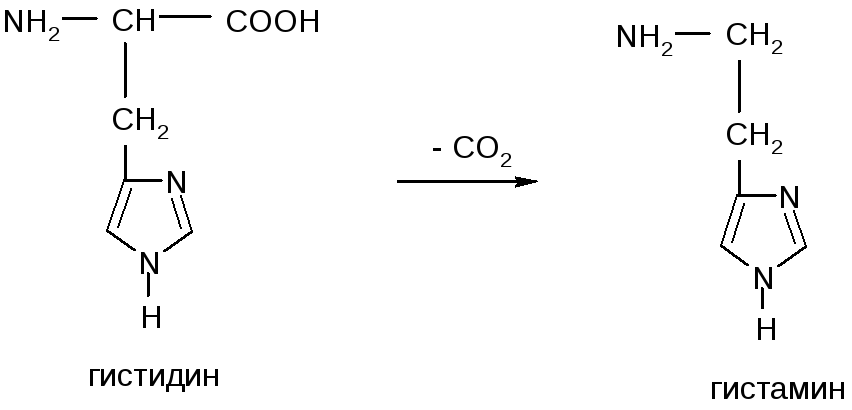
Декарбоксилирование, образование биогенных аминов
Ббиогенные амины образуются из Ак реакцией декарбоксилирования: триптамин и серотонин из триптофана, гистамин из гистидина, коламин из серина, кадаверин из лизина.
3. Поликонденсация ак, образование полипептида.
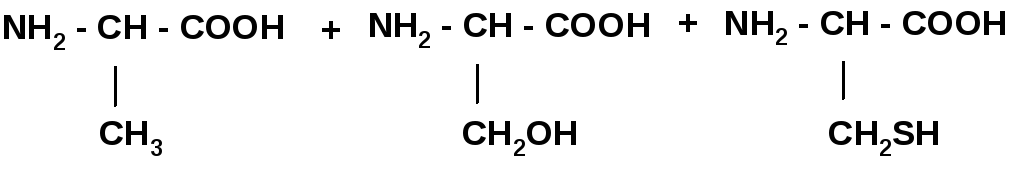

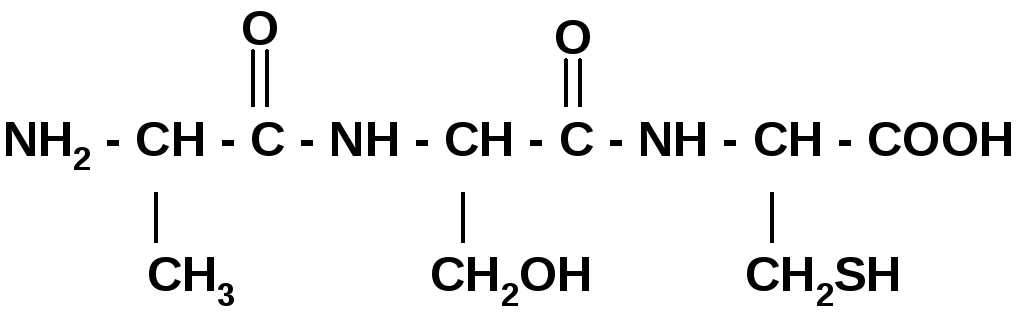
Номенклатура полипептидных цепей: название начинается с N-конца цепочки, остатки АК без годроксильных групп называются как радикалы, с заменой окончания –ИН на –ИЛ, последняя АК называется полностью с окончанием –ИН.
Ала – Цис-Фен: Аланилцистеилфенилаланин
Строение пептидной связи: наличие р-п сопряжения, sp2-гибридизации атомов углерода, азота и кислорода в ней определяет ее плоскостное строение и отсутствие вращений вдоль оси связи и транс- конформацию.
II. Белки и пептиды Строение белков и полипептидов.
Пептиды, содержащие до 10 остатков АК наз олигопептиды. От 10-50 – полипептиды, более 50 – белки.
1. Характеристика первичной структуры белковой или полипептидной молекулы.
Первичная структура это последовательность АК, связанных пептидной связью.Эта последовательность закодирована в участке ДНК, называемом геном. В процессе синтеза белка информация, находящаяся в гене переписывается на м-РНК, а затем, используя м-РНК в качестве матрицы на рибосоме происходит сборка первичной структуры белка.

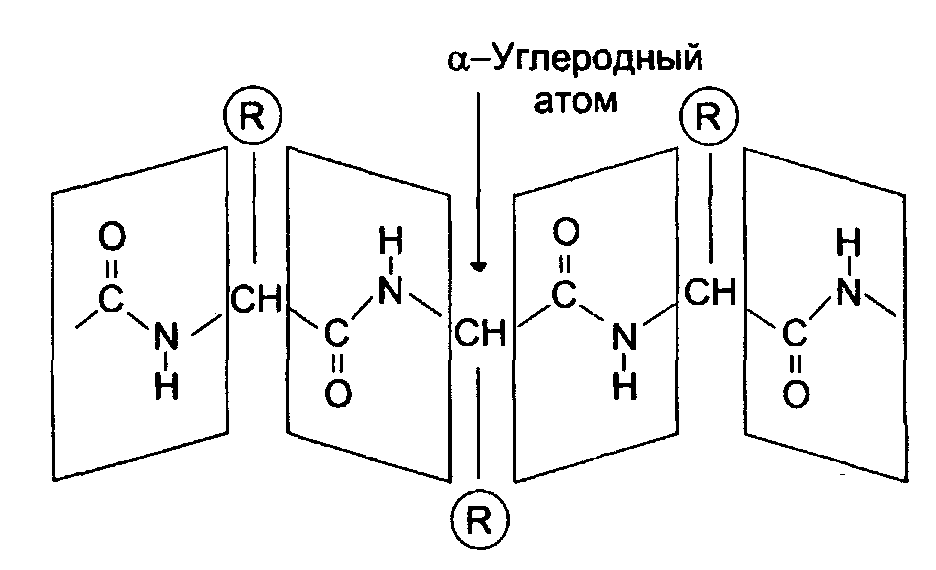
За счет внутримолекулярных взаимодействий белки образуют определенную пространственную структуру называемую «конформация белков».
Вторичная структура белков
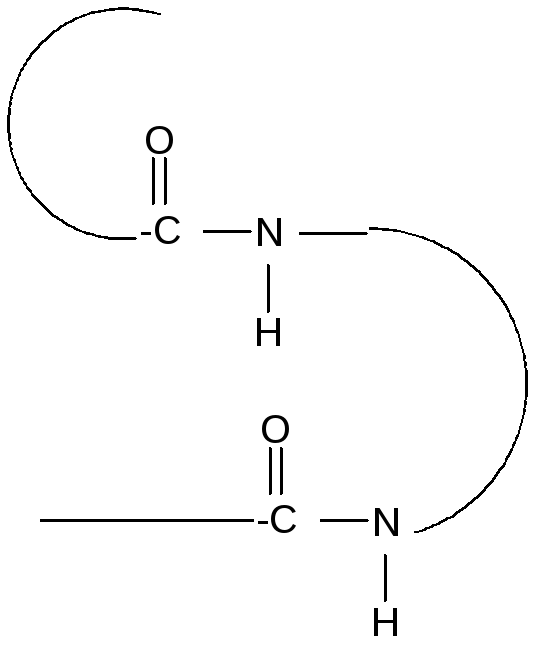
Вторичная структура представляет собой наиболее выгодную конформацию в виде правозакрученной - спирали или складчатой -структуры. Стабилизация вторичной структуры идет за счет водородных связей между пептидными группами.
Третичная структура белков.
Третичная структура возникает за счет взаимодействия боковых радикалов в водном растворе. Молекула белка укладывается в пространстве в виде «глобулы» или «клубка» за счет 1.гидрофобного взаимодействия неполярных или гидрофобных радикалов,2. ионных связей. 3. Дисульфидных ковалентных мостиков, образованных при окислении цистеина. 4. водородных связей
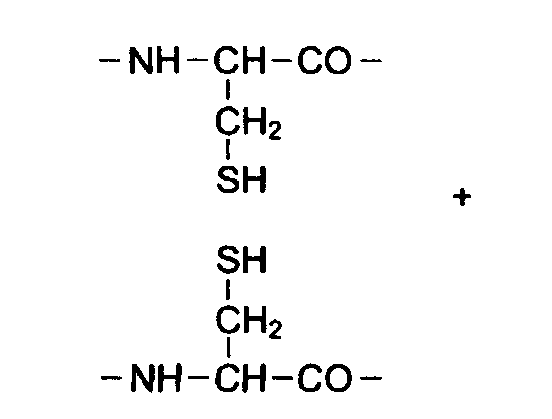
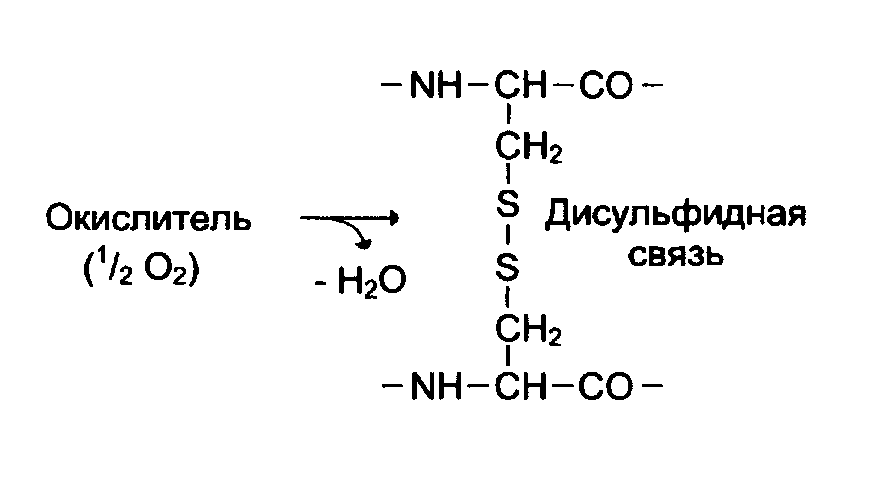
.
