
- •Анализ лекарственных средств органического происхождения по функциональным группам
- •Введение
- •3. Прочие
- •2. Лекарственные вещества, содержащие фенольный гидроксил
- •3. Лекарственные вещества, содержащие карбонильную группу (альдегидную, кетонную)
- •4. Лекарственные вещества, содержащие карбоксильную группу
- •5. Лекарственные вещества, содержащие первичную ароматическую аминогруппу
- •6. Лекарственные вещества, содержащие ароматическую нитрогруппу
- •7. Лекарственные вещества, содержащие вторичную и третичную аминогруппы
- •8. Лекарственные вещества, содержащие сложноэфирную группу
- •9. Лекарственные вещества, содержащие амидную группу
- •10. Лекарственные вещества, содержащие имидную и сульфамидную группы
- •Эффект реакции барбитуратов с раствором меди сульфата
- •11. Лекарственные вещества, содержащие ковалентно связанный галоген
- •12. Лекарственные вещества, содержащие азометиновую группу, ковалентно связанную серу, пиридиновый цикл, ароматический радикал, непредельную связь
- •Специфические реакции
- •Литература
- •Содержание
2. Лекарственные вещества, содержащие фенольный гидроксил
Фенольный гидроксил – это гидроксил, связанный с ароматическим радикалом. Его содержат ЛВ группы фенолов (фенол, резорцин); фенолокислот и их производных (кислота салициловая, фенилсалицилат, салициламид, оксафенамид); производные фенантренизохинолина (морфина гидрохлорид, апоморфин); синэстрол, адреналин и др.
Химические свойства соединений, содержащих фенольный гидроксил, обусловлены взаимодействием электронной пары с π-электронами ароматического кольца. Это взаимодействие приводит к смещению электронной плотности с ОН-группы на кольцо, нарушению в нём равномерности распределения электронов, созданию избыточного отрицательного заряда в орто (о)- и пара (п)-положениях. Атом водорода гидроксигруппы ионизирует и придаёт фенолам слабые кислотные свойства (рКа фенола = 10,0; рКа резорцина = 9,44). Поэтому, в отличие от спиртов, они образуют соли со щелочами (при рН 12-13), растворимые комплексные соединения с хлоридом железа (III) (в нейтральных, слабощелочных и кислых растворах).
Фенолы проявляют сильные восстановительные свойства, очень легко окисляются даже слабыми окислителями. Образуют окрашенные соединения хиноидной структуры.
Наибольшее значение имеют реакции электрофильного замещения водородов в о- и п-положениях ароматического кольца – галогенирование (бромирование), конденсация с альдегидами, нитрование, сочетание с солями диазония.
На основе свойств фенольного гидроксила и активированного им ароматического кольца в анализе ЛВ используются следующие реакции:
1 – комплексообразования;
2 – галогенирования (бромирования);
3 – азосочетания;
4 – окисления;
5 – образования индофенолового красителя;
6 – конденсации с альдегидами.
Идентификация
2.1. Реакция комплексообразования с ионами железа (III)
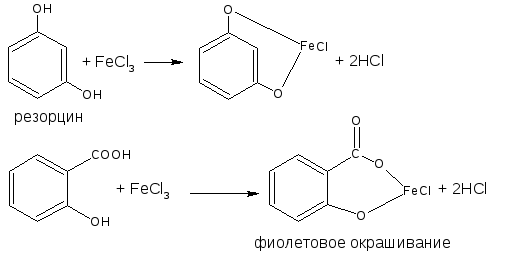
Основана на свойствах фенольного гидроксила образовывать растворимые комплексные соединения, окрашенные чаще в синий (фенол) или фиолетовый цвет (резорцин, кислота салициловая) реже в красный (ПАСК – натрия) и зелёный (хинозол, адреналин).
Состав комплексов, а, следовательно, и их окраска обусловлены количеством фенольных гидроксилов, влиянием других функциональных групп, реакцией среды.
Реакция рекомендована фармакопеей для большинства соединений, содержащих фенольный гидроксил.
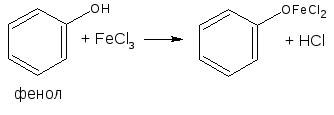
При избытке фенола:
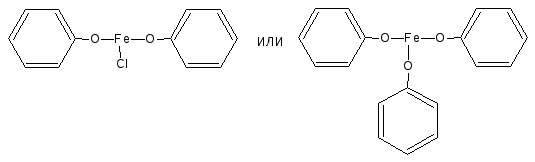
Предположительный состав конечного продукта в реакции с фенолом:
![]()
2.2. Реакция бромирования ароматического кольца
Основана на электрофильном замещении водорода в о- и п- положениях на бром с образованием нерастворимого бромпроизводного (белый осадок).

Основные правила бромирования:
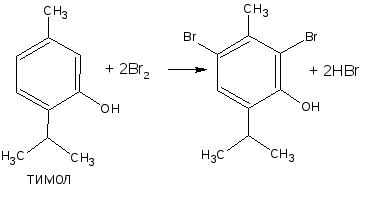
- бром замещает водород в о- и п- положениях по отношению к фенольному гидроксилу (наиболее реакционноспособное – п-положение):
- при наличии в о- или п-положениях ароматического кольца заместителей, в реакцию вступает меньше атомов брома;
- если в о- или п- положениях находится карбоксильная группа, то при наличии избытка брома происходит декарбоксилирование и образование трибромпроизводного:
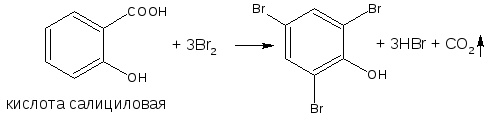
- если заместитель находится в м-положении, то он не препятствует образованию трибромпроизводного:
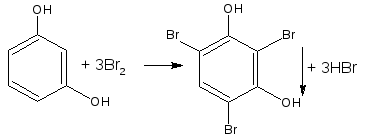
- если в соединении содержится два фенольных гидроксила в м- положении, то в результате их согласованной ориентации образуется трибромпроизводное:
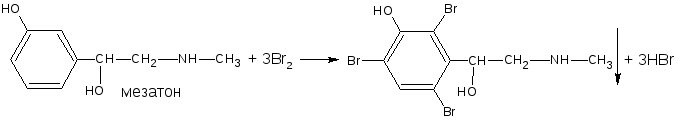
- если две гидроксильные группы расположены в о- или п- положениях друг к другу, то они действуют несогласованно: бромирование количественно не проходит:
- если кроме фенольных гидроксилов соединение содержит амидную или сложно-эфирную группу (салициламид, фенилсалицилат) для их количественной оценки методом броматометрии необходимо провести предварительный гидролиз.
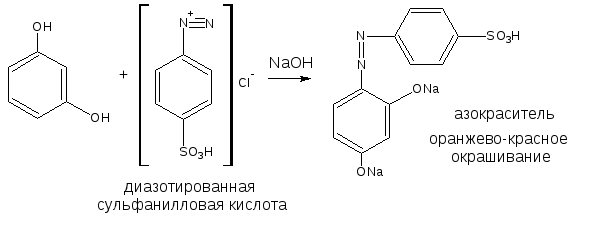
2.3. Реакция азосочетания
Сочетание идет также в о- и п-положениях, в этом случае также, как и при бромировании, предпочтительным является п-положение. Диазореактив – соль диазония (диазотированная сульфаниловая кислота). Среда – щелочная. Продукт реакции – азокраситель.
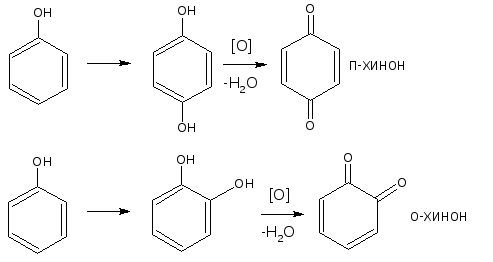
2.4. Реакция окисления
Фенолы могут окисляться до различных соединений, но чаще всего до о- или п-хинонов (циклических дикетонов),окрашенных в розовый или реже в жёлтый цвет.
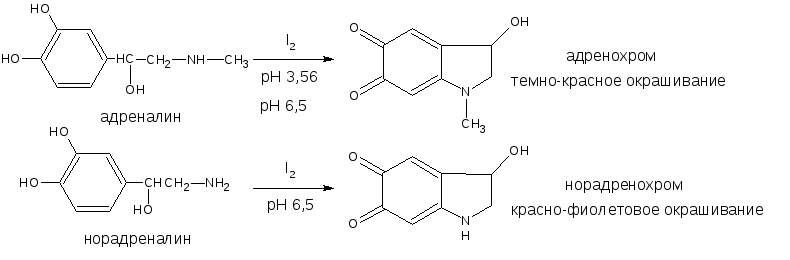
В частности, реакция окисления рекомендована ГФ для адреналина и норадреналина: в качестве окислителя используется йод при определённом значении рН среды. При этом образуются окрашенные продукты адренохром и норадренохром.
2.5. Реакция образования индофенолового красителя
Основана на окислении фенолов до хинонов, которые при конденсации с аммиаком или аминопроизводным и избытком фенола образуют индофеноловый краситель, окрашенный в фиолетовый цвет.
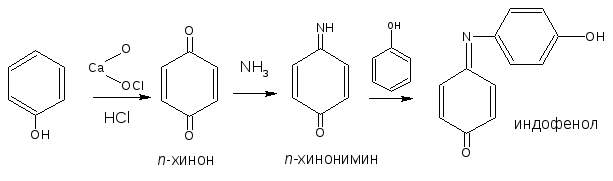
ГФ Х рекомендует эту реакцию для идентификации парацетамола, который гидролизуясь, выделяет п-аминофенол, обнаруживаемый реакцией образования индоамина (по свойствам родственный индофенолу).
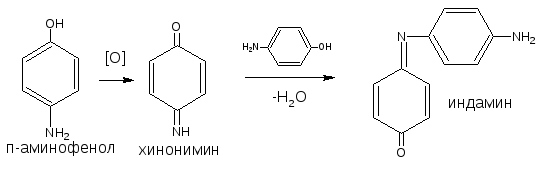
Разновидностью данной реакции является нитрозореакция Либермана, она характерна для фенолов, не имеющих заместителей в о- и п-положениях.
При действии нитрита натрия в кислой среде образуется п-нитрозофенол, изомеризующийся в п-хиноидоксим, который, реагируя с избытком фенола в кислой среде, образует индофенол:
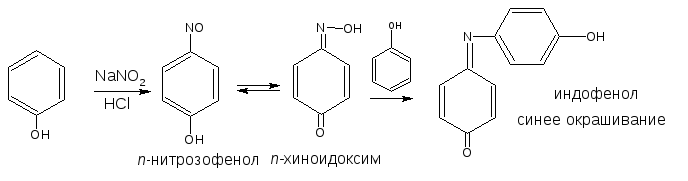
2.6. Образование нитрозосоединений
При взаимодействии с разведенной азотной кислотой фенолы могут нитроваться при комнатной температуре, образуя о- и п-нитропроизводные. Образующееся нитропроизводное содержит в п-положении подвижный атом водорода гидроксильной группы, образуется таутомерная аци-форма с хиноидной структурой, она обычно окрашена в желтый цвет. Добавление щелочи усиливает окраску, вследствие образования хорошо диссоциируемой соли:
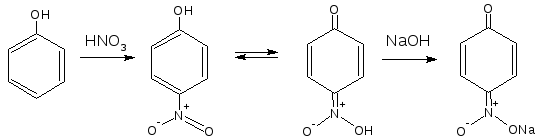
2.7. Реакция конденсации с альдегидами или ангидридами кислот
- с формальдегидом в присутствии концентрированной серной кислоты с образованием ауринового (арилметанового) красителя окрашенного в красный цвет.
Реакция является фармакопейной для кислоты салициловой. Концентрированная серная кислота на первой стадии реакции играет роль водоотнимающего средства, на второй – является окислителем.

С фталевым ангидридом (сплавление и последующее растворение плава в щёлочи) рекомендована фармакопеей для идентификации фенола и резорцина.
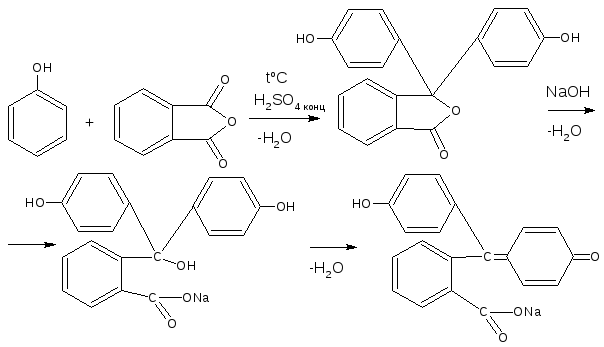
Количественное определение
2.8. Броматометрия
Метод основан на электрофильном замещении атомов водорода ароматического кольца на бром, выделенный в реакции бромата калия с бромидом калия в кислой среде.
K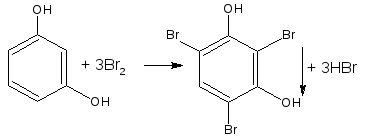 BrO3
+
5KBr
+ 6 HCl
→ 3Br2
+
6KCl
+ 3H2O
BrO3
+
5KBr
+ 6 HCl
→ 3Br2
+
6KCl
+ 3H2O
Используют способы прямого и обратного титрования. В прямом – титруют броматом калия в присутствии бромида калия с индикатором метиловым оранжевым или метиловым красным от розовой окраски до обесцвечивания. В точке эквивалентности избыточная капля бромата калия выделяет бром, который окисляет индикатор и раствор обесцвечивается. При обратном титровании вводят избыток бромата калия, добавляют калия бромид, создают кислую среду, выдерживают нужное для бромирования время и после чего избыток брома определяют йодометрически (индикатор – крахмал).
Br2 + 2KI → I2 + 2KBr
I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
Способом прямого титрования определяют по ГФ Х тимол, обратного – фенол, резорцин, кислоту салициловую, синэстрол и другие ЛВ.
М.э. = ¼ М.м. (тимол)
М.э. = 1/6 М.м. (фенол, резорцин, кислота салициловая)
М.э. = 1/8 М.м. (синэстрол)
2.9. Йодометрия
Основана на электрофильном замещении атомов водорода ароматического кольца на йод.
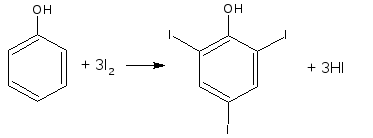
Для связывания йодоводородной кислоты, смещающей равновесие в обратную сторону, добавляют ацетат или гидрокарбонат натрия.
HI + NaHCO3 → NaI + H2O + CO2
HI + CH3COONa → NaI + CH3COOH
Используют способы прямого и обратного титрования. В последнем – избыток йода оттитровывают тиосульфатом натрия.
I2 + 2NaS2O3 → 2NaI + Na2S4O6
М.э. = 1/6 М.м. (фенол)
2.10. Йодхлорметрия
Метод основан на электрофильном замещении атомов водорода ароматического кольца на йод, входящий в состав йодмонохлорида.
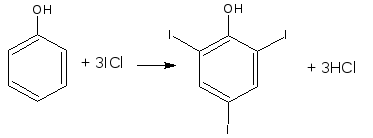
Используют способ обратного титрования – избыток йодмонохлорида определяют йодометрически.
ICl + KI → I2 + KCl
I2 + 2Na2S2O6 → 2NaI + Na2S4O6
М.э. = 1/6 М.м. (фенол)
2.11. Метод ацетилирования
Используют по ГФ Х для количественной оценки синэстрола.

М.э. = ½ М.м.
2.12. Алкалиметрический метод нейтрализации в среде протофильного растворителя диметилформамида (ДМФА).
ЛВ группы фенолов проявляют очень слабые кислотные свойства, их определение алкалиметрическим методом нейтрализации в водных или смешанных средах невозможно, поэтому используют титрование в среде неводных растворителей, в частности, ДМФА. Метод основан на солеобразовании определяемой слабой кислоты (фенола) с титрантом (метилатом натрия) в среде протофильного растворителя, усиливающего кислотные свойства.
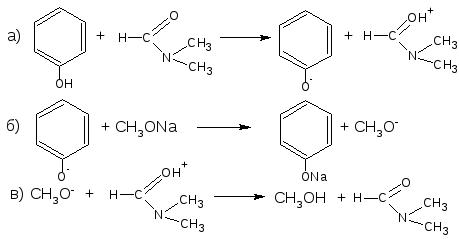
Суммарно:

М.э. = М.м.
2.13. Фотоколориметрия (ФЭК) и спектрофотометрия (СФМ)
Основана на свойстве окрашенных растворов поглощать немонохроматический (ФЭК) или монохроматический (СФМ) свет в видимой области спектра.
В основе определения здесь и далее лежат следующие стадии:
- получение окрашенных растворов;
- измерение оптической плотности (D), характеризующей поглощение электромагнитного излучения раствором, содержащим анализируемое вещество;
- проведение расчётов на основе основного закона светопоглощения с использованием калибровочного графика, удельного коэффициента поглощения, раствора стандартного образца.
При определении этими методами ЛВ, содержащих фенольный гидроксил, получают окрашенные соединения на основе реакций комплексообразования с ионами железа (III), азосочетания с солями диазония и образования индофенолового красителя.
