
- •Анализ лекарственных средств органического происхождения по функциональным группам
- •Введение
- •3. Прочие
- •2. Лекарственные вещества, содержащие фенольный гидроксил
- •3. Лекарственные вещества, содержащие карбонильную группу (альдегидную, кетонную)
- •4. Лекарственные вещества, содержащие карбоксильную группу
- •5. Лекарственные вещества, содержащие первичную ароматическую аминогруппу
- •6. Лекарственные вещества, содержащие ароматическую нитрогруппу
- •7. Лекарственные вещества, содержащие вторичную и третичную аминогруппы
- •8. Лекарственные вещества, содержащие сложноэфирную группу
- •9. Лекарственные вещества, содержащие амидную группу
- •10. Лекарственные вещества, содержащие имидную и сульфамидную группы
- •Эффект реакции барбитуратов с раствором меди сульфата
- •11. Лекарственные вещества, содержащие ковалентно связанный галоген
- •12. Лекарственные вещества, содержащие азометиновую группу, ковалентно связанную серу, пиридиновый цикл, ароматический радикал, непредельную связь
- •Специфические реакции
- •Литература
- •Содержание
10. Лекарственные вещества, содержащие имидную и сульфамидную группы
Имидная группа – входит в структуру производных пиримидин-2,4,6-триона – барбитуратов (барбитал, бензонал, фенобарбитал), пиримидин-2,4-диона (метилурацил, фторурацил, фторафур), ксантина (теобромин), 5-нитрофурана (фурадонин).
Сульфамидная группа – входит в структуру бензолсульфаниламидов и их производных: сульфаниламидов (стрептоцид, сульфацил-натрий, норсульфазол, фталазол), производных амида хлорбензолсульфоновой кислоты (фуросемид, дихлотиазид), замещённых сульфонилмочевины (бутамид, глибенкламид).
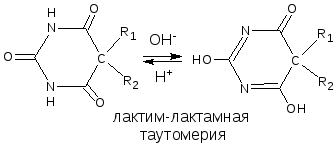
ЛВ, содержащие имидную группу, обладают слабыми кислотными свойствами, т. к. электронная плотность с атома азота смещена к атомам кислорода карбонильных групп вследствие чего водород при нём приобретает подвижность.
Для соединений, содержащих имидную группу характерна лактим-лактамная таутомерия.
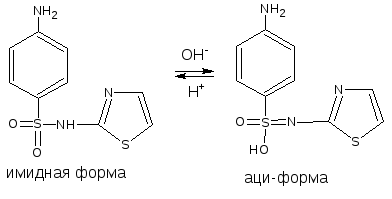
ЛВ, содержащие сульфамидную группу, также являются слабыми кислотами, что обусловлено электроноакцепторными свойствами сульфогруппы и связанным с ними перераспределением электронной плотности. В соответствии с этим сульфамиды могут находиться в двух таутомерных формах.
В анализе ЛВ, содержащих имидную и сульфамидную группы, используются реакции, в основе которых лежат их кислотные свойства.
Идентификация
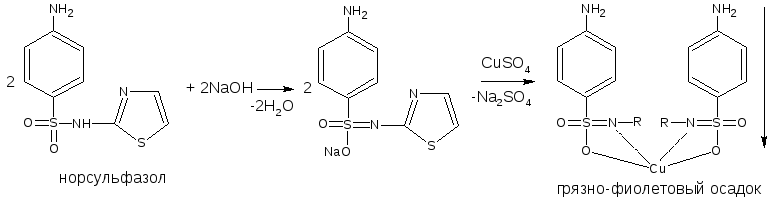
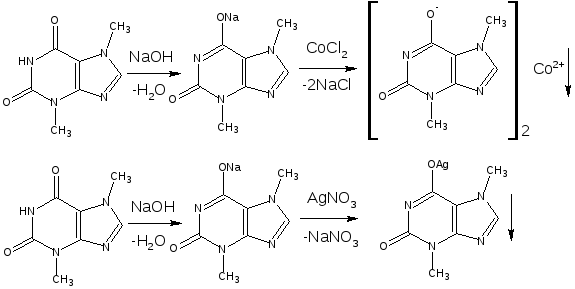
10.1.Реакция с ионами тяжёлых металлов – меди (II), кобальта (II), серебра (I)
В результате образуются, как правило, труднорастворимые комплексные соли. Эти реакции являются фармакопейными, широко используются также во внутриаптечном контроле лекарственных форм, содержащих барбитураты и сульфаниламиды. Различная окраска медных солей позволяет дифференцировать барбитураты и сульфаниламиды (табл. 1 и 2).
Таблица 1.
Эффект реакции барбитуратов с раствором меди сульфата
|
Название ЛВ |
Эффект реакции |
|
барбитал барбитал-натрий |
синее окрашивание, затем осадок красно-сиреневого цвета |
|
фенобарбитал |
осадок бледно-сиреневого цвета, не изменяющийся при стоянии. |
|
бензонал |
серо-голубой осадок |
|
гексенал |
голубое окрашивание, переходящее в ярко-синее, затем выпадает белый осадок |
При выполнении реакции кислотные формы предварительно растворяют в растворе щёлочи (не должно быть избытка), а затем прибавляют раствор соответствующего реактива; солевые формы растворяют в воде.
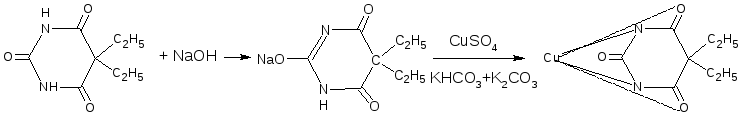
Таблица 2.
Эффект реакции сульфаниламидов с раствором меди сульфата
|
Название ЛВ |
Эффект реакции |
|
стрептоцид |
раствор голубого цвета |
|
сульфацил-натрий |
осадок голубовато-зелёного цвета, не изменяющийся при стоянии |
|
норсульфазол |
осадок грязно-фиолетового цвета |
|
сульфадимезин |
осадок желтовато-зелёного цвета, переходящего в коричневый |
Реакции с солями кобальта и серебра рекомендованы ГФ для идентификации теобромина: с хлоридом кобальта он даёт бистро исчезающее фиолетовое окрашивание, затем осадок серовато-голубого цвета; с нитратом серебра образует густую желатинообразную массу, которая разжижается при нагревании и снова застывает при охлаждении.
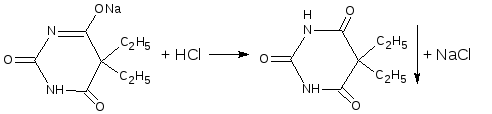
10.2. Реакция вытеснения кислотной формы
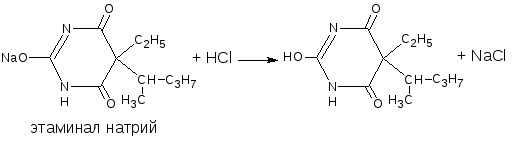
Основана на вытеснении слабой органической кислоты из её соли. Используется в фармакопейном анализе для идентификации натриевых солей барбитуратов (барбитал-натрий, этаминал-натрий, гексенал). Выделяющиеся органические кислоты отделяют, высушивают и определяют температуру плавления.
Количественное определение
10.3. Алкалиметрический метод
Вариант нейтрализации, способ прямого титрования. Основан на кислотных свойствах ЛВ, содержащих имидную или сульфамидную группы. Определение проводят в водно-спиртовом или водно-ацетоновом растворе.
Метод используется во внутриаптечном контроле (фенобарбитал, барбитал, норсульфазол), является фармакопейным (бутамид). М.э. = М.м.

При определении фталазола (способ обратного титрования) нейтрализация протекает по сульфамидной и карбоксильным группам.
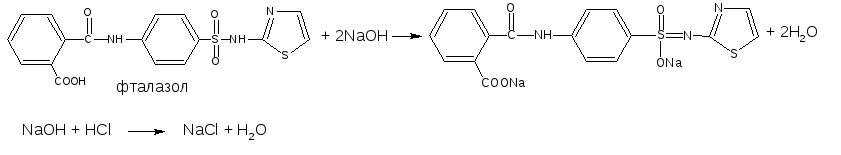
М.э. = ½ М.м.
10.4. Кислотно-основное титрование в протофильном растворителе
При анализе соединений, обладающих очень слабыми кислотными свойствами, определение проводят в среде протофильного растворителя – диметилформамида (ДМФА). Метод применяется в фармакопейном анализе (барбитал, фенобарбитал, бензонал, фталазол, метилурацил, фторурацил). Титрант – раствор натрия гидроксида в смеси метанола и бензола. Индикатор – тимоловый синий. М.э. = М.м.
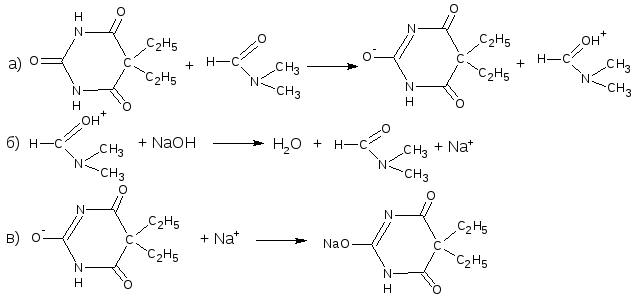
М.э. = М.м.
10.5. Ацидиметрический метод
Способ прямого титрования. Основан на вытеснении слабых органических кислот из их солей сильной минеральной кислотой (титрант). Метод используется в количественном определении солевых форм препаратов в фармакопейном анализе (барбитал-натрий, этаминал-натрий) и во внутриаптечном контроле (сульфацил-натрий, барбитал-натрий, этаминал-натрий). Индикатор метиловый оранжевый. Среда – диэтиловый эфир.
М.э. = М.м.
10.6. Аргентометрический метод
Способ прямого титрования. Основан на количественном взаимодействии производных пиримидин-2,4,6-триона (барбитуратов) с серебра нитратом, с образованием растворимых однозамещённых серебряных солей. Во внутриаптечном контроле определение обычно проводят в среде натрия карбоната или тетрабората, индикация осуществляется по появлению устойчивой мути – осадка двузамещённой серебряной соли (титрование без индикатора). М.э. = ½ М.м.
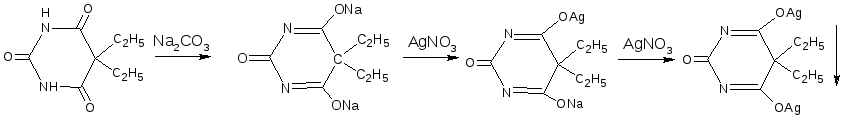
При определении в присутствии индикатора калия хромата (среда слабощелочная) сначала осаждается двузамещённая серебряная соль, затем избыточная капля титранта реагирует с индикатором, образуя осадок кирпично-красного цвета.
10.7. Алкалиметрический метод
Вариант нейтрализации, способ косвенного определения. Основан на свойстве соединений, содержащих подвижный атом водорода в имидной группе, образовывать труднорастворимые соли серебра, что сопровождается выделением эквивалентного количества кислоты, которую определяют алкалиметрически. Метод является фармакопейным (теобромин) и используется во внутриаптечном контроле (теобромин, метилурацил).
10.8. Фотоколориметрия и спектрофотометрия
На основе реакций комплексообразования с ионами меди (II) и кобальта (II). Поскольку образующиеся комплексные соли, как правило, нерастворимы в воде, определение ведут в присутствии органического растворителя.
