
- •2 Кислотно-основные методы
- •2.1 Краткие теоретические основы метода
- •2.1.1 Кислотно-основное взаимодействие
- •Классификация кислот и оснований в зависимости от величины их рКа
- •Величины рКа оснований в различных растворителях
- •2.1.2 Титрованные растворы
- •Титранты кислотно-основного метода
- •2.1.3 Установление конца титрования с помощью визуальных индикаторов
- •Интервал перехода окраски и показателя титрования кислотно-основных индикаторов
- •Данные для эмпирического выбора индикатора при кислотно-основном титровании
- •Интервалы рН и изменение цвета индикаторов (гф XI, вып.2, стр. 102)
- •2.1.4 Определение ингредиентов многокомпонентных лекарственных форм
- •2.1.5 Варианты и способы кислотно-основного титрования
- •2.2 Ацидиметрия
- •2.2.1 Вариант нейтрализации
- •2.2.2 Вариант вытеснения
- •2.2.3 Вариант гидролитического разложения
- •2.3.2 Вариант вытеснения
- •2.3.3 Вариант гидролитического разложения
- •2.3.4 Косвенное титрование
- •Соле- и комплексообразование
- •Конденсация
- •2.4 Титрование в неводных растворителях
- •Примеры дифференцирующего действия растворителя
- •Пример нивелирующего действия растворителя
- •2.4.1 Титрование в среде протогенных растворителей. Ацидиметрия
- •Определение кофеина
- •Определение изониазида
- •Определение дибазола
- •Определение атропина сульфата
- •2.4.2 Титрование в среде протофильных растворителей. Алкалиметрия
- •Определение теобромина
- •Определение фталазола
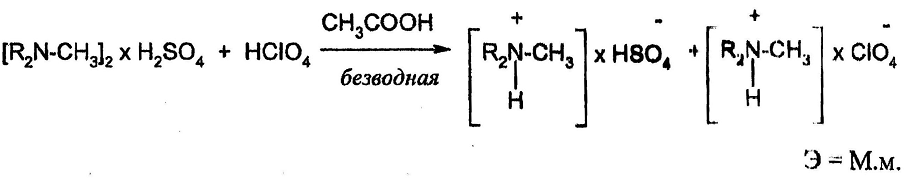
Определение атропина сульфата
Особенность представляет определение атропина сульфата, который в процессе титрования образует две соли – перхлорат и гидросульфат.

HClO4 + CH3COOH → ClO4- + CH3COOH2+

CH3COO- + CH3COOH2+ → 2 CH3COOH
С уммарно:
уммарно:
Методом кислотно-основного титрования можно проводить количественный анализ солей, образованных сильными минеральными основаниями и слабыми органическими кислотами, например калия ацетат, калия гидрофталат и др.
CH3COOK
+ CH3COOH
![]() (CH3COOKH)+
+ CH3COO-
(CH3COOKH)+
+ CH3COO-
HClO4
+ CH3COOH
![]() ClO4-
+ CH3COOH2+
ClO4-
+ CH3COOH2+
(CH3COOKH)+
+ ClO4-
![]() KClO4-
+ CH3COOH
KClO4-
+ CH3COOH
CH3COO- + CH3COOH2+ → 2CH3COOH

Суммарно:
CH3COOK
+ HClO4
![]() KClO4
+ CH3COOH
KClO4
+ CH3COOH
Э = М.м.
2.4.2 Титрование в среде протофильных растворителей. Алкалиметрия
По этому методу определяют лекарственные соединения, обладающие, слабыми кислотными свойствами. К этой группе лекарственных веществ относятся карбоновые кислоты, фенолы, барбитураты (барбитал, фенобарбитал), сульфаниламиды, производные урацила (метилурацил, фторурацил), ксантина (теобромин, теофиллин), 5-нитрофурана (фурадонин).
В качестве титрантов в неводной алкалиметрии используют растворы едкого натра и едкого кали, метилата натрия или лития, приготовленных в смеси метилового спирта и бензола.
В случае титрования кислот с рКА= 7-8 используют растворы щелочей, а при определении соединений обладающих более слабыми кислотными свойствами (теобромин, теофиллин, фурадонин, фенолы) в качестве титранта используется метилат натрия (лития).
Индикаторы – тимоловый синий, бромтимоловый синий (переход окраски от желтой до голубой).
Для усиления кислотных свойств анализируемых лекарственных веществ используют протофильные растворители – растворители основного характера, содержащие свободную электронную пару, способные отнимать протон у анализируемого вещества и тем самым способствовать его ионизации. К таким растворителям относятся диметилформамид (ДМФА), пиридин, этилендиамин. Наиболее часто используется ДМФА, но в случае очень слабых кислот, например, фенолов – применяют этилендиамин, обладающий более сильными основными свойствами, чем ДМФА.
Примеры
Определение лекарственных веществ, содержащих имидную группу (барбитураты-кислоты, метилурацил, фторурацил, теобромин, фурадонин)
I. Растворение и ионизация определяемого вещества

II. Солеобразование
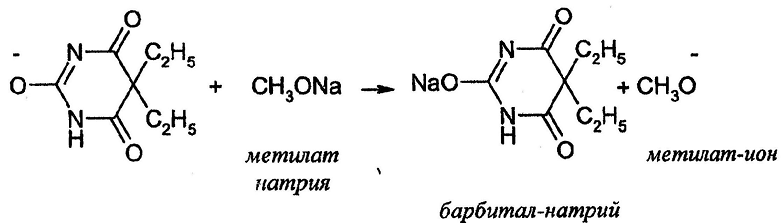
III. Регенерация растворителя


Суммарно:

Определение теобромина


С уммарно:
уммарно:

Определение соединений, содержащих другие функциональные группы, обладающие кислотными свойствами.Например, титрование сульфаниламидов.
Определение фталазола




Суммарно:

Определение лекарственных соединений содержащих фенольный гидроксил.



Суммарно:

Оба способа неводного титрования как ацидиметрия, так и алкалиметрия требуют постановки контрольного опыта.
Метод титрования в неводных средах является фармакопейным и применяется для количественного определения субстанций лекарственных веществ, обладающих слабыми кислотными или слабыми основными свойствами, а также их лекарственных форм: таблеток, растворов для инъекций (растворы для инъекций предварительно упаривают до получения сухого остатка).
Метод титрования в неводных средах имеет ряд достоинств и ограничений.
К достоинствам следует отнести следующие:
Позволяет проводить анализ слабых и очень слабых кислот и оснований, в том числе нерастворимых в воде.
Дает возможность унифицировать методики количественного определения для большой группы лекарственных веществ.
Метод специфичен, т.к. определение ведется по фармакологически активной части молекулы.
Возможно титрование смесей веществ, обладающих однотипными свойствами (кислотными или основными).
Ограничения(негативные стороны):
Физиологическое действие растворителей. Органические растворители небезразличны для организма человека и оказывают раздражающее действие на кожу, слизистую оболочку глаза, дыхательных путей (кислоты и их ангидриды), печень (галогенсодержащие растворители), вызывают головную боль (пиридин) и другие нежелательные эффекты.
Хлорная кислота взрывоопасна.
Растворы ацетата ртути, применяемые в высоких концентрациях при титровании галогенводородных солей азотистых оснований, являясь ядовитыми, способны кумулировать в организме и вызывать тяжелые отравления при неосторожном обращении с ними.
Требуется тщательная подготовка растворителей, защита титрантов (особенно основного характера) от атмосферных влияний, хорошие вентиляционные установки.
Органические растворители имеют значительно более высокую стоимость, чем вода очищенная.
Ценность метода снижается при анализе лекарственных форм, приготовленных на воде (растворы, микстуры, растворы для инъекций). В этом случае приходится прибегать к длительной операции выпаривания воды из лекарственных форм.
Метод не позволяет получить объективную информацию о качестве лекарственных веществ, подверженных в условиях хранения водных лекарственных форм или в процессе стерилизации гидролитическому разложению (например, вещества со сложноэфирной группой) и другим видам разрушения.
